Влияние аглютеновой диеты на метаболическую активность кишечной микробиоты у больных целиакией
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Обследован 61 больной целиакией, подтвержденной положительными серологическими тестами и гистологическим исследованием слизистой оболочки тонкой кишки, из них было 17 (13,7%) мужчин (медиана возраста – 41 год) и 44 (86,3%) женщины (медиана возраста – 45 лет). В первую группу были включены больные с впервые выявленной целиакией (n = 21); во вторую группу – пациенты, соблюдающие АГД, осознанно или неосознанно нарушающие ее (n = 20); третью группу составили пациенты, строго соблюдающие АГД (n = 20). Длительность диетического лечения больных второй группы составляла от шести месяцев до семи лет, у больных третьей группы – от одного года до восьми лет.
Уровень КЖК в кале определяли методом газожидкостной хроматографии на хроматографе «Кристалл 2000 М». Контрольную группу составили 22 здоровых добровольца, среди них было 6 (27,3%) мужчин, 16 (72,7%) женщин, медиана возраста составила 42 года (Q1–Q3: 32–58 лет; Shapiro p-value < 0,01). Статистический анализ проводили с помощью параметрического и непараметрического методов по программе Statistica 13.3 (StatSoft Inc., США).
Результаты. Общий уровень КЖК в копрофильтрате больных первой группы был несколько выше, чем в группе контроля (13,15 ± 1,52 vs 9,8 ± 2,1 мг/г; р = 0,278), анаэробный индекс – достоверно выше (1,43 ± 0,23 vs 0,754 ± 0,15 мг/г; р = 0,017), что указывало на повышение метаболической активности анаэробных бактерий. Достоверные различия у больных первой группы и группы контроля были получены в уровнях пропионовой кислоты (3,85 ± 0,62 vs 1,65 ± 0,46 мг/г; р = 0,006); изомасляной кислоты (0,67 ± 0,1 vs 0,28 ± 0,1 мг/г; p = 0,009) и валериановой кислоты (0,83 ± 0,13 vs 0,32 ± 0,09 мг/г; р = 0,002).
У больных второй группы установлено достоверное снижение общего количества КЖК по сравнению с группой контроля (4,6 ± 0,9 vs 9,8 ± 2,1 мг/г; p = 0,034). Также во второй группе по сравнению с контрольной группой выявлено достоверное снижение концентрации уксусной кислоты (1,9 ± 1,2 vs 5,36 ± 1,1 мг/г; р = 0,045). Уровень изовалериановой кислоты был повышен во второй группе по сравнению с третьей группой (0,66 ± 0,14 vs 0,22 ± 0,13 мг/г; р = 0,04),
а уровень концентрации капроновой кислоты был снижен (0,05 ± 0,1 vs 0,35 ± 0,1 мг/г; p = 0,04). Эти данные косвенно указывали на уменьшение количества представителей сахаролитической микрофлоры во второй группе.
Заключение. При изучении спектра и концентрации КЖК в кале у больных целиакией, находящихся на разных этапах лечения АГД и восстановления слизистой оболочки тонкой кишки, наблюдается тенденция к разнонаправленной метаболической активности толстокишечной микробиоты.
По мере соблюдения АГД уменьшается общий уровень КЖК, происходит сдвиг в соотношении анаэробов и аэробных бактерий, увеличивается уровень изовалериановой кислоты и наблюдается тенденция к повышению изомасляной кислоты, снижается уровень уксусной и капроновой кислот. Для оптимизации лечения больных целиакией требуется дальнейший мониторинг метаболической активности кишечной микробиоты в процессе динамического наблюдения.
Материал и методы. Обследован 61 больной целиакией, подтвержденной положительными серологическими тестами и гистологическим исследованием слизистой оболочки тонкой кишки, из них было 17 (13,7%) мужчин (медиана возраста – 41 год) и 44 (86,3%) женщины (медиана возраста – 45 лет). В первую группу были включены больные с впервые выявленной целиакией (n = 21); во вторую группу – пациенты, соблюдающие АГД, осознанно или неосознанно нарушающие ее (n = 20); третью группу составили пациенты, строго соблюдающие АГД (n = 20). Длительность диетического лечения больных второй группы составляла от шести месяцев до семи лет, у больных третьей группы – от одного года до восьми лет.
Уровень КЖК в кале определяли методом газожидкостной хроматографии на хроматографе «Кристалл 2000 М». Контрольную группу составили 22 здоровых добровольца, среди них было 6 (27,3%) мужчин, 16 (72,7%) женщин, медиана возраста составила 42 года (Q1–Q3: 32–58 лет; Shapiro p-value < 0,01). Статистический анализ проводили с помощью параметрического и непараметрического методов по программе Statistica 13.3 (StatSoft Inc., США).
Результаты. Общий уровень КЖК в копрофильтрате больных первой группы был несколько выше, чем в группе контроля (13,15 ± 1,52 vs 9,8 ± 2,1 мг/г; р = 0,278), анаэробный индекс – достоверно выше (1,43 ± 0,23 vs 0,754 ± 0,15 мг/г; р = 0,017), что указывало на повышение метаболической активности анаэробных бактерий. Достоверные различия у больных первой группы и группы контроля были получены в уровнях пропионовой кислоты (3,85 ± 0,62 vs 1,65 ± 0,46 мг/г; р = 0,006); изомасляной кислоты (0,67 ± 0,1 vs 0,28 ± 0,1 мг/г; p = 0,009) и валериановой кислоты (0,83 ± 0,13 vs 0,32 ± 0,09 мг/г; р = 0,002).
У больных второй группы установлено достоверное снижение общего количества КЖК по сравнению с группой контроля (4,6 ± 0,9 vs 9,8 ± 2,1 мг/г; p = 0,034). Также во второй группе по сравнению с контрольной группой выявлено достоверное снижение концентрации уксусной кислоты (1,9 ± 1,2 vs 5,36 ± 1,1 мг/г; р = 0,045). Уровень изовалериановой кислоты был повышен во второй группе по сравнению с третьей группой (0,66 ± 0,14 vs 0,22 ± 0,13 мг/г; р = 0,04),
а уровень концентрации капроновой кислоты был снижен (0,05 ± 0,1 vs 0,35 ± 0,1 мг/г; p = 0,04). Эти данные косвенно указывали на уменьшение количества представителей сахаролитической микрофлоры во второй группе.
Заключение. При изучении спектра и концентрации КЖК в кале у больных целиакией, находящихся на разных этапах лечения АГД и восстановления слизистой оболочки тонкой кишки, наблюдается тенденция к разнонаправленной метаболической активности толстокишечной микробиоты.
По мере соблюдения АГД уменьшается общий уровень КЖК, происходит сдвиг в соотношении анаэробов и аэробных бактерий, увеличивается уровень изовалериановой кислоты и наблюдается тенденция к повышению изомасляной кислоты, снижается уровень уксусной и капроновой кислот. Для оптимизации лечения больных целиакией требуется дальнейший мониторинг метаболической активности кишечной микробиоты в процессе динамического наблюдения.

Введение
В патогенезе симптомов целиакии определенную роль играет избыточная микробиота кишечника, росту которой способствует большое количество недопереваренных компонентов пищи [1]. В процессе ее микробного метаболизма в толстой кишке образуются короткоцепочечные жирные кислоты (КЖК) [2]. При изучении спектра и концентрации КЖК кала у больных целиакией, находящихся на разных этапах лечения аглютеновой диетой (АГД) и восстановления слизистой оболочки тонкой кишки (СОТК), наблюдается тенденция к разнонаправленной метаболической активности толстокишечной микробиоты. Для оптимизации лечения больных целиакией требуется дальнейший мониторинг метаболической активности кишечной микробиоты в процессе динамического наблюдения [1, 3].
Правильное соотношение и достаточное количество КЖК необходимо для обеспечения нормальной функции эпителиоцитов тонкой и толстой кишок, иммунной системы, регуляции pH в просвете кишечника, выработки слизи, обеспечения питания эпителиальных клеток [3]. Отдельные виды КЖК, например масляная кислота, играют важную роль в питании и поддержании целостности клеток кишечника, всасывании воды, электролитов, а также оказывают противовоспалительный эффект [1, 4]. Микробиом кишечника помогает осуществлять конечный обмен нутриентов (синтез биологически активных веществ, витаминов и др.), участвовать в микробном пищеварении и формировании иммунной защиты.
С другой стороны, у части больных целиакией даже при восстановлении структуры СОТК сохраняются вздутие, урчание, дискомфорт в животе и диарея. Причиной указанных симптомов может служить избыточная активность условно-патогенной микрофлоры и угнетение отдельных видов микробов, сопровождающееся дефицитом синтеза КЖК. Поэтому определение спектра и концентрации КЖК в кале может служить одним из методов оценки избыточного бактериального роста [4, 5].
Нарушение метаболической активности кишечной микрофлоры, количества и соотношения КЖК оказывает негативное воздействие на слизистую оболочку кишечника, что может отразиться на процессах полноценного усвоения нутриентов и являться причиной персистенции клинических симптомов.
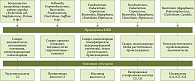
Известно, что определенный вид и род микробного сообщества синтезирует определенный тип КЖК [2]. На рисунке показаны основные продуценты КЖК и субстраты.
Присутствие или отсутствие глютена в рационе может изменить разнообразие и пропорции микробных сообществ, составляющих микробиоту кишечника. Существует тесная связь между метаболизмом глютена, патофизиологией целиакии и кишечной микробиотой; их взаимодействие определяет здоровье и гомеостаз кишечника [5, 6].
Так как основной этиотропной терапией целиакии является полное исключение из пищевого рациона пшеницы, ржи, ячменя, которые являются питательными субстратами для кишечной микрофлоры, можно предполагать сдвиг в ее видовой и метаболической активности. Поэтому в основе неполного ответа на лечение может лежать не только строгая приверженность АГД, но и определенный дисбаланс кишечной микрофлоры [1, 7–9].
Следовательно, важным условием повышения эффективности лечебно-реабилитационных программ при целиакии может быть мониторинг и коррекция микробиома кишечника и его метаболической активности в условиях безглютеновой диеты [10, 11].
Цель – изучить влияние АГД на спектр и концентрацию КЖК кислот в кишечнике у больных целиакией.
Материал и методы
В отделении невоспалительной патологии кишечника Московского клинического научно-практического центра им. А.С. Логинова обследован 61 пациент с целиакией. Диагноз подтвержден данными серологических тестов и гистологическим исследованием СОТК, полученной из дистального отдела двенадцатиперстной кишки. Медиана возраста обследованных больных составила 45 лет (Q1–Q3: 36–61 год; Shapiro p-value < 0,01). Количество мужчин составило 17 (13,7%) человек, медиана возраста – 41 год; женщин – 44 (86,3%), медиана возраста – 45 лет. В исследование были включены только пациенты, не получавшие в течение месяца лечения пробиотиками, антибиотиками и противомикробными препаратами.
Контрольную группу из практически здоровых 22 человек составили шестеро мужчин и 16 женщин. Медиана возраста их составила 42 года (Q1–Q3: 32–58 лет; Shapiro p-value < 0,01).
В программе лечения и реабилитации пациентов с целиакией приверженность АГД имеет приоритетное значение. В зависимости от тщательности ее соблюдения больные были разделены на три группы. В первую группу были включены больные с впервые выявленной целиакией (n = 21). Во вторую группу включены больные, придерживающиеся АГД, но осознанно или неосознанно нарушающие ее (n = 20). В третью группу вошли 20 пациентов с ранее установленным диагнозом «целиакия», строго соблюдающие АГД. Длительность диетического лечения больных второй группы составляла от шести месяцев до семи лет, больных третьей группы – от одного года до восьми лет.
Уровень антител к тканевой трансглутаминазе иммуноглобулинов IgA и IgG в сыворотке крови определяли с помощью коммерческих наборов Orgentec Diagnostics, GmbH с использованием иммуноферментного метода ELISA. Всем больным проводили эзофагогастродуоденоскопию с последующим морфологическим исследованием СОТК для окончательной верификации диагноза.
КЖК (уксусную, пропионовую, масляную, валериановую, капроновую, а также их изопроизводные изомасляную, изовалериановую кислоты) определяли в копрофильтратах методом газожидкостной хроматографии на хроматографе «Кристалл 2000 М» (Хроматек, Россия).
Статистический анализ проводили по программе Statistica 13.3 (StatSoft Inc., США). Систематизацию исходной информации осуществляли в электронных таблицах Microsoft Office Excel 2016. Статистическую обработку полученных результатов проводили с использованием методов параметрического и непараметрического анализа. Количественные показатели оценивали на предмет соответствия нормальному распределению с использованием критериев Шапиро – Уилка. Совокупности количественных показателей, отличающихся от нормального распределения, описывали при помощи значений медианы (Me) и межквартильного интервала [25-й; 75-й перцентили], качественные признаки – в виде абсолютного значения и процента. Различия между группами считали статистически значимыми при вероятности справедливости нулевой гипотезы об отсутствии различий между группами (р < 0,05).
Результаты и обсуждение
Для выявления различий и особенностей спектра КЖК у больных с впервые выявленной целиакией (первая группа) определяли общий уровень КЖК, концентрацию уксусной, пропионовой, масляной, изомасляной, валериановой, изовалериановой и капроновой кислот, а также анаэробный индекс (АИ) как отношение концентраций всех КЖК, кроме уксусной, к концентрации уксусной кислоты.
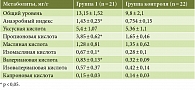
В таблице 1 показано содержание КЖК в копрофильтратах у пациентов с впервые выявленной целиакией (первая группа) и у лиц контрольной группы.
Как видно из табл. 1, общий уровень КЖК в копрофильтрате больных с впервые выявленной целиакией (первая группа) оказался несколько выше по сравнению с группой контроля (13,15 ± 1,52 vs 9,8 ± 2,1 мг/г), однако статистической достоверности не выявлено (р = 0,278).
Обнаружено достоверное повышение уровня основных КЖК: пропионовой кислоты (3,85 ± 0,62 vs 1,65 ± 0,46 мг/г; р = 0,006); изомасляной кислоты (0,67 ± 0,1 vs 0,28 ± 0,1 мг/г; p = 0,009) и валериановой кислоты (0,83 ± 0,13 vs 0,32 ± 0,09 мг/г; р = 0,002) по сравнению с группой контроля.
Причиной изменения спектра КЖК за счет пропионовой, валериановой и изокислот могло быть увеличение объема химуса вследствие экссудативной диареи у больных с тотальной атрофией ворсинок СОТК и повышенной метаболической активностью микрофлоры толстой кишки.
Особое внимание мы уделяли АИ – соотношению анаэробных и аэробных микроорганизмов внутри микробного сообщества кишечника. Выявлено достоверное повышение АИ в группе пациентов с впервые выявленной целиакией (первая группа) (1,43 ± 0,23 vs 0,754 ± 0,15 мг/г; р = 0,017), что указывает на повышение у них метаболической активности анаэробных бактерий, таких как Bacteroides, Fusobacterium, Propionibacterium [11]. Возможным вариантом коррекции выявленных нами нарушений микробиома может быть назначение противомикробных препаратов. Это будет способствовать купированию кишечных симптомов, связанных с избыточной метаболической активностью бактерий, заселяющих толстую кишку.
Особый интерес представляют изменения профиля и спектра КЖК у больных, соблюдающих АГД. Исключение из рациона белков злаковых, повышенное содержание цельной клетчатки оказывает положительный этиотропный эффект на СОТК, но, с другой стороны, уменьшение поступающего субстрата в просвет толстой кишки может влиять на разнонаправленные изменения метаболической активности отдельных видов толстокишечной микробиоты.
В таблице 2 показаны различия и особенности спектра КЖК у больных целиакией в зависимости от тщательности соблюдения ими АГД.
Из таблицы 2 следует, что у больных, строго соблюдающих диету (группа 2), достоверно снижено общее количество КЖК по сравнению с группой контроля (4,6 ± 0,9 vs 9,8 ± 2,1 мг/г, p = 0,049), в группе больных, допускающих частичное употребление глютенсодержащих продуктов, определяется тенденция к снижению общего уровня КЖК (7,74 ± 1,26 vs 9,8 ± 2,1 мг/г). В этих же группах выявлены достоверные различия по отдельным видам метаболитов – в концентрации уксусной кислоты (1,9 ± 1,2 vs 5,36 ± 1,1 мг/г; р = 0,04). Концентрация изовалериановой и капроновой кислот достоверно различалась во второй и третьей группах больных соответственно (0,66 ± 0,14 vs 0,22 ± 0,14 мг/г; р = 0,04) и (0,05 ± 0,1 vs 0,35 ± 0,1 мг/г; p = 0,004). Наблюдалась тенденция к повышению изомасляной кислоты во второй группе. Общий уровень КЖК и уровни основных метаболитов достоверно не различались у больных в третьей группе и группе контроля.
Обсуждение
В результате обследования больных, соблюдающих АГД от полугода до семи лет, установлено изменение состава кишечной микрофлоры по показателям спектра КЖК кала.
Выраженность кишечных симптомов у пациентов с целиакией зависит от количества поступающих растительных субстратов и степени их ферментации, осуществляемой микробами Peptostreptococcus, Clostridium, Candida, обладающими протеолитической активностью [12–14].
Пациенты, строго соблюдающие АГД, в основном придерживаются рациона с преобладанием белков животного происхождения, при этом ограничивают потребление комбинированных блюд и клетчатки злаковых, что приводит к уменьшению количества представителей сахаролитической кишечной микрофлоры. Косвенно это подтверждается достоверным снижением концентрации уксусной кислоты у пациентов второй группы по сравнению с пациентами группы контроля (1,9 ± 1,2 vs 5,36 ± 1,1 мг/г; р < 0,05) и статистически значимым повышением уровня изовалериановой и капроновой кислот, а также тенденцией к повышению уровня изомасляной кислоты как основных метаболитов протеолитической микрофлоры по сравнению с контрольной группой.
При целиакии развивается синдром нарушенного всасывания и в толстую кишку поступает большое количество химуса, поэтому в ней повышается активность микробиоты с индивидуальной устойчивостью к влиянию различных факторов (пищевые нагрузки, контакт с компонентами химуса и т.д.). При этом, как было нами показано, возникают определенные сдвиги внутри спектра метаболитов. В частности, достоверно снижается концентрация уксусной и капроновой кислот и повышается уровень изовалериановой кислоты.
Уровень КЖК в кале отражает сложный процесс взаимосвязи в организме больного микробиоты его кишечника и особенностей питания [2, 15]. При целиакии происходит полная или частичная атрофия ворсинок СОТК, степень выраженности которой обусловливает формирование клинических проявлений заболевания, синдромов мальабсорбции и экссудативной диареи. Для этих процессов характерно значительное повышение объема химуса, который усиленно метаболизируется кишечной микрофлорой. При наличии значительного количества субстрата для его ферментации сахаролитическая микрофлора толстой кишки продуцирует большое количество метаболитов, что подтверждается повышением в кишечнике общего количества КЖК. Ускоренный пассаж по кишечнику, обусловленный патогенетическими механизмами целиакии, также способствует изменению состава микробного сообщества [1, 16, 17]. Измененный спектр и концентрация КЖК отражают состав микроорганизмов в основном в толстой кишке. Однако концентрация КЖК в фекалиях также зависит от наличия ферментируемых субстратов.
У больных целиакией с впервые установленным диагнозом, еще не исключивших из рациона глютен, наблюдается активизация сахаролитической флоры, что подтверждается достоверными различиями по уровню пропионовой, изомасляной и валериановой кислот по сравнению с группой контроля. Эти результаты соответствуют данным I. Bertini и соавт., свидетельствующим об измененном микробном пейзаже больных целиакией, причем для устранения дисбиотических явлений, по мнению авторов, требуется более года [18]. Измененное соотношение КЖК у больных с впервые выявленной целиакией до начала лечения, возможно, влияет на тяжесть клинических проявлений и в процессе динамического наблюдения требует коррекции. Так, некоторые авторы указывают на значимое влияние концентрации пропионовой кислоты на состояние энтероцитов [19].
АГД является диетой, при которой нарушается соотношение основных нутриентов: повышается содержание жиров и снижается потребление клетчатки, в связи с чем возникает большая вероятность развития избыточного бактериального роста в тонкой кишке [8, 20, 21].
В дополнение к сказанному заметим, что АГД как таковая может быть связана с потенциально опасными изменениями в микробиоте, такими как уменьшение богатства микробиоты, уменьшение количества бифидобактерий, лактобактерий, а также Faecalibacterium prausnitzii и увеличение количества Proteobacteria [10].
Исключение из рациона глютена ведет к восстановлению структуры СОТК, нормализации работы пищеварительно-транспортного конвейера, обеспечивающего ассимиляцию пищевых веществ. В то же время одними из основных субстратов, которые подвергаются микробному пищеварению в толстой кишке, являются сложные углеводы, в том числе и растительные белки, входящие в состав злаков. В результате их исключения из рациона может снижаться общая метаболическая активность толстокишечной микробиоты вследствие избирательного уменьшения количества ее отдельных видов.
В частности, наше исследование показало, что у пациентов, строго соблюдающих АГД, статистически достоверно повышается концентрация изовалериановой кислоты по сравнению с пациентами группы контроля, а также снижается концентрация уксусной и капроновой кислот. Вследствие исключения растительных белков глютена из рациона больных, строго соблюдающих АГД, ограничивается поступление субстрата для синтеза уксусной кислоты как одного из важных метаболитов, влияющих на активность микробиоты. Это необходимо учитывать диетологам при составлении рациона больных, находящихся на АГД.
Заключение
При изучении спектра и концентрации КЖК у больных целиакией, находящихся на разных этапах восстановления СОТК в результате лечения АГД, наблюдается тенденция к разнонаправленной метаболической активности толстокишечной микробиоты.
По мере соблюдения АГД уменьшался общий уровень КЖК, происходил сдвиг в соотношении анаэробов и аэробных бактерий, увеличивался уровень изовалериановой кислоты, наблюдалась тенденция к повышению уровня изомасляной и снижению уровня уксусной и капроновой кислот.
Для оптимизации лечения больных целиакией требуется динамический мониторинг метаболической активности кишечной микробиоты, а при составлении рациона больных, находящихся на АГД, необходимо наблюдение диетолога.
S.V. Bykova, PhD, E.A. Sabelnikova, PhD, S.Yu. Silvestrova, PhD, T.N. Kuzmina, PhD, E.V. Baulo, A.I. Parfenov, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Research Institute of Health Organization and Medical Management
Contact person: Svetlana V. Bykova, s.bykova@mknc.ru
The aim is to study the effect of the gluten-free diet (GFD) on the spectrum of short-chain fatty acids (SСFAs) in the intestine in patients with celiac disease.
Material and methods. 61 patients with celiac disease were examined, confirmed by positive serological tests and histological examination of the mucous membrane of the small intestine. Men were 17 (13.7%), median age – 41 years; women – 44 (86.3%), median age – 45 years. The first group included patients with newly diagnosed celiac disease (n = 21); the second group included patients who observe GFD, consciously or unconsciously violate it (n = 20); the third group consisted of patients who strictly observe GFD (n = 20). The duration of dietary treatment of patients of the second group ranged from two hundred months to seven years, in patients of the third group – from one year to eight years.The level of SСFAs in feces was determined by gas-liquid chromatography on the Crystal 2000 M chromatograph. The control group consisted of 22 healthy volunteers, among them were 6 (27.3%) men, 16 (72.7%) women, the median age was 42 years (Q1-Q3: 32–58 years; Shapiro p-value < 0.01). Statistical analysis was performed using parametric and nonparametric methods according to the Statistica 13.3 program (StatSoft Inc., USA).
Results. The total level of SCFAs in the coprofiltrate of patients of the first group was slightly higher than in the control group (13.15 ± 1.52 vs 9.8 ± 2.1 mg/g; p = 0.278), the anaerobic index was significantly higher (1.43 ± 0.23 vs 0.754 ± 0.15 mg/g; p = 0.017), which indicated an increase in the metabolic activity of anaerobic bacteria. Significant differences in patients of the first group and in the control group were obtained in the levels of propionic acid (3.85 ± 0.62 vs 1.65 ± 0.46 mg/g; p = 0.006); isobutyric acid (0.67 ± 0.1 vs 0.28 ± 0.1 mg/g; p = 0.009) and valerian acid (0.83 ± 0.13 vs 0.32 ± 0.09 mg/g; p = 0.002).
In patients of the second group, a significant decrease in the total amount of SCFAs was found compared with the control group (4.6 ± 0.9 vs 9.8 ± 2.1 mg/g; p = 0.034). Also, in the second group, compared with the control group, a significant decrease in the concentration of acetic acid was revealed (1.9 ± 1.2 vs 5.36 ± 1.1 mg/g; p = 0.045). The level of isovaleric acid was increased in the second group compared to the third group (0.66 ± 0.14 vs 0.22 ± 0.13 mg/g; p = 0.04), and the level of capronic acid concentration was reduced (0.05 ± 0.1 vs 0.35 ± 0.1 mg/g; p = 0.04). These data indirectly indicated a decrease in the number of representatives of the saccharolytic microflora in the second group.
Conclusion. When studying the spectrum and concentration of SCFAs in the feces of patients with celiac disease who are at different stages of treatment of GFD and recovery of MMSI, there is a tendency to multidirectional metabolic activity of the colonic microbiota. As the GFD is observed, the overall level of SCFAs decreases, there is a shift in the ratio of anaerobes and aerobic bacteria, the level of isovaleric acid increases and the tendency to increase isobutyric acid decreases, the level of acetic and caproic acids decreases. To optimize the treatment of patients with celiac disease, further monitoring of the metabolic activity of the intestinal microbiota in the process of dynamic observation is required.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.