Влияние дефицита интерферона α21 на иммунный статус и защиту от герпесвирусных инфекций
- Аннотация
- Статья
- Ссылки
- English
Цель – изучить уровень ИФН-α21 и его ассоциацию с показателями иммунного статуса и выделением ДНК герпесподобных вирусов из слизистых оболочек носоглотки и ротоглотки у часто болеющих детей.
Материал и методы. Обследованы 43 пациента в возрасте от полутора до 15 лет с частыми (более шести раз в год) острыми респираторными вирусными инфекциями, у которых были выделены ДНК герпесвирусов из носоглотки и ротоглотки.
В данной когорте определяли уровень ИФН-α21 и показатели стандартной иммунограммы.
Результаты. У детей со сниженным уровнем ИФН-α21 в отличие от детей с нормальными значениями показателя наблюдалось более высокое абсолютное количество Т-киллеров (884,8 против 616,7), натуральных киллеров (299,3 против 173,8), активных В-лимфоцитов (577,7 против 412,9). В группе с нормальным уровнем ИФН-α21 уровень общего иммуноглобулина E был повышен (82,6 против 38,7). При нормальном уровне ИФН-α21 достоверно чаще встречался вирус Эпштейна – Барр (77,7 против 41,2%), а при сниженном – персистенция вируса герпеса человека 6-го типа (85,1 против 66,6%).
Заключение. Выявлены две группы часто болеющих детей: одна – с дефицитом ИФН-α21 (напряжение эффекторного звена специфического иммунитета на фоне снижения неспецифического противовирусного барьера), другая – с нормальным уровнем ИФН-α21 (атопическая направленность воспаления), что позволяет индивидуализировать подход к терапии.
Цель – изучить уровень ИФН-α21 и его ассоциацию с показателями иммунного статуса и выделением ДНК герпесподобных вирусов из слизистых оболочек носоглотки и ротоглотки у часто болеющих детей.
Материал и методы. Обследованы 43 пациента в возрасте от полутора до 15 лет с частыми (более шести раз в год) острыми респираторными вирусными инфекциями, у которых были выделены ДНК герпесвирусов из носоглотки и ротоглотки.
В данной когорте определяли уровень ИФН-α21 и показатели стандартной иммунограммы.
Результаты. У детей со сниженным уровнем ИФН-α21 в отличие от детей с нормальными значениями показателя наблюдалось более высокое абсолютное количество Т-киллеров (884,8 против 616,7), натуральных киллеров (299,3 против 173,8), активных В-лимфоцитов (577,7 против 412,9). В группе с нормальным уровнем ИФН-α21 уровень общего иммуноглобулина E был повышен (82,6 против 38,7). При нормальном уровне ИФН-α21 достоверно чаще встречался вирус Эпштейна – Барр (77,7 против 41,2%), а при сниженном – персистенция вируса герпеса человека 6-го типа (85,1 против 66,6%).
Заключение. Выявлены две группы часто болеющих детей: одна – с дефицитом ИФН-α21 (напряжение эффекторного звена специфического иммунитета на фоне снижения неспецифического противовирусного барьера), другая – с нормальным уровнем ИФН-α21 (атопическая направленность воспаления), что позволяет индивидуализировать подход к терапии.
Введение
Острые респираторные вирусные инфекции (ОРВИ) – самая распространенная группа заболеваний в мире в целом [1, 2] и в России в частности [3, 4]. Практически каждый человек в течение жизни переносит эти заболевания неоднократно. Однако существует группа пациентов, особенно среди детей, у которых ОРВИ встречаются значительно чаще, чем в общей популяции. В отечественной практике таких детей принято называть часто болеющими. Первые критерии отнесения ребенка к этой группе были разработаны еще в 1986 г.: на первом году жизни перенесено четыре и более эпизода ОРВИ, в возрасте от одного года до трех лет – шесть и более эпизодов ОРВИ в год, от трех до пяти лет – пять и более эпизодов, старше пяти лет – три и более эпизода ОРВИ в течение года. Для отнесения ребенка к группе часто болеющих помимо числа случаев заболевания важны его продолжительность (более 14 дней), а также факт осложненного течения [5]. В настоящее время существуют различные модификации этих критериев, в том числе основанные на возрастных коэффициентах, но их значимость по-прежнему сохраняется [6].
По мнению экспертов Всемирной организации здравоохранения, здоровый ребенок раннего возраста может переносить до восьми ОРВИ в год. При более высоком уровне заболеваемости говорят о рекуррентных респираторных инфекциях (recurrent respiratory tract infections). Данный термин является функциональным эквивалентом российского термина «часто и длительно болеющие дети». К данной группе зарубежные авторы предлагают относить детей, которые на первом году жизни перенесли семь и более эпизодов ОРВИ, в возрасте от одного года до трех лет – восемь и более эпизодов ОРВИ в год, старше трех лет – шесть и более эпизодов ОРВИ в течение года. Дополнительными показаниями для включения в группу лиц с рекуррентными респираторными инфекциями являются рецидивирующий острый средний отит, риносинусит – три эпизода в течение шести месяцев или четыре эпизода в течение 12 месяцев, рецидивирующий фаринготонзиллит – шесть эпизодов в течение 12 месяцев [7–9]. Исходя из предполагаемого патогенеза частых ОРВИ, в последнее время все большее применение находит термин «иммунокомпрометированный пациент», также характеризующий эту группу больных [10]. Понятие «иммунокопрометированный» несколько шире понятия «часто и длительно болеющий». Так, к основным критериям иммунной компрометированности относятся [10, 11]:
- повторные ОРВИ различной этиологии;
- частые обострения хронического тонзиллита, синусита, фаринготрахеита, бронхита, повторные пневмонии;
- постинфекционный синдром астении, или синдром хронической усталости;
- частые рецидивы герпесвирусных инфекций, вызываемых герпесвирусами человека 1-го, 2-го и 3-го типов (вирусом простого герпеса 1-го типа, вирусом простого герпеса 2-го типа и вирусом ветряной оспы соответственно);
- атипично протекающие хронические активные герпесвирусные инфекции, вызываемые герпесвирусами 4, 5, 6 и 7-го типов (вирусом Эпштейна – Барр (ВЭБ), цитомегаловирусом (ЦМВ), вирусом герпеса человека 6-го типа (ВГЧ-6), вирусом герпеса человека 7-го типа (ВГЧ-7) соответственно), на фоне которых отмечаются астенизация, быстрая утомляемость и физическая истощаемость – непереносимость физической нагрузки, ранее хорошо переносимой, снижение работоспособности, когнитивные расстройства (нарушение памяти, концентрации внимания, «туманная голова» или «туманный мозг») [11];
- рецидивирующая гнойная инфекция кожи (хроническая пиодермия, фурункулез, в том числе абсцедирующий, и т.д.);
- тяжелые гнойно-бактериальные инфекции (сепсис, деструктивная пневмония, гематогенный остеомиелит, острый местный или разлитой перитонит и т.д.);
- рецидивирующие обострения хронических заболеваний различных органов и систем.
Таким образом, любой иммунокомпрометированный пациент относится к часто и длительно болеющим, но не любой часто и длительно болеющий относится к иммунокомпрометированным пациентам. Одним из маркеров ослабления противовирусной иммунной защиты является активное выделение ДНК вирусов герпеса в секретах.
Первой линией противовирусного иммунитета является система интерферонов (ИФН). Ее дисбаланс считается краеугольным камнем иммунопатогенеза вирусных инфекций. Зачастую данный дисбаланс связан не только с врожденными, генетически обусловленными дефектами, так называемыми врожденными ошибками иммунитета, но и с приобретенными нарушениями регуляции системы ИФН на разных уровнях: рецепторном, молекулярном, ядерного трансмиттера передачи сигнала. Установлено, что интервенция вирусов нарушает функциональную активность системы ИФН, что лежит в основе развития иммунопатогенеза как инфекционных заболеваний, так и аутоиммунных синдромов и процессов посредством аберрантной активации воспалительных реакций или неадекватного контроля течения вирусной инфекции. Таким образом, адекватность ответа системы ИФН на вирусные стимулы определяет эффективность иммунного реагирования, что способствует элиминации вируса [12].
Изменения интерферонового статуса в целом у часто болеющих детей изучены достаточно давно [13–15]. Однако роль конкретных фракций интерферонов оценена недостаточно. Так, на сегодняшний день подтверждены различия их противовирусной эффективности в зависимости от органа-мишени, конкретного вида и даже штамма вируса [16], а также разная активность в отношении активации Т-киллеров [17]. В контексте иммунокомпрометированности и с учетом разнообразия персистирующих и вызывающих острые заболевания вирусов особый интерес представляет изменение уровня ИФН-α21, который наиболее активно вырабатывается в стимулированных дендритных клетках вне зависимости от конкретного типа вируса, вызвавшего такую стимуляцию [18].
Целью данного исследования стала оценка уровня ИФН-α21 у часто болеющих детей и его ассоциации с показателями иммунного статуса и выделением ДНК герпесподобных вирусов из слизистых оболочек носоротоглотки.
Материал и методы
В исследование включены 43 пациента в возрасте от полутора до 15 лет (средний возраст – 6,05 ± 0,63 года), из них мальчиков – 62,8%, девочек – 37,2%. Все участники исследования наблюдались в клинике Научно-исследовательского института охраны материнства и детства (НИИ ОМиД) как иммунокомпрометированные дети.
Критерии включения:
- частые (более шести раз в год) ОРВИ;
- обнаружение ДНК герпесвирусов в носоротоглотке.
Критерии исключения:
- наличие других инфекционных заболеваний на момент начала исследования;
- наличие врожденных и подтвержденных иммунодефицитов иного генеза (неопластический процесс, терапия системными глюкокортикостероидами, цитостатиками и т.п.).
Все пациенты были осмотрены аллергологом-иммунологом клиники НИИ ОМиД.
Уровень ИФН-α21 определяли с помощью иммуноферментного анализа (SEG966Hu, Cloud-Clone Corp., Китай).
В зависимости от полученных результатов детей разделили на две группы – с нормальным уровнем ИФН-α21 (5–15 пг/мл) (n = 9) и со сниженным уровнем ИФН-α21 (менее 5 пг/мл) (n = 34). Повышенный уровень ИФН-α21 (более 15 пг/мл) среди участников исследования не обнаружен.
Исследование лимфоидных популяций осуществляли на цитометре FACSCalibur (Becton Dickinson (BD), США). Панель моноклональных антител (BD) состояла из семи параметров: CD3+/CD45+ (зрелые Т-лимфоциты), CD19+/CD45+ (зрелые В-лимфоциты), CD3+/CD4+/CD45+ (Т-хелперы/индукторы), CD3+/CD8+/CD45+ (Т-киллеры/цитотоксические Т-лимфоциты), CD3+/CD25+ (маркер лимфоцитарной активации), CD(16+56)/CD45+ (натуральные киллеры), CD3+/HLA-DR+ (активированные Т- и В- лимфоциты). Активность нейтрофилов оценивали в спонтанном и стимулированном фагоцитарных тестах с частицами латекса и в тестах восстановления нитросинего тетразолия (НСТ) в формазан («ФАН-тест», «НСТ-тест», «Реакомплекс», Россия, г. Чита). Для определения уровня иммунолобулинов (Ig) в сыворотке крови применяли иммуноферментный метод с использованием тест-системы «Вектор-Бест» для IgA, IgM и IgG и тест-системы «Хема-Медика» для IgE. Оценка осуществлялась посредством автоматического спектрофотометра Lazurite («Вектор-Бест», Россия). ДНК ЦМВ, ВЭБ и ВГЧ-6 выявляли методом полимеразной цепной реакции с использованием для ее выделения и амплификации наборов НПФ «ЛИТЕХ» (Россия, г. Москва). Учет продуктов амплификации проводился методом электрофореза в агарозном геле.
Для статистического анализа результатов исследования использовали стандартные методы вариационной статистики с применением пакета программ Statistica 10.0 для Windows версии 10.0. Для категориальных переменных рассчитывали частоты и процентные доли. Оценка статистической достоверности различий показателей в группах проводилась с помощью Z-критерия. Для непрерывных переменных тип распределения проверялся с помощью критерия Шапиро – Уилка.
В отношении всех переменных получено нормальное распределение, в связи с чем проводился расчет среднего значения, стандартного отклонения, стандартной ошибки среднего и для сравнения групп был выбран параметрический статистический критерий – критерий Стьюдента.
Различия между группами считались статистически значимыми при p < 0,05. При p < 0,1 констатировалась выраженная тенденция.
Исследование проводилось в соответствии с принципами текущего пересмотра Хельсинкской декларации 2013 г. Все данные были собраны с согласия исследуемых и/или их законных представителей. Во всех таблицах статистической обработки данных, кроме первичной, обследуемые представлены под порядковыми номерами. Электронная таблица Excel с первичными данными хранилась под защитой паролем и была доступна только участникам исследования. Дизайн исследования утвержден этическим комитетом Хабаровского филиала Дальневосточного научного центра физиологии и патологии дыхания – Научно-исследовательского института охраны материнства и детства (протокол № 11 от 14.09.2024).
Результаты
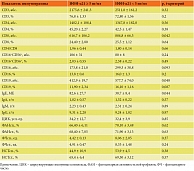
В изучаемых группах при оценке иммунного статуса достоверные различия были обнаружены в отношении трех показателей, значимые тенденции – в отношении двух показателей (табл. 1).
В группе со сниженным уровнем ИФН-α21 отмечено достоверно более высокое абсолютное количество Т-киллеров (884,8 против 616,7) и значимая тенденция к более высокому абсолютному числу натуральных киллеров (299,3 против 173,8). У данных пациентов также обнаружено большее абсолютное число активных В-лимфоцитов (577,7 против 412,9) и значимая тенденция к увеличению их доли (16,1 против 11,9).
В гуморальном звене иммунограммы выявлено достоверное повышение содержания общего IgE в группе с нормальным уровнем ИФН-α21 (82,6 против 38,7). В фагоцитарном звене иммунограммы значимых различий между группами не обнаружено.
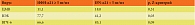
При выделении и исследовании ДНК герпесподобных вирусов установлены различия в вирусном пейзаже двух групп (табл. 2).
Так, у детей с нормальным уровнем ИФН-α21 достоверно чаще выявляли ВЭБ (77,7 против 41,2%), а у детей со сниженным уровнем ИФН-α21 – значимую тенденцию к более частой персистенции ВГЧ-6 (85,1 против 66,6%). По частоте встречаемости ЦМВ достоверных различий между группами не обнаружено.
Обсуждение
Во всех своих фракциях ИФН-α является первым активным противовирусным барьером организма. Его выработка макрофагами начинается немедленно после обнаружения вируса рецепторами, распознающими патогенные паттерны [12], и препятствует дальнейшему проникновению вируса в клетки организма. ИФН-α21 наиболее активно вырабатывается именно на данном этапе [18], что обеспечивает снижение дальнейшей вирусной нагрузки. ИФН-α в отличие от ИФН-γ обладает максимально выраженным прямым противовирусным действием и менее выраженным иммунорегуляторным действием. Это открывает путь внутриклеточным патогенам, в частности вирусам, к активному размножению в тканях пораженного организма и обусловливает высокую частоту развития респираторных инфекций. Можно предположить, что именно со снижением уровня ИФН-α и ИФН-α21 и, как следствие, более активным проникновением вируса в организм связаны компенсаторный рост показателей эффекторного звена специфического противовирусного иммунитета (Т-киллеры и активные В-лимфоциты), а также активация клеточных неспецифических противовирусных эффекторов (натуральные киллеры) в группе со сниженным уровнем ИФН-α21.
У пациентов с нормальным уровнем ИФН-α21 следует предположить другие механизмы увеличения частоты респираторных инфекций. В частности, в данной группе выявлен более высокий уровень общего IgE в крови.
В дальнейшем исследовании в группе со сниженным уровнем ИФН-α21 превышение уровня общего IgE отмечалось в 20% случаях, а в группе с нормальным уровнем ИФН-α21 – в 66% (р = 0,036). По-видимому, в группе с нормальным уровнем ИФН-α21 именно аллергическое воспаление способствовало активации вирусных инфекций.
Различие в иммунореактивности исследуемых групп подтверждалось и особенностями вирусного пейзажа. Так, в группе со сниженной продукцией ИФН-α21 основным был ВГЧ-6, в то время как в группе с нормальной продукцией ИФН-α21 – ВЭБ. Известно, что ВЭБ коррелирует с аллергическими поражениями дыхательных путей.
Заключение
У часто болеющих (иммунокопрометированных) детей механизмы развития частых респираторных инфекций могут значительно различаться. Так, при оценке уровня ИФН-α21 нами были выявлены две группы часто болеющих детей: с дефицитом и напряжением эффекторного звена специфического иммунитета на фоне снижения неспецифического противовирусного барьера и с нормальным уровнем компонентов эффекторного звена специфического иммунитета, но с признаками аллергической гиперчувствительности.
Полученные результаты позволяют индивидуализировать терапию в разных группах часто болеющих детей с учетом особенностей их иммунного реагирования, в частности дифференцированно подходить к принятию решения о применении препаратов интерферонов и их индукторов.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
S.V. Suprun, MD, PhD, Prof., E.N. Suprun, MD, PhD, Yu.S. Smolkin, MD, PhD, Prof., M.A. Lazareva, PhD, O.A. Lebedko, MD, PhD
Khabarovsk Branch of the Far Eastern Scientific Center of Physiology and Pathology of Respiration – Research Institute of Maternity and Childhood Protection
Far-East State Medical University
Academy of Postgraduate Education of the Federal Scientific and Clinical Center of the Federal Medical-Biological Agency
Contact person: Evgeniy N. Suprun, evg-suprun@yandex.ru
Changes in interferon status in frequently ill children have been studied for a long time. However, the role of specific fractions of interferons (IFNs) and, in particular, IFN-α has not been sufficiently investigated. Of particular interest are changes in the level of IFN-α21, which is most actively produced in stimulated dendritic cells, regardless of the specific type of virus that caused such stimulation.
Objective – to study the level of interferon 21 alpha in frequently ill children and its associations with indicators of immune status and isolation of DNA of herpes-like viruses from the mucous membranes of the oropharynx.
Material and methods. 43 patients aged 1.5 to 15 years were examined, with frequent, more than 6 times a year, acute respiratory infections that secrete DNA from herpes viral infections in the nasopharynx. The level of IFN-α21 and the parameters of the standard immunogram were determined.
Results. The group with reduced IFN-α21 had a higher absolute number of T-killers (884.8 vs 616.7) and natural killers (299.3 vs 173.8), active B-lymphocytes (577.7 vs 412.9). An increase in immunoglobulin E was observed in the group with a normal level of IFN-α21 (82.6 vs 38.7). Individuals with normal levels of IFN-α21 were significantly more likely to have the Epstein – Barr virus (77.7 vs 41.2%), and those with reduced levels had the persistence of human herpes virus type 6 (85.1 vs 66.6%).
Conclusion. 2 groups of frequently ill children were identified: one – with IFN-α21 deficiency (the stress of the effector link of specific immunity against a background of a decrease in the nonspecific antiviral barrier), other – with a normal level (the atopic orientation of inflammation), which allows individualizing the approach to therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.