Полиоксидоний в комплексном лечении атопической бронхиальной астмы
- Аннотация
- Статья
- Ссылки

Внедрение в практику лечения БА ингаляционных форм глюкокортикостероидов (ИГКС) оказалось высокоэффективным даже при тяжелом течении заболевания [1]. Известно, что ГКС обладают выраженным иммуносупрессивным и антипро-лиферативным действием (в первую очередь по отношению к Т-клеточному звену иммунитета), однако ингаляционные формы не вызывают системных проявлений при той же терапевтической эффективности [2]. Благоприятное действие ИГКС связано с локальным противовоспалительным эффектом (в основном с подавлением эозинофильного воспаления) и уменьшением гиперчувствительности дыхательной мускулатуры. Однако длительное применение ГКС, оказывающее терапевтический противовоспалительный эффект, в большей или меньшей степени подавляет противоинфекционный иммунный ответ, что способствует развитию инфекционных осложнений. При этом характер инфекций и их локализация зависят от пути введения, применяемой дозы и активности препарата [3].
Многолетний опыт применения ИГКС в лечении БА позволяет предположить, что неблагоприятное действие ИГКС на иммунную систему у больных БА во многих случаях может быть компенсировано и не проявляться полностью при отсутствии повышенной нагрузки на иммунную систему. Целью нашего исследования является анализ исходного состояния иммунитета и потенциальных возможностей поликлональной активации Т-клеточных популяций у больных БА, получающих базисную терапию с использованием ГКС, с последующей оценкой эффективности использования иммуномодулятора Полиоксидония (ПО) в комплексной терапии таких больных.
Материалы и методы
Обследовано 48 пациентов с атопической бронхиальной астмой (АБА) персистирующего течения средней тяжести. Диагноз был установлен на основании анамнеза, данных физикального и инструментального обследования, а также результатов специфической аллергологической диагностики. Все больные находились на базисной поддерживающей терапии ИГКС (будесонид) в суточной дозе 500–1000 мкг в комбинации с β2‑агонистами короткого действия. Группу сравнения составили 29 здоровых добровольцев. В числе сопутствующих заболеваний были выявлены: аллергический ринит – у 38 больных, хронический гнойно-обструктивный бронхит – у 43, рецидивирующие (до 5–6 раз в год) респираторные инфекции – у 36, в единичных случаях наблюдалось присоединение хронического тонзиллита, хронического пиелонефрита и повторных пневмоний. Возраст больных составил от 18 до 50 лет. Длительность заболевания – от 2 до 20 лет.
Наблюдаемые больные с АБА были разделены на две группы. Первая (23 человека) получала базисную терапию, включающую ИГКС (будесонид), 9 человек из группы периодически принимали ГКС парентерально или перорально. Вторая группа больных (25 человек) наблюдалась в процессе проведения курса комплексной терапии, включающей базисный прием ИГКС (будесонид) и иммуномодулятор ПО в дозе 6 мг внутримышечно через день в количестве 5 инъекций.
В исследованиях клетки получали из периферической крови. Мононуклеарную фракцию выделяли центрифугированием на градиенте плотности перколла («Pharmacia», Швеция) 1,077 при 700 g в течение 25 мин при комнатной температуре.
Количество лимфоцитов, экспрессирующих маркеры СD3+, CD4+, CD8+, CD19+, определяли с использованием моноклональных антител (МКАТ) к соответствующим антигенам (набор «IMK Plus», «Becton Dickinson», США).
Оценку уровня экспрессии поверхностных антигенов проводили методом трехцветного маркирования. Результаты реакции учитывали на двухлазерном проточном цитофлюориметре «FACSCalibur» («Becton Dickinson») в программе «СellQuest». Настройку прибора по каналам флюоресценции осуществляли с помощью программы «FACSComp» с применением калибровочных частиц CaliBRITE и частиц, меченных APC.
Уровень стимулированной экспрессии активационных маркеров на мононуклеарных клетках периферической крови больных АБА и здоровых добровольцев исследовали в условиях краткосрочного культивирования. Статистическую обработку результатов проводили с использованием t-критерия Стьюдента для двух группах и в динамике для одной группе [4].
Результаты исследования
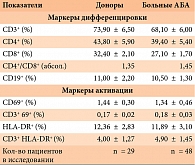
Результаты исследования влияния длительного применения ИГКС в составе базисной терапии у больных АБА на экспрессию активационных маркеров представлены в табл. 1. Проведено сравнение средних показателей экспрессии на мононуклеарах периферической крови маркеров лимфоцитарной дифференцировки и маркеров активации (CD69+ – раннего маркера активации и HLA-DR – позднего маркера активации).
Рассматривая материалы исследования, необходимо отметить, что при длительном наблюдении больных АБА, получавших базисную терапию с использованием средних доз ИГКС, процентное соотношение Т-клеточных субпопуляций (CD4+ и CD8+) в составе Т-лимфоцитарной популяции (CD3+) сохранялось и их уровень практически не отличался от такового у здоровых доноров (было зафиксировано незначительное и малодостоверное снижение CD8+ Т-лимфоцитов). Показатели соотношения CD4+/CD8+Т-лим-фоцитов в сравниваемых группах не отличались и соответствовали средним величинам нормы.
Количество активированных лимфоцитов, оцениваемое по уровню экспрессии маркеров ранней активации (CD69+), в общей популяции мононуклеаров не превышало 2%, а в наиболее значимой CD3+ Т-популяции лимфоцитов было минимальным (табл. 1). Более высоким было количество мононуклеаров, экспрессирующих поздние маркеры активации (HLA-DR), которое составило 12%. Однако эта цифра не отражает истинной степени активации клеток, поскольку для некоторых клеточных популяций экспрессия маркеров HLA-DR характерна и в норме. Поэтому истинный уровень активации Т-лимфоцитов по увеличению поздних активационных маркеров следует оценивать по показателям CD3+ HLA-DR+. Как мы видим, и эти величины однотипны в обеих группах.
Таким образом, следует признать, что базисная терапия АБА с использованием средних доз ИГКС не сопровождается значимыми сдвигами Т-лимфоцитарных по-пуляционно-субпопуляционных и активационных показателей.
Однако следует иметь в виду, что рассмотренные показатели характеризуют уровень экспрессии дифференцировочных и активационных маркеров Т-клеточного звена иммунитета у больных АБА в период восстановления клинического благополучия. Это совершенно не доказывает того, что Т-лимфоциты у больных АБА будут функционировать так же безупречно, как и Т-клетки здоровых людей, в условиях выраженной антигенно-инфекционной нагрузки. Данных о состоянии Т-лимфоцитов больных АБА, получающих ИГКС в составе базисной терапии, в доступной литературе мы не обнаружили.
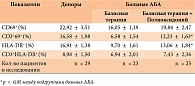
В связи с этим мы провели следующую серию лабораторных исследований, задачей которых было сравнение потенциальных возможностей Т-лимфоцитов доноров и больных АБА при активации их поликлональным митогеном – фитогемагглютинином (ФГА) – в течение 24 часов в культуре клеток. Полученные результаты представлены в таблице 2.
Результаты исследований свидетельствовали о том, что культивирование мононуклеаров периферической крови у индивидов анализируемых групп в течение 24 часов без добавления митогена не сопровождалось изменением уровня экспрессии ранних маркеров активации (CD69+) как у доноров, так и у больных АБА. В то же время степень активации СD3+ Т-лимфоцитарной популяции несколько возрастала преимущественно в группе доноров и достигала 1,41 ± 0,31% при 0,17 ± 0,02% в исходном состоянии. Прирост был незначителен, однако он оказался больше, чем в группе больных АБА.
Интересно, что при 24‑часовом культивировании без добавления ФГА количество клеток, несущих поздние маркеры активации (HLA-DR), несколько уменьшилось, что, видимо, связано с незначительной потерей клеток, несущих в норме маркеры HLA-антигенов ІІ класса. Именно об этом свидетельствуют практически неизменные уровни экспрессии маркера HLA-DR на CD3+Т-лимфоцитах у доноров – 4,0 ± 1,27% и 4,16 ± 1,12% в исходном состоянии и через 24 часа культивирования без ФГА (табл. 1, 2).
Использование митогена ФГА при культивировании привело к значительному увеличению количества активированных клеток. При этом наиболее выраженное увеличение отмечено в группе здоровых доноров. Процентное содержание клеток, экспрессирующих ранние маркеры активации, выросло у доноров до 22,92 ± 3,15%. У больных АБА также отмечалось увеличение количества активированных CD69+-мононуклеаров, но оно было достоверно меньшим, чем у доноров. Наибольшая разница прослеживалась у CD3+Т-лимфоцитарной популяции доноров и больных (16,58 ± 1,98% и 6,58 ± 1,54% соответственно, р < 0,01).
Воздействие ФГА увеличивало также экспрессию поздних маркеров активации мононуклеаров до 16,91 ± 1,38% в группе доноров, что практически в 2 раза превышало увеличение степени активации клеток у больных АБА, получавших ИГКС в составе базисной терапии.
Таким образом, длительное применение средних доз ИГКС в составе базисной терапии у больных АБА приводило к снижению потенциальных возможностей клеток к активации при использовании поликлонального митогена. Воздействие последнего может быть сопоставимо с выраженной активацией инфекционными агентами.
Было проведено сравнение полученных нами результатов с данными опубликованных исследований. Авторы сравниваемых работ использовали в основном высокие дозы ИГКС (флутиказон), что приводило к снижению количества активированных Т-лимфо-цитов уже в исходном состоянии с уменьшением выраженности реакций гиперчувствительности замедленного типа как у больных, так и у здоровых добровольцев [5, 6]. Полученные отличия были обусловлены разницей в дозировках и длительности применения ИГКС. Использование более низких доз в наших исследованиях не приводило к уменьшению количества клеток, экспрессирующих активационные маркеры.
Анализируя результаты длительного применения ИГКС по литературным данным, мы предположили, что отсутствие выраженного системного иммуносупрессирующего влияния у препаратов данной группы не отменяет возможности подавления местного иммунитета на уровне дыхательного тракта больных. Многочисленные противовоспалительные и иммуносупрессивные эффекты ГКС реализуются через транскрипционную стимуляцию или репрессию специфических генов. Наиболее характерным механизмом их действия является ингибирование транскрипционного ядерного фактора В (NF-kB). Это приводит к тому, что ГКС воздействуют практически на все клеточные типы, участвующие в воспалительном и иммунном ответе [7]. В пользу высказанного нами положения свидетельствуют данные о высокой чувствительности больных, находящихся на терапии системными ГКС, к оппортунистическим инфекциям. Применение же ИГКС сопровождалось специфическим локальным осложнением в виде легочного аспергиллеза [8]. С подобными явлениями локального снижения резистентности на уровне респираторного тракта мы встретились у больных АБА, находящихся на базисной терапии с использованием ИГКС. Применяемая терапия оказалась эффективной в снижении частоты и тяжести приступов АБА, однако признаки тяжелого бронхита сохранялись. Пациентов по-прежнему беспокоил приступообразный кашель с выделением слизисто-гнойной мокроты.
В ранее опубликованной нами работе было высказано предположение, что иммуносупрессивный эффект ИГКС у больных АБА может послужить обоснованием включения в комплексное лечение иммуномодуляторов [9, 10]. При выборе иммуномодулятора мы отдали предпочтение ПО как препарату, способному восстанавливать функции многочисленных клеточных типов у больных с патологией легких [11, 12]. ПО применяется в комплексном лечении хронических инфекционно-вос-палительных процессов различной локализации. Диапазон его иммунотропного действия широк: усиление фагоцитоза и активности естественных киллеров, активация В‑ и Т-лимфоцитов, стимуляция синтеза антител и др. [13]. Применение в комплексном лечении больных АБА Полиоксидония наряду с базисной терапией, содержащей ИГКС, также сопровождалось снижением частоты и тяжести приступов, однако более существенное влияние препарат оказал на течение осложняющих АБА воспалительных процессов, таких как гнойно-обструктивный бронхит. К концу курса лечения у больных значительно уменьшался кашель и выделение гнойной мокроты.
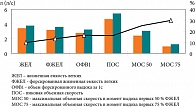
Функциональные легочные пробы указали на значительный прирост всех скоростных показателей после завершения курса лечения с использованием ПО (рис. 1). Повысились абсолютные значения ОФВ1, ПОС, МОС 50, МОС 75, что достоверно свидетельствовало об улучшении состояния бронхиальной проходимости.
Как показали наши исследования, ПО обладает многокомпонентным механизмом действия и оказывает хороший клинический эффект в комплексной терапии больных АБА с использованием ИГКС. Дополнительным проявлением противовоспалительного эффекта ПО явилась стимуляция гуморального иммунитета (повышение уровней IgG и IgA). Состояние клеточного иммунитета у больных, получавших ПО, мы оценивали по уровню экспрессии активационных маркеров на мононуклеарах периферической крови, стимулированных поликлональным Т-лимфоцитарным митогеном ФГА в течение 24 часов в культуре клеток (табл. 3).
Включение Полиоксидония наряду с ИГКС в терапию больных АБА обеспечивает восстанавление способности Т-лимфоцитов к полноценной активации в ответ на сильные стимулы. Популяция CD3+69+ Т-лимфоцитов, наиболее точно отражающая потенциальные возможности Т-клеток, увеличивалась при использовании ПО в комплексной терапии АБА.
Выводы
- Средние дозы ИГКС при лечении больных АБА оказывают положительный клинический эффект на течение основного заболевания без признаков системного иммунодепрессивного действия.
- Неблагоприятное действие ИГКС может реализоваться в снижении потенциальных возможностей активации Т-лимфоцитов в ответ на Т-клеточные поликлональные стимулы. Показанием к назначению ПО является снижение активационных показателей Т-лимфоцитов больных.
- Использование Полиоксидония в комплексной терапии больных АБА оказывало дополнительный местный противовоспалительный эффект, улучшало качественные показатели синтеза IgG и IgA и повышало потенциальные возможности Т-клеточного звена иммунитета.
- Больным АБА, находящимся длительное время на базисной терапии с использованием ИГКС, целесообразно включать в состав терапии Полиоксидоний на основании тщательного анализа клинической картины заболевания и состояния системы иммунитета конкретного пациента.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.