Влияние комплексов Сперотон и Синергин на показатели окислительного стресса эякулята у пациентов, готовящихся к программам вспомогательных репродуктивных технологий
- Аннотация
- Статья
- Ссылки
- English
По статистическим данным, от 15 до 25% пар испытывают проблемы с зачатием и вынуждены обращаться за медицинской помощью [1, 2], причем не всегда можно обнаружить, что привело к снижению фертильности [3].
Одной из распространенных причин мужского бесплодия является гиперпродукция активных форм кислорода (АФК) [4]. Так, у 25–30% бесплодных мужчин повышен уровень АФК в сперме. С одной стороны, АФК в физиологических концентрациях необходимы для гиперактивации и конденсации сперматозоидов и акросомной реакции. С другой, чрезмерное производство АФК незрелыми зародышевыми клетками и лейкоцитами индуцирует дисфункцию сперматозоидов, приводит к повреждению ДНК сперматозоидов, вызывает перекисное окисление липидов [5]. Оно в свою очередь, способствуя быстрой потере внутриклеточного аденозинтрифосфата, вызывает повреждение, снижение жизнеспособности и нарушение морфологии сперматозоидов [6, 7].
Сперматозоиды самостоятельно не могут устранить повреждение, вызванное АФК, поскольку у них отсутствуют необходимые системы восстановления цитоплазматического фермента. Кроме того, клеточные мембраны сперматозоидов богаты полиненасыщенными жирными кислотами, легко подвергающимися перекисному окислению. Все это делает сперматозоиды восприимчивыми к кислородному повреждению и, следовательно, перекисному окислению липидов [8].
У здоровых мужчин ДНК спермы защищена от окислительного стресса двумя основными механизмами. Во-первых, ДНК плотно свернута и упакована в хроматин, так что воздействие АФК на генетический материал минимально [9]. Во-вторых, естественные антиоксиданты в семенной плазме и сперматозоидах помогают нормализовать уровень продукции АФК: они останавливают окислительную цепную реакцию [5], устраняют, поглощают АФК или уменьшают их образование [6]. Некоторые природные антиоксиданты являются ферментами, например каталаза и супероксиддисмутаза, а также неферментативными соединениями, в частности витамины C и E, карнитины. Эти антиоксиданты нейтрализуют АФК, предотвращая развитие окислительного стресса и сохраняя функции сперматозоидов [10]. К эндогенным антиоксидантам относятся также лактоферрин и коэнзим Q10 [5]. Таким образом, сперматозоиды с помощью антиоксидантных механизмов инактивируют избыточное количество АФК, тем самым защищая гонадные клетки и зрелые сперматозоиды от окислительного повреждения [11].
Однако если в здоровом организме соотношение прооксидантов и антиоксидантов сбалансировано, то в патологических условиях неконтролируемое производство АФК превышает антиоксидантную способность семенной плазмы, что приводит к окислительному стрессу [1, 11]. Другими словами, окислительный стресс представляет собой дисбаланс между продуцированием АФК и способностью биологической системы обезвреживать реактивные промежуточные соединения или останавливать возникший апоптоз [3, 4]. Ввиду того что окислительный стресс нарушает оплодотворяющую способность, ведет к нарушениям эмбрионального развития, потере беременности и врожденным дефектам плода, он является предметом пристального изучения клиницистов и ученых [12–15].
Внедрение в клиническую практику программ вспомогательных репродуктивных технологий (ВРТ) позволило реализовать репродуктивную функцию при различных заболеваниях как у женщин, так и у мужчин в случаях, которые ранее считались абсолютно бесперспективными [2, 16]. Однако при высоком уровне АФК программы ВРТ не имеют преимуществ перед зачатием естественным путем. Часто сам процесс центрифугирования сперматозоидов в программах ВРТ увеличивает продукцию АФК и вызывает окислительный стресс. A. Agarwal и соавт. установили, что сперматозоиды производили значительно больше АФК, когда подвергались повторным циклам центрифугирования [17]. При этом длительность центрифугирования оказалась важнее, чем его сила, поскольку способствовала большей фрагментации ДНК с неблагоприятными последствиями для ВРТ. Повреждение ДНК – повод для беспокойства, поскольку в программах ВРТ, в частности во время интрацитоплазматической инъекции сперматозоидов, сперматозоиды со значительным количеством повреждений ДНК могут оплодотворить ооцит с последующими негативными исходами [18].
Таким образом, у некоторых пациентов, страдающих бесплодием, может быть либо перепроизводство АФК, либо недопроизводство антиоксидантов. В этой связи для восстановления баланса между оксидантной и антиоксидантной системами в семявыносящих путях им необходимо потреблять достаточное количество экзогенных антиоксидантов. Проводились исследования для выяснения эффективности различных антиоксидантов. Однако результаты были неубедительными, поскольку большинство экспериментов имели небольшой размер выборки, отличались дозировкой действующих веществ и продолжительностью терапии, в них отсутствовали группы контроля [19].
Цель исследования
Изучить влияние комплексов Сперотон и Синергин на изменение показателей окислительного стресса эякулята и индекс фертильности пациентов, планирующих участие в программах ВРТ.
Материал и методы
В исследование включены 60 инфертильных мужчин в возрасте от 26 до 45 лет (средний возраст 34 ± 3,2 года) с различными идиопатическими нарушениями спермограммы, которые с партнершами планировали вступление в программы ВРТ.
Критерии включения:
- мужчины в возрасте от 20 до 45 лет с бесплодием (ненаступление беременности у партнерши на протяжении более 12 месяцев половой жизни без контрацепции);
- наличие в анализе спермограммы идиопатической патозооспермии (олигозооспермии, астенозооспермии, тератозооспермии), нарушений акросомальной реакции сперматозоидов, повышенного уровня АФК;
- отсутствие клинических и лабораторных признаков воспалительных изменений придаточных половых желез;
- отсутствие при пальпации варикоцеле и других негативно влияющих на сперматогенез заболеваний органов мошонки, подтвержденное результатами ультразвукового исследования и допплерографией;
- отсутствие иммунной формы бесплодия (MAR-тест IgG < 10%);
- отсутствие выраженной соматической патологии;
- способность пациента понять суть исследования и дать письменное согласие на участие в нем.
Критерии исключения:
- обструктивная или необструктивная азооспермия, а также иммунологическая форма бесплодия;
- бесплодие партнерши (непроходимость маточных труб, нарушения овуляции, распространенный эндометриоз и др.);
- возраст моложе 20 лет или старше 47 лет;
- алкогольная или наркотическая зависимость;
- повышенная чувствительность к любому из компонентов исследуемых комплексов;
- нарушения функции печени и почек;
- участие в другом клиническом исследовании за последние три месяца.
Все пациенты случайным образом были разделены на три группы:
- первая группа (n = 20) получала исследуемый комплекс Сперотон по одному саше один раз в день в течение трех месяцев;
- вторая группа (n = 20) получала исследуемый комплекс Синергин по две капсулы один раз в день в течение трех месяцев;
- третья группа (n = 20) – контроль.
Исследование показателей спермограммы осуществлялось в соответствии с требованиями Всемирной организации здравоохранения: исходно и через три месяца от начала приема комплексов. Оценивались концентрация, подвижность, морфология сперматозоидов по строгим критериям Крюгера, объем эякулята. Выраженность окислительного стресса определялась по уровню АФК с помощью OxiSperm-теста – метода оценки повышенного количества супероксидных радикалов, присутствующих в эякуляте. Тест основан на химических свойствах нитросинего тетразолия, находящегося в наборе в виде реакционного геля. Оценка фрагментации ДНК сперматозоидов проводилась методом прямого мечения концевой группы 3'-ОН ДНК нуклеотидом (dUTP), несущим флуорохром, с помощью терминальной дезоксинуклеотидилтрансферазы (Terminal Deoxynucleotidyl Transferase (TdT)-Mediated dUTP Nick-End Labeling – TUNEL) с применением набора реактивов фирмы Millipore (США). Подсчитывали среднее значение фрагментированных ядер в препарате.
Статистические тесты планировалось проводить как двухсторонние с уровнем α = 5%. Для описания количественных переменных использовались следующие характеристики: количество пациентов, среднее значение, стандартное отклонение, стандартная ошибка, медиана, экстремальные значения. Статистическая достоверность изменений количественных переменных оценивалась с применением парного t-теста Стьюдента или знакового критерия Вилкоксона.
Результаты
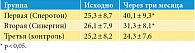
Сравнение основных показателей спермограммы исходно и через три месяца выявило достоверное (р < 0,05) увеличение количества сперматозоидов с поступательным движением (А + В) в первой группе по сравнению со второй и третьей группами (табл. 1).
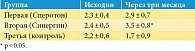
Во второй группе по сравнению с первой и контрольной группами через три месяца значительно выросло количество морфологически нормальных форм сперматозоидов (табл. 2).
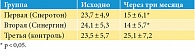
Наблюдались положительные изменения функциональных показателей спермы (снижение уровней АФК, фрагментации ДНК). По результатам OxiSperm-теста продемонстрировано уменьшение показателей окислительного стресса через три месяца в первой и второй группах. Улучшение было более выражено у пациентов, принимавших Синергин, и составило 41,9% по сравнению с исходным значением, у пациентов, принимавших Сперотон, – 36,7%. При этом в контрольной группе показатели ухудшились на 6,8% (табл. 3).
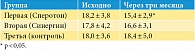
Доля пациентов, у которых снизился уровень фрагментации ДНК сперматозоидов через три месяца, в первой группе была значимо выше, чем во второй и контрольной. Так, в первой группе (прием Сперотона) уровень фрагментации ДНК составил 15,4 ± 2,9%, тогда как во второй (прием Синергина) и контрольной группе – 16,6 ± 3,1 и 18,4 ± 5,0% соответственно (р < 0,05) (табл. 4). Это в свою очередь свидетельствует о положительной динамике индекса фрагментации ДНК как в первой, так и во второй группах по сравнению с контрольной группой, где ухудшение показателей составило 2,2%.
На фоне приема Сперотона и Синергина ни у одного пациента не наблюдалось нежелательных эффектов.
В первой и второй группах суммарно было зафиксировано 17 (42,7%) клинических беременностей после выполнения программы ВРТ, в контрольной группе – шесть (30%).
Выводы
В результате проведенного исследования установлено достоверное положительное влияние комплексов Сперотон и Синергин на функциональное состояние репродуктивной системы у мужчин с патозооспермией, готовящихся к программе ВРТ.
Через три месяца в группе Сперотона доля сперматозоидов с поступательным движением (А + В) увеличилась на 58,5% (по сравнению с контрольной группой), а в группе Синергина подвижность сперматозоидов увеличилась на 19,9%. Количество морфологически нормальных сперматозоидов в эякуляте через три месяца выросло на 26,1% на фоне приема Сперотона и на 45,8% на фоне приема Синергина, тогда как в контрольной группе отмечалась отрицательная динамика (-22,7%).
По результатам анализа данных OxiSperm-теста, после трех месяцев приема Сперотона уровень АФК уменьшился на 36,7%, а после приема Синергина – на 41,9%, что свидетельствует о положительном влиянии комплексов на антиоксидантные свойства спермы.
Доля пациентов с улучшением показателей фрагментации ДНК (по данным TUNEL) через три месяца после исходного анализа в группах Сперотона (15,4%) и Синергина (16,6%) была выше, чем в контрольной группе, где ухудшение показателей составило 2,2%.
Прием Сперотона и Синергина не вызвал каких-либо нежелательных явлений.
Частота положительных исходов программы ВРТ на фоне приема Сперотона и Синергина выросла на 12,7%.
Таким образом, у мужчин с бесплодием, планирующих с партнершами принять участие в программах ВРТ, получавших Сперотон, отмечалась положительная динамика основных показателей спермограммы, а также снижение уровней фрагментации ДНК сперматозоидов и АФК, а у получавших Синергин наблюдалось улучшение морфологии сперматозоидов и антиоксидантного потенциала эякулята. Особенно следует подчеркнуть, что антиоксидантный статус сперматозоидов улучшался уже после 14-дневного приема исследуемых комплексов, следовательно, их можно назначать короткими курсами пациентам, не имеющим возможности пройти полный курс. На основании полученных результатов можно рекомендовать комбинированный прием комплексов Синергин и Сперотон для усиления воздействия на функциональную способность сперматозоидов, что в свою очередь может повысить положительные результаты исходов программ ВРТ. Однако требуются дополнительные исследования.
A.Yu. Popova, PhD, S.I. Gamidov, DM, Prof., R.I. Ovchinnikov, PhD, N.G. Gasanov
National Medical Research Center for Obstetrics, Gynecology and Perinatology named after Academician V.I. Kulakov, Moscow
I.M. Sechenov First Moscow State Medical University
Contact person: Alina Yuryevna Popova, a_popova@oparina4.ru
Provide the results of a study proved statistically significant positive effect of Speroton and Sinergin supplements on the functional state of the reproductive system in men with pathozoospermia preparing for the program of assisted reproductive technologies. Thus, the use of Speroton and Sinergin complexes for three months contributed to an increase in the proportion of sperm with forward motion (A + B) and the number of morphologically normal sperm in the ejaculate, as well as the significant reduction in the levels of reactive oxygen forms and DNA fragmentation of sperm.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.