Влияние патогенетически обоснованной терапии аденомиоза на его течение
- Аннотация
- Статья
- Ссылки


Доказана необходимость повышенной способности к имплантации эндометриальных клеток, при этом защитные силы организма недостаточны для обеспечения их клиренса. Реализация этих условий возможна под воздействием одного или нескольких факторов: гормонального дисбаланса, расстройств иммунитета, неблагоприятной экологии, наследственной предрасположенности, воспаления, условий жизнедеятельности и т.д. Относительно гормональной и иммунологической концепции эндометриоза утверждается, что они играют роль факторов (пусковых механизмов), предрасполагающих к возникновению патологического процесса (1, 7, 9, 11, 12).
Последние 30 лет широко и настойчиво изучаются иммунологические аспекты аденомиоза. Определенная роль в развитии и прогрессировании заболевания отводится изменениям как общего, так и локального иммунитета, проявляющегося в угнетении клеточного и гуморального его звеньев.
Однако окончательный диагноз аденомиоза можно установить только после патоморфологического исследования материала. При этом необходимо присутствие таких признаков, как наличие эндометриальных желез и стромы на расстоянии более 2,5 мм от базального слоя эндометрия; реакция миометрия в виде гиперплазии и гипертрофии мышечных волокон; увеличение желез и стромы, окружающей гиперплазированные гладкомышечные волокна матки; наличие пролиферативных и отсутствие секреторных изменений.
Важными клиническими проявлениями эндометриоза, определяющими показания к проведению лечения, являются: тазовые боли, нарушение менструального цикла, бесплодие, расстройства функции тазовых органов. Характерный для аденомиоза симптом – менометроррагия и перименструальные кровянистые выделения по типу «мазни», обусловлен как циклическими превращениями эктопического эндометрия, так и нарушением сократительной функции матки. Тазовые боли, как правило, усиливающиеся накануне и во время менструации, типичны как для наружного эндометриоза, так и для аденомиоза.
Одним из наиболее важных методов диагностики эндометриоза остается бимануальное гинекологическое исследование. Бимануальное исследование позволяет оценить величину матки, ее консистенцию, форму, характер поверхности, заподозрить наличие опухолевидных образований в области придатков матки, уплотнения в позадишеечной области и болезненность стенок малого таза, а также спаечного процесса в малом тазу. Бимануальное исследование обеспечивает ценную диагностическую и дифференциально-диагностическую (особенно от онкологических заболеваний) информацию. При эндометриозе влагалищной части шейки матки и влагалища при осмотре видны эндометриоидные образования.
Оптимальным и общедоступным скрининговым методом в алгоритме обследования больных с различными формами эндометриоза считают УЗИ, диагностическое значение цветового допплеровского картирования (ЦДК) высоко. Сущность этого метода состоит в возможности визуализации всех движущихся жидкостей организма в режиме реального времени и проведении анализа их движения. Картина УЗИ при аденомиозе характеризуется следующим: при 1 степени распространения отмечаются небольшие округлой или овальной формы гипо- и анэхогенные структуры диаметром 0,1-0,2 см; эхонегативные трубчатые структуры, идущие от слоя эндометрия к миометрию до 0,1 см в диаметре; неравномерность толщины базального слоя эндометрия, зазубренность его контура; появление в миометрии отдельных участков повышенной эхогенности до 0,3 см. При II-III степени распространения отмечаются: преимущественное увеличение передне-заднего размера матки; асимметрия толщины стенок матки; появление в миометрии различной толщины зоны повышенной эхогенности; появление в зоне повышенной эхогенности анэхогенных включений 0,2-0,6 см или жидкостных полостей, содержащих мелкодисперсную взвесь; появление в месте патологического образования множественных средней и низкой эхогенности близко расположенных полос, ориентированных перпендикулярно к плоскости сканирования; выявление в области переднего фронта сканирования зоны повышенной эхогенности, зоны в области дальнего фронта (анэхогенной). При очаговой форме внутреннего эндометриоза отмечаются:
- появление в одном из участков миометрия зоны повышенной неоднородной эхогенности с нечеткими и неровными контурами;
- преимущественное увеличение одной из стенок матки по отношению к другой, наличие внутри этой зоны отдельных округлой или овальной формы включений (кистозных) диаметром 0,2-0,6 см и кистозных полостей диаметром 0,7-1,5 см.
При узловой форме внутреннего эндометриоза отмечаются:
- появление в стенке матки зоны повышенной эхогенности округлой или овальной формы, с наличием в ней небольших анэхогенных включений или кистозных полостей, содержащих мелкодисперсную взвесь;
- ровные и не всегда четкие контуры образования;
- повышенная эхогенность переднего контура образования и пониженная возле дальнего;
- выявление в патологическом очаге средней и низкой эхогенности близко расположенных полос перпендикулярно к плоскости сканирования.
По данным допплерометрии, сосудистая сопротивляемость в маточной артерии и ее яичниковой ветви достоверно выше у женщин с выраженными клиническими проявлениями эндометриоза.
Все большее значение в диагностике эндометриоза и дифференциальной диагностике, а также злокачественной опухоли приобретает определение в крови различных опухолевых маркеров. Наиболее доступно в настоящее время выявление онкоантигена – СА-125. Установлено, что в сыворотке крови у здоровых лиц концентрация онкомаркера СА-125 составляет в среднем 8,3 Ед/мл. В то время как при эндометриозе этот показатель – в среднем 27,2 Ед/мл. Исследование уровня СА-125 (биохимического маркера эндометриоза, вещества, синтезируемого производными целомического эпителия и являющегося маркером рака яичников) статистически значимо повышается при среднетяжелом и тяжелом эндометриозе, но остается в пределах нормы при минимальном и легком. Уровень СА-125 значительно колеблется. В большинстве случаев он составляет в межменструальном периоде у здоровых женщин 8-22 Ед/мл, при легком течении эндометриоза – 14-31 Ед/мл, при среднетяжелом и тяжелом эндометриозе – 13-95 Ед/мл. По данным некоторых исследований, специфичность определения уровня СА-125 при эндометриозе превышает 80% (1, 9). Определение уровня СА-125 может быть полезно для наблюдения за больными, которые проходят курс лечения при эндометриозе. Уровень СА-125 снижается после комбинированного гормонального лечения.
Лекарственная терапия может стать компонентом лечения или быть самостоятельной. Особая роль отводится нестероидным противовоспалительным препаратам (ингибиторы синтетаз простагландинов), а также гормональным или антигормональным препаратам, лечебный эффект которых основан на подавлении стероидогенеза в яичниках, создании гипоэстрогенного состояния или ановуляции. Это гормональные контрацептивы, прогестагены, производные андрогенов, антигонадотропины, агонисты гонадотропин-рилизинг-гормона (ГнРГ). Препарат нужно подбирать строго индивидуально, с учетом побочных эффектов, по возможности начиная с наименее агрессивного. Эндометриоз является заболеванием всего организма, следовательно, необходима комплексная терапия с учетом всех звеньев патогенеза (1, 3, 6). Согласно общепринятому определению, эндометриоз – это гормонозависимое заболевание на фоне нарушения иммунного гомеостаза. Это и явилось выбором цели нашего исследования.
Цель – определить влияние комплексной терапии комбинированными оральными контрацептивами (КОК), содержащими гестоден, и препаратами Индинол и Эпигаллат на аденомиоз легкой степени тяжести.
Материалы и методы
В обследовании приняли участие 60 больных с аденомиозом легкой степени тяжести. Критериями отбора в группы являлись приведенные выше данные ультразвукового исследования и выраженность клинических симптомов, а также отсутствие показаний для оперативного лечения. Возраст пациенток составил от 26 до 39 лет (средний возраст – 30,7 ± 3,4 года). Были выделены две группы исследования:
I группа (30 женщин) получала лечение гестоденсодержащими КОК в пролонгированном режиме 63-7-63 дня;
II группе (30 пациенток) была назначена комбинация гестоденсодержащих КОК аналогично, как и в I группе, в пролонгированном режиме в сочетании с Индинолом (2 капсула 2 р./сут. в течение 6 мес.) и Эпигаллатом (2 капсула 2 р./ сут. в течение 6 мес.).
Сравнительная эффективность проводимой терапии оценивалась в динамике: до начала лечения, через 3 и 6 мес. терапии, отдаленные результаты – через 12 мес. после ее окончания.
Все обследованные предъявляли жалобы на вторичную альгоменорею, болевой синдром, усиливающийся перед и во время менструации; синдром хронических тазовых болей. Возникновение усиливающегося циклического болевого синдрома у девушек с момента менархе указали 25% из числа всех опрошенных. При оценке интенсивности болей врачи полагаются на субъективную оценку пациентки, которая в значительной степени зависит от ее психоэмоционального фона. В связи с этим была применена для оценки степени выраженности исходного болевого синдрома и изменения его в процессе лечения шкала С. Mac Laverty, P. Shav (1995).
Из числа обследованных 83% I группы (20 женщин) и 93% II группы (27 женщин) предъявляли жалобы на мено- и метроррагии. Скудные кровянистые выделения в пред- и постменструальном периоде беспокоили 12 пациенток I группы (40%) и 18 (60%) II группы, длительность менструаций составляла от 5-6 до 10-12 дней. При бимануальном исследовании практически в 100% отмечено изменение передне-заднего размера матки в обеих группах, исследование проводилось накануне и сразу после окончания менструации. Из числа обследованных I группы 40% (12 женщин) страдали анемией легкой степени тяжести, таких пациенток во II группе было 26,7% (8 женщин).
Все обследованные отмечали повышенный инфекционный индекс, частые стрессовые ситуации, которые, как известно, приводят к функциональной лабильности гипоталамо-гипофизарной и иммунной систем, создающей определенный преморбидный фон. Из числа обследованных половина имела в анамнезе родственников первой линии, страдающих эндометриозом. Неэффективность длительного лечения воспалительных процессов внутренних половых органов была выявлена у 70% (21 пациентка) I группы и у 60% (18 женщин) II группы.
Женщины указывали на возникновение заболевания после патологических родов, искусственных и самопроизвольных абортов, диагностических выскабливаний и других внутриматочных вмешательств; диатермокоагуляции шейки матки, а также операций на матке и придатках 73,3% (22 пациентки) I группы и 80% (24 пациентки) II группы.
Бесплодие так называемого неясного генеза, то есть при проходимых трубах (подтвержденных гистеросальпингографией), овуляторных циклах, фертильной сперме и положительном тесте пенетрации выявлено у 33,3% женщин I группы (10 обследованных) и у 40% (12 женщин) II группы.
Ультразвуковое исследование с использованием трансабдоминального и влагалищного датчиков, дополненное допплерометрией кровотока в маточных артериях, проводилось всем пациенткам до начала лечения (5-7 день менструального цикла), в процессе терапии через 3-6 мес. на аппарате Philips HD11 на 5-7 день менструальноподобной реакции.
Учитывая, что специфичность определения уровня СА-125 при эндометриозе превышает 80%, нам представилось интересным изучить изменение уровня СА-125 в динамике до проведения терапии, на фоне лечения и после в обеих группах. Учитывая изменение показателей в зависимости от фазы менструального цикла, был разработан и апробирован метод определения соотношения уровней СА-125 (Ед/мл), получаемых во время менструации (2-3 дни менструального цикла) и в середине первой его фазы – 7-9 день менструального цикла. СА-125 определялись иммунохимическим методом на аппарате Elexsis 2020 («Rochе», Швейцария).
До начала лечения и через 6 мес. терапии определяли уровень гормонов в плазме крови гормональным анализатором Cobas Core («Roche», Швейцария) и тест-системами иммунохемилюминесценции «Immulite»: ФСГ (МЕ/л), ЛГ (МЕ/л), пролактин (мМЕ/л), тестостерон (нмоль/л), кортизол (нмоль/л), 17-ОП (нмоль/л), альдостерон (пг/мл), ТТГ (мМЕ/л) на 2-5-й день менструального цикла. Были определены биохимические показатели (печеночные пробы, липидный спектр крови) с использованием биохимического анализатора Cobas Integra («Roche», Швейцария). Состояние свертывающей системы (фибриноген, антитромбин-III, тромбоциты) выявлялось с помощью коагулометрического анализатора КС 10А «Amelung-Coagulometer» (Германия).
Иммунологические показатели, абсолютное и процентное содержание лимфоцитов, CD4+ (Т-лимфоциты хелперы-индукторы); CD8+ (Т-лимфоциты цитотоксические), CD4+/CD8+ (отношение хелперов-индукторов к цитотоксическим лимфоцитам) определяли методом прямой реакции иммунофлуоресценции с меченными ФИТЦ мышиными моноклональными антигенами фирмы Becton Diclinson (США) с регистрацией результатов на проточном цитофлуориметре Becton Diclinson.
Результаты исследования
Проведенные исследования показали, что в обеих группах на фоне лечения отмечалось снижение болевого синдрома: в I группе – у 26 пациенток (86,7%) и во II группе – у 30 (100%). В связи с различной степенью интенсивности болевого синдрома, все пациентки, согласно шкале C. Mac Laverty et P. Shav, были разделены на подгруппы: легкой степени – слабая боль (1-3 балла) 17 (56,7%) в I группе, 15 (50%) во II группе; средней степени – умеренная боль (4-6 баллов) 10 (33,3%) и 9 (30%), соответственно в I и II группах, а также тяжелой – сильная (8-9 баллов), 3 (10%) и 6 (20%) соответственно. После проведенного лечения через 6 мес. в I группе болевой синдром легкой степени диагностировался у 24 женщин (80%), средней степени – у 5 (16,7%) и тяжелой степени у 1 (3,3%). Во II группе: у 25 (83,3%), средней степени – у 5 (16,7%), болевой синдром тяжелой степени после лечения в данной группе не выявлен.
Пролонгированные приемы КОК способствовали уменьшению кровопотери у всех женщин и, как следствие, снижению числа больных с анемией на 83,3% – в I группе и на 87,5% – во II группе.
В обеих группах уменьшилось количество пациентов с перименструальными кровомазаниями на 54,2% – в I группе и на 83,3% – во II группе.
Биохимические показатели и состояние свертывающей системы крови до лечения и в процессе терапии были в допустимых пределах и существенно не изменялись.
Уровень гормонов плазмы крови в обеих группах имел определенную тенденцию: при допустимых значениях, существенных изменений в процессе терапии ТТГ, кортизол, тестостерон не изменялись. Динамика остальных определяемых до лечения и через 6 мес. терапии гормонов представлена в таблице 1.
Достоверные различия в уровне гонадотропных гормонов до начала лечения и через 6 мес. отмечены в обеих группах обследования. Пролонгированный прием КОК способствовал снижению уровня ФСГ (р < 0,01) и в меньшей степени ЛГ (р < 0,05). Имеющийся умеренный антиальдостероновый эффект у гестодена, показанный нами в предшествующих работах (4, 5), отмечен и в данном исследовании. Причем снижение альдостерона было более выражено во II группе получавших КОК с Индинолом и Эпигаллатом. Снижение 17-ОП обусловлено комплексным воздействием, достоверно в обеих группах с незначительной разницей между группами. Интерес вызывает изменение уровня пролактина. Как известно, пролактин имеет тенденцию повышаться при приеме этинил-эстрадиола, входящего в состав современных КОК, представленных на нашем рынке, что порой затрудняет их назначение у женщин с синдромом гиперпролактинемии или склонных к повышению его уровня в связи с определенным преморбидным фоном. В I группе произошло недостоверное его увеличение, а во II – снижение уровня пролактина (р < 0,05).
Известно, что современные КОК положительно влияют на иммунные аспекты. Использование в комплексной терапии препаратов (Индинол и Эпигаллат), способствующих в том числе положительному влиянию на общий иммунитет, потенцирует их действие. Таким образом, оказывается двойное воздействие на патологический процесс (гормоно- и иммуномодулирующее), что соответствует данному ранее определению эндометриоза как гормонозависимого заболевания на фоне нарушения иммунного гомеостаза (таблица 2).
Изучение изменения показателей Т-лимфоцитов хелперов-индукторов (CD-4+) в процессе терапии имело тенденцию к повышению, при сниженных исходных показателях; кроме того, отмечено уменьшение Т-лимфоцитов цитотоксических, рассматриваемых как ключевой фактор прогрессирования аденомиоза (10), во время лечения во II группе и тенденция к снижению CD8+ в I группе. Отношение CD4+/CD8+ повышалось и в I, и во II группах, но при этом во II группе с достоверной разницей, что позволяет говорить о преимущественной пролиферации CD8+ и указывает на активацию клеточного иммунитета на фоне комбинации лечения КОК и Индинола с Эпигаллатом. Отмечена положительная динамика в нормализации как процентного, так и абсолютного количества лимфоцитов в обеих группах.
Исследования соотношения уровня СА-125, которое мы обозначили как коэффициент активности аденомиоза КАА, имело следующую тенденцию. Начальные уровни колебались в пределах от 1 до 5. При сопоставлении с клиническими проявлениями выявлено, что уровень коэффициента при неактивной форме аденомиоза был в пределах от 1до 1,5. Уровень КАА выше 1,5 указывает, с нашей точки зрения, на активность процесса. В I и II группах были выделены в процессе определения введенного коэффициента КАА по две подгруппы (I А – I В и II А – II В), в которых уровень КАА определялся в интервалах от 1 до 1,5, от 1,5 и выше соответственно. При отборе пациентов в группы исследования нами был выявлен КАА до 5-9, что соответствовало средней и тяжелой степени аденомиоза как по клинической картине, так и по совокупности методов исследования. Данный контингент женщин в это исследование не вошел.
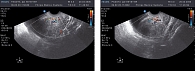
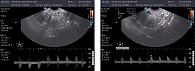
С целью выявления корреляционной связи и проведения сопоставления уровня КАА данным ультразвуковой картины, нами проводилось УЗИ-исследование по указанной выше методике. Исходная картина в обеих группах не имела выраженных отличий. Определяемый индекс резистентности (IR) в маточных сосудах при исходном ультразвуковом исследовании составил 0,83 ± 0,06 и 0,64 ± 0,03 в эндометриоидных гетеротопиях. Кроме того, была выявлена достоверная асимметрия в кровотоках между обеими маточными артериями, причем в левой маточной артерии данный показатель был выше более чем на 0,3 ± 0,04. При этом поражение ближайших к эндометрию слоев миометрия не превышало 3 мм, определялась округлая форма матки за счет увеличения переднезаднего размера, асимметрия толщины стенок матки, при этом разница в толщине не превышала 2 мм, отмечалось наличие участков повышенной эхогенности в миометрии с прерывистым контуром, наличие гипо- и анэхогенных участков в диаметре до 2-3 мм (рисунки 1-4), что соответствовало литературным данным (1, 2, 8).
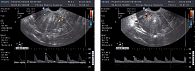
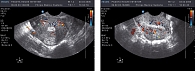
В процессе лечения выявлены следующие показатели: в I группе IR снизился и стал соответствовать 0,74 ± 0,04 в маточных артериях, а во II группе – 0,68 ± 0,05, IR в эндометриоидных гетеротопиях соответственно – 0,57 ± 0,02 и 0,44 ± 0,07. При анализе ультразвуковой картины отмечено недостоверное, но уменьшение переднезаднего размера матки, более выраженного во II группе, уменьшение количества гипо- и анэхогенных включений, а также их диаметра (после лечения диаметр гипо- и анэхогенных участков не превышал 1-2 мм, при исходном до 2-3 мм), поражение ближайших к эндометрию слоев миометрия также не превышало 3 мм (рисунки 5-8).
Учитывая, что в группах были выделены подгруппы согласно уровню КАА до 1,5 и выше 1,5, что нашло отражение в разделении данных групп на подгруппы А и В, мы посчитали возможным провести корреляционный анализ коэффициента КАА и IR. Оказалось, что IR был выше в подгруппах В, при р < 0,05. После 6 мес. терапии во II группе (получавших в качестве лечения КОК в сочетании с Индинолом и Эпигаллатом) произошло достоверное снижение коэффициента КАА в II В, при отсутствии такового в I группе подгруппе В.
Заключение
Таким образом, можно сделать следующие выводы: клиническая и ультразвуковая картины легкой степени аденомиоза не всегда объективно оценивают тяжесть его течения. Наличие методики по определению уровня СА-125 в плазме крови, без учета предлагаемого нами расчетного коэффициента КАА, недостаточно отражает достоверность тяжести течения патологического процесса. Расчет КАА позволит выбрать патогенетически обоснованную тактику в выборе метода терапии. При показателе КАА, не превышающем 1,5, с целью коррекции имеющихся нарушений и в качестве контрацептивного средства можно рекомендовать прием КОК в пролонгированном режиме. Если КАА превышает 1,5, необходимо сочетание с Индинолом и Эпигаллатом. При уровне КАА выше 3 в лечении необходимо использовать агонисты ГнРГ, возможно, в сочетании с Индинолом и Эпигаллатом. Имеющийся опыт данной терапии на небольшом количестве пациентов и достоверные изменения в клинических, инструментальных и лабораторных показателях, с достоверным уменьшением КАА позволяет нам рекомендовать сочетание Индинола и Эпигаллата с агонистами ГнРГ.
Кроме этого, нами выявлена связь между изменениями коэффициента КАА и картиной ультразвукового исследования. Наличие методов определения активности аденомиоза зачастую основывается на применении инвазивных методов диагностики, что не всегда оправдано, особенно у пациенток с бесплодием в анамнезе. Использование УЗИ-диагностики и определения коэффициента КАА позволит снизить расходы на проведение исследования и в отдельных случаях отказаться от проведения инвазивных методов диагностики.
При анализе отдаленных результатов (через 12 мес.) отмечено наступление беременности в обеих группах, но процент наступления был выше во II группе (66,7% против 50% в I группе). При анализе наступления беременности в подгруппах оказалось, что в I группе все беременности наступили в подгруппе А (при КАА ниже 1,5), а во II группе из 8 забеременевших женщин 3 (37,5%) были из подгруппы В (КАА выше 1,5). Следовательно, использование в терапии Индинола и Эпигаллата в сочетании с приемом КОК в пролонгированном режиме повышает клинический эффект от проводимой терапии и способствует более высокому уровню наступления беременности.
Применение данного комплекса терапии способствовало повышению качества жизни. Пациенты II группы, принимавшие анксиолитики до начала лечения, через 6 мес. на фоне терапии отказались от них в связи со стабилизацией психического состояния, улучшения сна, снижения метеозависимости.
Таким образом, Индинол и Эпигаллат влияют не только на иммунологические и гормональные составляющие эндометриоза, но и на другие его звенья. Сочетание приема КОК с препаратами Индинол и Эпигаллат достоверно улучшает состояние пациенток с аденомиозом и является методом выбора терапии при легкой его степени.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.