количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Влияние препарата Индигал на клинические и морфологические показатели у пациентов с доброкачественной гиперплазией простаты и простатической интраэпителиальной неоплазией
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №2
- Аннотация
- Статья
- Ссылки
По данным американской статистики, от 17 до 20% мужчин имеют повышенный риск заболевания раком простаты, летальность при этой патологии составляет 2,82–4,73% [22].
Рак предстательной железы остается одним из наиболее распространенных злокачественных новообразований у мужчин среднего и пожилого возраста, причем заболеваемость неуклонно растет год от года.
По данным американской статистики, от 17 до 20% мужчин имеют повышенный риск заболевания раком простаты, летальность при этой патологии составляет 2,82–4,73% [22].
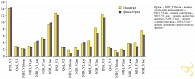
Рис. 1. Динамика индексов IPSS и NIH-CPSI
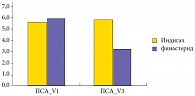
Рис. 2. Динамика показателей ПСА
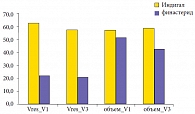
Рис. 3. Динамика количества остаточной мочи (Vres) и объема простаты (мл)

Таблица 1. Морфологические диагнозы пациентов и значимость отличий в их частотах между Визитами 1 и 3
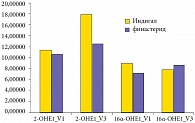
Рис. 4. Динамика метаболитов эстрогенов в моче (нг/мл)
Профилактической мерой, которая позволит частично снизить показатели смертности от рака простаты, является раннее выявление простатической интраэпителиальной неоплазии (ПИН). ПИН высокой степени является главным предиктором развития рака простаты. Так, по данным литературы, при повторной биопсии простаты у пациентов с ПИН низкой степени рак диагностируется в 13–30%, у больных с ПИН высокой степени – в 27–66% случаев. При этом наличие ПИН высокой степени при повторных биопсиях повышает риск развития рака простаты до 70–73% [2,21]. Нетрудно сделать вывод, что разработка эффективных методов и лекарственных агентов, способствующих нормализации функциональных и морфологических характеристик предстательной железы, позволит значительно снизить этот показатель.
К таким лекарственным агентам относятся содержащийся в овощах семейства крестоцветных индол-3-карбинол (I3C) и наиболее активный из катехинов зеленого чая – эпигаллокатехин-3-галлат (EGCG). Оба компонента входят в состав препарата Индигал («МираксБиоФарма», Москва) [1]. Однако, несмотря на доказанную в доклинических исследованиях эффективность этих соединений в отношении неопластических образований предстательной железы, клинических исследований в данном направлении до настоящего времени было проведено недостаточно. Вышеуказанные факты послужили поводом для проведения клинического исследования эффективности препарата в качестве профилактического средства, позволяющего воздействовать на предопухолевые процессы в предстательной железе.
Материалы и методы
В 2008–2010 гг. в нашем центре было проведено исследование клинической эффективности, морфологических эффектов и безопасности применения препарата Индигал в сравнении с финастеридом у больных доброкачественной гиперплазией простаты (ДГП) и ПИН. С этой целью были отобраны 50 мужчин, у которых при первичной биопсии предстательной железы была выявлена ПИН. При этом основным критерием включения являлось отсутствие предшествующего хирургического лечения заболеваний простаты и органов малого таза, которое может оказывать значительное влияние на параметры мочеиспускания.
Также исключался прием препаратов, влияющих на качество мочеиспускания, на момент начала исследования или менее чем за 2 месяца до него (ингибиторы 5-альфа-редуктазы, альфа-1-адреноблокаторы, растительные экстракты, холинолитики, антидепрессанты, диуретики). Пациенты были рандомизированы на две группы: в первую вошли 30 мужчин, получавших Индигал; вторую группу (контрольную) составили 20 пациентов, принимавших финастерид. Длительность приема исследуемого препарата в обеих группах составила 6 месяцев, в дозировке: Индигал – по 2 капсулы 2 раза в сутки, финастерид – по 5 мг (1 таблетка) ежедневно.
С целью определения эффективности терапии изучали:
- динамику показателей стандартных опросников (IPSS, NIH-CPSI, QoL);
- динамику максимальной скорости потока мочи (Qmax);
- изменение объема остаточной мочи (Vres);
- динамику объема предстательной железы;
- динамику морфологических показателей: пролиферативнаяактивность эпителия (качественная оценка распределения пролиферативных центров, количество клеточных элементов на единицу длины базальной мембраны), плоидность эпителиальных клеток, дифференцированная оценка частоты встречаемости фокусов ПИН и атипической гиперплазии, эпителиальная атрофия.
Результаты
Из 50 пациентов, включенных в исследование, согласно протоколу, его завершили 44. Шестеро больных выбыли по различным причинам (3 случая – возникновение нежелательных эффектов, 2 – развитие рака предстательной железы, 1 – отказ от продолжения исследования по личным причинам). Таким образом, количество пациентов, завершивших исследование, в соответствии с листом рандомизации составило: 25 пациентов в первой группе (Индигал) и 19 пациентов во второй группе (финастерид). Статистически значимых отличий в исходных данных пациентов не было, за исключением результатов урофлоуметрии (Qmax и Qave) и объема остаточной мочи. В связи с этим межгрупповых сравнений по указанным показателям не проводилось.
В обеих группах на фоне терапии отмечалась тенденция к снижению показателей по всем индексам анкетных опросников, однако статистически значимой она была в первой группе по индексу IPSS (с 14,1 до 12,38 балла), во второй группе – по индексам IPSS (с 14,35 до 11,42 балла), NIH-CPSI домен «дизурия», NIH-CPSI домен «симптоматика» и NIH-CPSI суммарный (р < 0,01) (рис. 1). В ходе исследования было показано, что при приеме Индигала не происходит статистически значимого изменения уровня ПСА (р < 0,05) и объема простаты (p < 0,1), в том числе не было отмечено и увеличения размеров простаты в течение 6 месяцев наблюдения, тогда как финастерид значительно снижает эти показатели (рис. 2 и 3). Оба препарата приводят к существенному росту Qmax и Qave, но не влияют на объем остаточной мочи. Применение Индигала способствует увеличению содержания 2-гидроксиэстрона (2-OHE1) в моче, при этом определяется тенденция к снижению 16-альфа-гидроксиэстрона (16-?-OHE1), поэтому соотношение 2-OHE1 к 16-?-OHE1 (2/16) также значимо растет (рис. 4). Финастерид не влияет на содержание гидроксиэстронов и соотношение 2/16 (p < 0,05).
Дополнительный анализ состояния метаболизма эстрогенов был проведен в подгруппах пациентов с различным морфологическим диагнозом в конце лечения. Проверка статистической значимости отличий в показателях метаболизма эстрогенов в подгруппах с различным исходом лечения показала, что в первой группе содержание и соотношение гидроксиэстронов одинаковы у пациентов с наличием и отсутствием ПИН в конце лечения. Во второй группе в подгруппе с сохраняющейся в конце лечения ПИН соотношение 2-OHE1 к 16-?-OHE1 было значимо ниже, чем в подгруппе с регрессировавшей ПИН.
Оценка морфологического состояния ткани предстательной железы пациентов, включенных в исследование, показала, что Индигал, как и финастерид, приводит к значимой регрессии ПИН (р = 0,02) и уменьшению частоты выявления ПИН (р = 0,01), при этом препараты практически одинаково эффективны (табл. 1). Межгрупповых отличий в частотах различных морфологических диагнозов нет. Проведенный анализ не выявил корреляций взаимосвязи между формой ДГП (соотношением строма/паренхима), степенью выраженности хронического воспаления (в баллах) и основными эффектами терапии в отношении уродинамических показателей, объема простаты, уровня ПСА, метаболитов эстрогенов и индексов симптомов IPSS и NIH-CPSI.
Обсуждение
Сегодня в мире проводится большое количество исследований, направленных на поиски агентов, способных предотвращать развитие рака различной локализации, включая рак предстательной железы. В 1993 г. было начато исследование по предотвращению рака предстательной железы (Prostate Cancer Prevention Trial – PCPT), главным объектом изучения которого являлся ингибитор 5-альфа-редуктазы финастерид. Результаты исследования показали, что прием финастерида снижает частоту развития рака простаты на24,8%. Это объясняется тем, что предстательная железа является гормонозависимым органом. [26]. Вместе с тем существуют и иные гормональные механизмы, ответственные за морфологические характеристики простаты и процессы клеточной пролиферации в органах и тканях, например, соотношение различных фракций эстрогенов. Одним из препаратов, оказывающих непосредственное влияние на эти процессы, является Индигал, содержащий два основных действующих компонента: индол-3-карбинол (I3C) и эпигаллокахетин-3-галлат (EGCG).
К настоящему времени накоплен огромный объем экспериментального и практического материала, свидетельствующего о том, что I3C и EGCG – поистине уникальные противоопухолевые соединения, эффективные в отношении большого числа опухолей эпителиального происхождения [3, 5, 7, 11, 25]. Это связано с их способностью блокировать молекулярные механизмы, стимулирующие патологическую клеточную пролиферацию и последующий канцерогенез. Комбинированное использование I3C и EGCG нормализует гормональный баланс, блокирует все основные (в том числе гормононезависимые) сигнальные пути, приводящие к патологической клеточной пролиферации, устраняет противовоспалительную реакцию, стимулирует апоптоз трансформированных клеток, подавляет патологический рост кровеносных сосудов.
В большом количестве экспериментальных исследований показано, что I3C и его основное метаболическое производное – 3,3`-дииндолилметан (DIM) – проявляют высокую противоопухолевую эффективность в отношении рака предстательной железы [22]. Установлено, что вусловиях in vitro I3C дозо- и вре-мязависимым образом ингибирует рост андроген-зависимых и андроген-независимых клеточных культур предстательной железы. При этом подавляется экспрессия стимуляторов клеточного цикла – циклинов и циклин-зависимых киназ – и, напротив, повышается уровень белков – ингибиторов клеточного деления – р21, р27 [5, 27].
Важнейшим биологическим свойством I3C является способность данного соединения блокировать проведение в клетках простаты андроген-зависимых пролиферативных сигналов на самых первых этапах их реализации посредством ингибирования экспрессии андрогеновых рецепторов [10]. Помимо этого, так же как в других клеточных системах, I3C индуцирует апоптоз простатических клеток [20], опосредованный системой белков Bax/Bcl, а также блокирует сигнальные каскады, активируемые факторами роста и осуществляемые посредством ядерного фактора транскрипции NF-kB [5] и протеинкиназы Akt [6]. Данные сигнальные пути регулируют баланс между клеточной выживаемостью и гибелью и рассматриваются как дополнительная возможность реализации апоптоза в простатических клетках [24].
Кроме того, на гормон-чувствительных клетках предстательной железы (клеточная культура LNCaP) показана способность DIM конкурентно связываться с андрогенными рецепторами, подавляя таким образом транслокацию их в ядро с последующей активацией генной транскрипции, а также экспрессию промотора гена, кодирующего простатоспецифический антиген ПСА (белок ПСА – специфическая протеаза простаты – является классическим маркером рака предстательной железы, продуцирующимся в избыточном количестве опухолевыми простатическими клетками). В той же работе в результате проведенных структурных исследований было установлено, что по молекулярной геометрии DIM чрезвычайно похож на известный синтетический антиандроген Касодекс [17], который, однако, в отличие от DIM способствует транслокации андрогеновых рецепторов в ядро.
Второй компонент препарата Индигал – EGCG – так же как и I3C, обладает мощными антипролиферативными и проапоптотическими свойствами. Достоверно установлено, что I3C и EGCG блокируют внутриклеточные сигнальные пути, индуцируемые полипептидными ростовыми факторами [19, 23]. Способность EGCG блокировать цитокинзависимые пути стимуляции опухолевого роста и таким образом подавлять патологические воспалительные реакции доказана еще более убедительно, чем для I3C. На эпителиальных опухолевых клетках различного происхождения установлено, что EGCG в физиологических концентрациях эффективно ингибирует экспрессию ключевого фермента цикла арахидоновой кислоты – циклооксигеназы 2 (COX-2), который стимулируют митогенные форболовые эфиры [9, 15].
Кроме того, есть данные, что EGCG ингибирует TNF-индуцируемую активацию ядерного фактора транскрипции NF-kB, который, как известно, является конечным эффектором сигнальных путей, индуцируемых не только ростовыми факторами, но и провоспалительными цитокинами. Что касается проапоптотических свойств EGCG, то для него, так же как и для I3C, показана способность к коммитированию опухолевых клеток к апоптозу, протекающему по описанному выше митохондриальному механизму. Селективная проапоптотическая активность EGCG (20–100 мкМ) была показана на клеточных моделях гормон-чувствительных и гормон-резистентных клеток молочной железы и простаты [8, 13]. При этом инициировался тот же каскад событий, что и в случае с I3C.
Еще одной важной составляющей противоопухолевой активности препарата Индигал является способность входящих в его состав компонентов подавлять патологический рост кровеносных сосудов, часто сопровождающий гиперпластические клеточные процессы. В многочисленных экспериментальных исследованиях было показано, что эпигаллокатехин-3-галлат является эффективным ингибитором фактора роста эндотелия сосудов VEGF – ключевого индуктора ангиогенных процессов [11, 26] – и его рецептора VEGFR [16, 18]. Кроме того, EGCG препятствует самому процессу взаимодействия фактора VEGF с рецептором VEGFR [14].
Основной метаболический продукт I3C – DIM – также обладает антиангиогенной активностью. Установлено, что в условиях in vitro микромолярные концентрации DIM эффективно подавляют пролиферацию и миграцию эндотелиальных клеток, а также их способность образовывать сосуды. Введенный подкожно экспериментальным животным DIM (5 мг/кг ежедневно) на 74% подавлял неоангиогенез [4].
Таким образом, очевидно, что активные действующие компоненты препарата Индигал – I3C и EGCG – эффективно блокируют основные сигнальные механизмы патологической клеточной пролиферации, индуцируют апоптоз трансформированных клеток, а также подавляют воспалительные реакции и патологический рост кровеносных сосудов, то есть осуществляют множественное блокирование основных звеньев патогенеза гиперпластических процессов в тканях предстательной железы.
Результаты проведенного нами клинического исследования подтверждают экспериментальные данные. Так, морфологическое исследование биоптатов предстательной железы у пациентов с выявленной при первичной биопсии ПИН, принимавших Индигал в течение 6 месяцев, показывает значительное уменьшение частоты предопухолевых изменений ткани простаты и/или снижение степени выраженности неоплазии. При этом не отмечено статистически значимой разницы в результатах профилактического приема пациентами финастерида, роль которого в предотвращении рака простаты была показана большим исследованием PCPT.
Выводы
Индигал является безопасным и эффективным препаратом для лечения симптомов ДГП и профилактики ПИН и соответственно рака простаты. Индигал продемонстрировал сходный с финастеридом уровень эффективности в лечении ПИН. Следует отметить, что в отличие от финастерида Индигал не вызывает снижения уровня ПСА крови, что особенно актуально у группы пациентов с наличием ПИН (группа риска развития рака простаты), поскольку неконтролируемое изменение уровня маркера может негативно повлиять на возможности раннего выявления рака.
Экономическая целесообразность применения Индигала с целью медикаментозной профилактики развития рака простаты заключается в том, что препарат обладает достаточной эффективностью в лечении симптомов ДГП, что также доказывают результаты проведенного исследования. Индигал способствует улучшению обмена эстрогенов у больных с ДГПЖ и ПИН, усиливая конверсию эстрона в 2-гидроксиэстрон и увеличивая соотношение 2-гидроксиэстрона к 16-альфа-гидроксиэстрону. У финастерида подобного действия не отмечено. При этом пациенты с регрессировавшей ПИН характеризуются более благоприятным соотношением метаболизма эстрогенов, что еще раз доказывает значение нормализации гормонального баланса в тканях предстательной железы для профилактики рака.
Индигал не влияет на уровень андрогенов, в отличие от финастерида, что делает его более приемлемым в группе сексуально активных пациентов, поскольку одним из наиболее значимых нежелательных эффектов финастерида является развитие у пациентов симптомов эректильной дисфункции. Таким образом, результаты проведенного исследования позволяют рекомендовать применение препарата Индигал в клинической практике у пациентов с симптомами ДГП и без таковых в случае выявления ПИН при первичной биопсии простаты с целью профилактики развития рака предстательной железы.
1. Ahmad N., Feyes D.K., Nieminen A.L., Agarwal R., Mukhtar H. Green tea constituent epigallocatechin-3-gallate and induction of apoptosis and cell cycle arrest in human carcinoma cells // J. Natl. Cancer Inst. 1997. Vol. 89. P. 1881–1886.
2. Berman D.M., Yang J., Epstein J.L. Foamy gland high-grade intraepithelial neoplasia // Am. J. Surg. Pathol. 2000. Vol. 24. P. 140–144.
3. Bradlow H.L., Sepkovic D.W., Telang N.T., Osborne M.P. Multifunctional aspects of the action of indole-3-carbinol as an antitumor agent // Ann. NY: Acad. Sci. 1999. Vol. 889. P. 204–213.
4. Chang X., Tou J.C., Hong C., Kim H.-A., Riby J.E., Firestone G.L., Bjeldanes L.F. 3,3’-Diindolylmethane inhibits angiogenesis and the growth of transplantable human breast carcinoma in athymic mice // Carcinogenesis. 2005. Vol. 264 (4). P. 771–778.
5. Chinni S.R., Li Y., Upadhyay S. et al. Indole-3-carbinol (I3C) induced cell growth inhibition, G1 cell cycle arrest and apoptosis in prostate cancer cells // Oncogene. 2001. Vol. 20. P. 2927–2936.
6. Chinni S.R., Sarkar F.H. Akt inactivation is a key event in indole-3-carbinol-induced apoptosis in PC-3 cells // Clin. Cancer Res. Vol. 8. 2002. P. 1228–1236.
7. Fujimoto N., Sueoka N., Sueoka E. et al. Lung cancer prevention with (-)-epigallocatechin gallate using monitoring by heterogeneous nuclear ribonucleoprotein B1 // Int. J. Oncol. 2002. Vol. 20. P. 1233–1239.
8. Gupta S., Hussain T., Mukhtar H. Molecular pathway for (-)-epigallocatechin-3-gallate-induced cell cycle arrest and apoptosis of human prostate carcinoma cells // Arch. Biochem. Biophys. 2003. Vol. 410 (1). P. 177–185.
9. Hong J., Smith T.J., Ho C.T., August D.A., Yang C.S. Effects of purified green and black tea polyphenols on cyclooxygenase- and lipoxygenase-dependent metabolism of arachidonic acid in human colon mucosa and colon tumor tissues // Biochem. Pharmacol. 2001. Vol. 62 (9). P. 1175–1183.
10. Hsu J.C., Zhang J., Dev A., Wing A., Bjeldanes L.F., Firestone G.L. Indole-3-carbinol inhibition of androgen receptor expression and downregulation of androgen responsiveness in human prostate cancer cells // Carcinogenesis. 2005. Vol. 26. P. 1896–1904.
11. Jin L., Qi M., Chen D.Z. et al. Indole-3-carbinol prevents cervical cancer in human papilloma virus type 16 (HPV16) transgenic mice // Cancer Res. 1999. Vol. 59. P. 3991–3997.
12. Jung Y.D., Kim M.S., Shin B.A. et al. EGCG, a major component of green tea, inhibits tumour growth by inhibiting VEGF induction in human colon carcinoma cells // Br. J. Cancer. 2001. Vol. 84. P. 844–850.
13. Kazi A., Smith D.M., Zhong Q., Dou Q.P. Inhibition of Bcl-XL phosphorylation by tea polyphenols or epigallocatechin-3-gallate is associated with prostate cancer cell apoptosis // Mol. Pharmacol. 2002. Vol. 62. P. 765–771.
14. Kondo T., Ohta T., Igura K., Hara Y., Kaji K. Tea catechins inhibit angiogenesis in vitro, measured by human endothelial cell growth, migration and tube formation, through inhibition of VEGF receptor binding // Cancer Letters. 2002. Vol. 180 (2). P. 139–144.
15. Kundu J.K., Na H.K., Chun K.S., Kim Y.K., Lee S.J., Lee S.S., Lee O.S., Sim Y.C., Surh Y.J. Inhibition of phorbol ester-induced COX-2 expression by epigallocatechin gallate in mouse skin and cultured human mammary epithelial cells // J. Nutr. 2003. Vol. 133 (11). Supl. 1. P. 3805S–3810S.
16. Lamy S., Gingras D., Beliveau R. Green tea catechins inhibit vascular endothelial growth factor receptor phosphorylation // Cancer Res. 2002. Vol. 62. P. 381–385.
17. Le H.T., Schaldach C.M., Bjeldanes L.F. Plant-derived 3,3’-diindolylmethane is a strong androgen antagonist in human prostate cancer cells // J. Biol. Chem. 2003. Vol. 278. P. 21136–21145.
18. Lee Y.K., Bone N.D., Strege A.K., Shanafelt T.D., Jelinek D.F., Kay N.E. VEGF receptor phosphorylation status and apoptosis is modulated by a green tea component, epigallocatechin-3-gallate (EGCG), in B-cell chronic lymphocytic leukemia // Blood. 2004. Vol. 104. P. 788–794.
19. Masuda M., Suzuki M., Lim J.T.E., Weinstein I.B. Epigallocatechin-3-gallate inhibits activation of HER-2/neu and downstream signaling pathways in human head and neck and breast carcinoma cells // Clin. Cancer Res. 2003. Vol. 9. P. 3486–3491.
20. Nachshon-Kedmi M., Yannai S., Haj A., Fares F.A. Indole-3-carbinol and 3,3’-diindolylmethane induce apoptosis in human prostate cancer cells // Food Chem. Toxicol. Vol. 41. 2003. P. 745–752.
21. Reyes A.O., Swanson P.E., Carbone J.M., Humphrey P.A. Unusual histologic types of high-grade prostatic intraepithelial neoplasia // Am. J. Surg. Pathol. 1997. Vol. 21. P. 1215–22.
22. Ries L.A.G., Eisner M.P., Kosary C.L., Hankey B.F., Miller B.A., Clegg L. et al. SEER Cancer Statistics Review, 1975–2001. Bethesda, MD: National Cancer Institute, 2004.
23. Sah J.F., Balasubramanian S., Eckert R.L., Rorke E.A. Epigallocatechin-3-gallate inhibits epidermal growth factor receptor signaling pathway // J. Biol. Chem. 2004. Vol. 279. P. 12755–12762.
24. Sarkar F.H., Li Y. Indole-3-carbinol and prostate cancer // J. Nutr. 2004. Vol. 134. P. 3493S–3498S.
25. Sartippour M.R., Shao Z.M., Heber D. et al. Green tea inhibits vascular endothelial growth factor (VEGF) induction in human breast cancer cells // J. Nutr. 2002. Vol. 132. P. 2307–2311.
26. Thompson I.M., Goodman P.J., Tangen C.M., Lucia M.S., Miller G.J., Ford L.C. et al. The influence of finasteride on the development of prostate cancer // N. Engl. J. Med. 2003. Vol. 349. P. 211–220.
27. Zhang J., Hsu B.A.J., Kinseth B.A.M., Bjeldanes L.F., Firestone G.L. Indole-3-carbinol induces a G1 cell cycle arrest and inhibits prostate-specific antigen production in human LNCaP prostate carcinoma cells // Cancer. 2003. Vol. 98. P. 2511–2520.
Новости на тему
17.02.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.