количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Возможности альтернативного консервативного ведения пациентов с первичным гиперпаратиреозом на фоне Фосамакса
Эффективная фармакотерапия. Эндокринология. СПЕЦВЫПУСК № 2.
- Аннотация
- Статья
- Ссылки
Первичный гиперпаратиреоз (ПГПТ) – наиболее частая причина вторичного остеопороза. Единственным методом лечения, приводящим к ремиссии заболевания, является хирургическое удаление образования околощитовидной железы (ОЩЖ). В последнее время, учитывая патогенез гиперпаратиреоидной остеодистрофии, исследуются консервативные возможности лечения костных нарушений с использованием антирезорбтивных средств. Полученные данные свидетельствуют о перспективности данного направления для поддержания отделов, богатых трабекулярной костной тканью. Однако сведений, подтверждающих значимое положительное влияние консервативной терапии на кортикальную кость, наиболее подверженную патологическому действию повышенного уровня паратиреоидного гормона (ПТГ), в зарубежных работах получено не было. Представляем результаты российского открытого проспективного исследования эффективности и безопасности терапии Фосамаксом у женщин в менопаузе с ПГПТ, позволяющей остановить прогрессирование костных потерь всех отделов скелета, а также предотвратить развитие других проявлений основного заболевания.
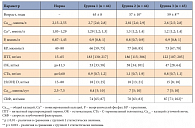
Таблица 1. Характеристика групп пациентов на момент включения в исследование
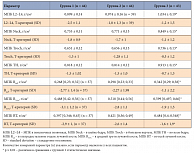
Таблица 2. Характеристика МПК групп на момент включения в исследование
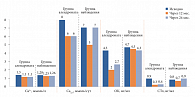
Рис. 1. Динамика гормонально-биохимических показателей на фоне различных видов консервативного ведения пациентов

Рис. 2. Динамика МПК L2–L4 при ПГПТ за 24 месяца на фоне различных методов ведения: а) хирургическое лечение; б) алендронат; в) динамическое наблюдение (М ± SD)

Рис. 3. Динамика R33% при ПГПТ за 24 месяца на фоне различных методов ведения: а) хирургическое лечение; б) алендронат; в) динамическое наблюдение) (М ± SD)

Таблица 3. Сравнительная характеристика состояния костной ткани в области R33% в группах с положительной динамикой МПК на фоне консервативного и хирургического лечения в первый год
Таким образом, учитывая широкую распространенность ПГПТ, особенно его мягкой формы, не удивительно, что в последнее время во всем мире активно поднимается вопрос выбора тактики ведения пациентов. При своевременном выявлении мягкой формы заболевания, а также при отсутствии по различным причинам (включая отказ самого пациента) возможности проведения хирургического лечения манифестной формы актуальным становится применение консервативного ведения ПГПТ.
Основываясь на данных о патогенезе костных нарушений, наиболее целесообразной с точки зрения предотвращения потери костной массы и снижения риска переломов представляется терапия антирезорбтивными препаратами, среди которых лучше всех целям терапии вторичного остеопороза отвечает группа бисфосфонатов. На данный момент самой большой доказательной базой обладает алендронат, изучавшийся в ряде зарубежных клинических исследований [1, 2, 3, 4].
В России первые исследования тактики консервативного ведения пациентов с ПГПТ предприняты несколько лет назад. Полученные к настоящему времени результаты позволяют считать терапию алендронатом обоснованной альтернативой хирургическому лечению мягкой формы заболевания.
Предлагаем результаты исследования, проведенного на базе отделения нейроэндокринологии и остеопатий ФГБУ «Эндокринологический научный центр» (зав. отд. д. м. н. Л.Я. Рожинская).
Материалы и методы
Для оценки эффективности и безопасности применения бисфосфонатов у пациентов с ПГПТ и костными нарушениями проведено открытое проспективное двухлетнее исследование, в которое включена 131 пациентка с ПГПТ в менопаузе (уровнем ПТГ не более 500 пг/мл). 44 женщины (основная группа) в течение 24 месяцев получали алендронат (препарат Фосамакс компании Merck Sharp & Dohme) 70 мг 1 раз в неделю (группа 1), 44 женщины проходили обследование до и в течение 24 месяцев после паратиреоидэктомии (ПТЭ) (группа 2). Результаты группы 1 также сравнивались с данными динамического обследования 43 пациенток, не получавших в течение 24 месяцев лечения. Характеристика групп представлена в таблице 1.
Применялись следующие критерии исключения: ПГПТ в рамках синдрома множественной эндокринной неоплазии (МЭН); снижение скорости клубочковой фильтрации (СКФ) менее 60 мл/мин; наличие первичных заболеваний почек, желудочно-кишечного тракта (ЖКТ), остеомаляции, тяжелых соматических заболеваний; терапия противосудорожными препаратами, тиазидными диуретиками, препаратами лития, способными привести к развитию вторичного повышения уровня ПТГ; применение препаратов, оказывающих выраженное влияние на костную ткань (заместительной гормональной терапии, бисфосфонатов, кальцитонина, солей стронция и фтора, терипаратида) в течение 5 лет, предшествовавших исследованию.
Исходно в группе 1 у 81% (36/44) пациенток был диагностирован остеопороз хотя бы в одном отделе скелета и у 19% (8/44) пациенток – остеопения. При оценке МПК позвоночника исключались пациентки с доказанными компрессионными переломами позвонков или снижением высоты роста более чем на 2 см за год (5 пациенток из группы 1). Оценка состояния лучевой кости по техническим причинам проведена у 37 пациенток.
В группе 2 остеопороз имели 79% (35/44) пациенток и остеопению – 21% (9/44).
В группе наблюдения (группа 3), состоявшей из пациенток, по различным причинам не получавших консервативного или хирургического лечения ПГПТ, в 74% (32/43) случаев наблюдался остеопороз и в 26% (11/43) – начальные костные изменения или нормальная МПК. При необходимости эти пациентки придерживались гипокальциемической диеты и увеличивали объем потребляемой жидкости.
На момент начала исследования значимых различий между группами по параметру индекс массы тела (ИМТ) и показателям, характеризующим ПГПТ (уровень ПТГ, кальция (Ca), неорганического фосфата (P), остеокальцина (ОК), бета-изомера С-терминального телопептида молекулы коллагена I типа (СТх), витамина D, состояние фильтрационной функции почек и экскреции кальция с мочой), не выявлено (р > 0,05) (табл. 1). При этом пациенты основной группы были статистически достоверно старше других (р < 0,01). Пациентки, подверженные впоследствии хирургическому лечению (ПТЭ) (группа 2), имели достоверно бóльшие размеры объемного образования ОЩЖ, а группа динамического наблюдения (группа 3) состояла из женщин со значимо бóльшим ИМТ, лучшей фильтрационной функцией почек и значимо бóльшей МПК всех отделов (табл. 1 и 2).
Статистический анализ проводился при помощи пакета STATISTICA 6,0 (Stat-Soft, 2001). Числовые данные приведены в виде средних значений со стандартным квадратичным отклонением (М ± SD) и, при необходимости, доверительного интервала (ДИ) при нормальном распределении и в виде медианы и значений 25-го и 75-го квартилей при отсутствии нормального распределения (Me [25; 75]). Достоверность различий для параметрических показателей определялась с помощью критерия t Стьюдента, для непараметрических – критерия χ2. Для сравнения независимых выборок использован критерий Манна – Уитни, Крускела – Уоллиса, а также расчет ранговой корреляции Спирмена (r). Для оценки влияния одного или нескольких признаков на другой использовались однофакторный (коэффициент регрессии R) и многофакторный регрессионные методы (коэффициент beta). Сравнение исследуемых параметров до и после лечения осуществлялось при помощи критерия Вилкоксона. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты исследования и их обсуждение
По результатам проведенного исследования подтверждено достижение ремиссии гиперпаратиреоза у 100% пациенток после хирургического лечения (группа 2), что привело к достоверному снижению уровня ПТГ и показателей фосфорно-кальциевого обмена и костного метаболизма (р < 0,001) (рис. 1). В результате наблюдалось значительное улучшение самочувствия пациенток, восстановление к концу второго года после операции имеющихся костных потерь у пациенток с исходно диагностированным остеопорозом до степени остеопении в 47% (16/35) случаев. Среди них ремиссия нефролитиаза наблюдалась в 80% случаев, а в 50% через 24 месяца у пациентов с исходным нефролитиазом конкрементов не обнаружено.
Прием Фосамакса не приводит к ремиссии гиперпаратиреоза, но сопровождается статистически достоверным снижением уровня кальция крови (за 1 год – -4,3 ± 5,4%, р = 0,00005; за 2 года – -2,7 ± 6,4%, р = 0,04) и кальциурии (за 1 год – от 8,5 [6,0; 11,7] ммоль/сут до 6,3 [3,7; 7,6] ммоль/сут, р = 0,007; за 2 года – до 6,5 [4,6; 9,0] ммоль/сут, р = 0,15) без ответного повышения ПТГ (исходно 157,6 [124; 200] пг/мл, через 1 год – 158 [113; 205] пг/мл, через 2 года – 136 [103; 174] пг/мл) (рис. 1).
Уровень маркеров костного обмена также достоверно снизился (СТх – на 66% [37%; 77%] за 1 год и на 60% [5%; 75%] за 2 года, ОК – на 39% [29%; 55%] и 27% [7%; 56%] соответственно, р < 0,01) (рис. 1).
В группе наблюдения на фоне сохранявшегося гиперпаратиреоза за первый год уровень ОК и СТх статистически значимо не изменился, а за второй год отмечено достоверное повышение активности резорбтивных процессов (СТх повысился на 53% [13%; 160%], р = 0,01) (рис. 1). Таким образом, достоверного изменения уровня кальциемии и ПТГ не произошло, но выявлено прогрессирование экскреции кальция с мочой за сутки (исходно 7,0 [4,9; 10,2] ммоль/сут; через 2 года – 7,7 [5,7; 12,9] ммоль/сут, р = 0,003), что может быть расценено как признак прогрессирования заболевания.
Меньшая частота повышения кальциемии и кальциурии в группе алендроната явилась причиной того, что в целом частота прогрессирования ПГПТ в группе лечения была ниже, чем в группе наблюдения. Прогрессирование заболевания в группе Фосамакса наблюдалось менее чем у 10% пациентов и характеризовалось повышением уровня общего кальция более чем на 0,25 ммоль/л у 5% (2/44) пациенток, увеличением суточной экскреции кальция более 10 ммоль/сут (при исходной нормокальциурии) у 5% (2/44), появлением или усугублением нефролитиаза у 9% (4/44) пациенток.
В 95% случаев на фоне проводимого лечения удалось предотвратить прогрессирование потери костной массы. Среди пациенток с исходной остеопенией развитие остеопороза наблюдалось всего в 5% случаев (2/44), низкоэнергетический перелом возник только у одной пациентки (2%).
При этом в группе наблюдения (группа 3) повышение уровня общего кальция крови наблюдалось у 9% (4/43) пациенток, суточной экскреции кальция – у 5% (2/43), развитие остеопении или остеопороза среди пациенток, исходно имевших нормальную МПК или остеопению, – у 12% (5/43), низкоэнергетический перелом – у 2% (1/43), снижение роста более чем на 2 см за 1 год – у 5% (2/43), появление или усугубление нефролитиаза – у 12% (5/43), обострение язвенной болезни желудка – у 2% (1/43), снижение СКФ от 63 до 50 мл/мин – у 2% (1/43) пациенток. Отсутствие разницы в снижении частоты переломов может быть связано с более выраженным остеопорозом в группе алендроната на момент начала лечения и недостаточной продолжительностью лечения. Одна пациентка через 9 месяцев приема алендроната получила перелом шейки бедра, однако тяжесть приложенной нагрузки не позволяет расценить его как малотравматичный.
Из нежелательных явлений, возникших на фоне приема алендроната, можно отметить только возникновение головных болей через 9 месяцев после начала лечения у одной пациентки, имеющей энцефалопатию смешанного генеза, в связи с чем она прервала курс лечения. Одна пациентка, имевшая язвенную болезнь желудка в анамнезе, вечером накануне приема алендроната принимала омепразол, что позволило избежать обострений. В дальнейшем алендронат у нее был заменен на золедроновую кислоту. Значимого изменения среднего уровня СКФ ни в одной группе не наблюдалось.
В ходе большинства проведенных исследований алендроната показана эффективность одно-двухгодичного лечения в отношении повышения МПК поясничного отдела позвоночника и, в меньшей степени, проксимального отдела бедра [1, 2, 3, 4]. Но при этом прирост МПК во всех отделах скелета был меньше, чем в первые годы после хирургического лечения (величина прироста МПК после ПТЭ достигает 15%). На фоне консервативного лечения достоверной положительной динамики в лучевой кости, для которой типично наибольшее снижение МПК при ПГПТ, ранее выявлено не было.
Согласно полученным в ходе нашего исследования результатам, в группе женщин в постменопаузе после ПТЭ в среднем наблюдается достоверная положительная динамика МПК во всех отделах скелета (рис. 2а и 3а). При этом через 12 месяцев после операции в 57% случаев (21/37) в области средней трети лучевой кости (R33%) отмечена выраженная положительная динамика, составившая в среднем +7,5 ± 8% [95% ДИ 4; 11].
Отметим, что в первый год после ПТЭ восстановительные процессы не имеют генерализованного характера; в области лучевой кости у 43% (16/37) пациенток выявлена отрицательная динамика МПК, несколько превышающая границы погрешности метода (-2,3 ± 3% [95% ДИ -5; -1]), что сопровождалось активным приростом МПК в других отделах скелета. К концу второго года после хирургического лечения отрицательная динамика в области лучевой кости была компенсирована в половине случаев.
В области позвоночника, наиболее уязвимого отдела скелета в постменопаузальном периоде, положительная динамика к концу первого года после операции наблюдалась значительно чаще – в 88% (34/39) случаев – и в среднем составила +10 ± 7%. Отрицательная динамика наблюдалась только в 12% (5/39) случаев (-3 ± 2%), при этом никаких статистически достоверных отличий между группами с различной динамикой выявить не удалось ни по одному параметру, характеризующему заболевание, исходному уровню показателей фосфорно-кальциевого обмена и костного метаболизма (р > 0,05). В течение последующего года все пациентки, имевшие за первый год отрицательную динамику МПК в области позвоночника, продемонстрировали ее прирост, при этом в половине случаев он превысил предыдущую потерю. Таким образом, несмотря на наличие риска развития постменопаузального остеопороза, нормализация уровня ПТГ, фосфорно-кальциевого обмена, снижение активности маркеров костного метаболизма являются положительным фактором, влияющим на МПК постменопаузальных женщин после хирургического лечения ПГПТ.
Терапия алендронатом, как и ожидалось, уже через 1 год привела к статистически достоверному приросту МПК в областях, богатых трабекулярной костной тканью (полученные результаты сопоставимы с данными зарубежных работ). Максимальное увеличение параметра наблюдалось в области поясничных позвонков (L2–L4) – +3 ± 4,9% [95% ДИ 1; 5] (p = 0,0001) (рис. 2б и 3б). По показателю бедра в целом (TH) он был равен 2,5 ± 5% [95% ДИ 0; 4] (р = 0,006), а в области большого вертела – +2 ± 4% [95% ДИ 0; 3] (p = 0,009). В течение следующего года лечения отмеченная динамика сохранялась (р < 0,05). В области шейки бедра (Neck) прирост также имел место (+1 ± 4% [95% ДИ 0; 3] (р = 0,06)), но, по полученным в общем по группе данным, достигал уровня достоверности только к концу второго года лечения – +2,3 ± 5,7% [95% ДИ 0; 4] (р < 0,05).
Наилучший результат наблюдался у пациенток, характеризовавшихся наиболее выраженным и стойким снижением показателей активности костной резорбции (СТх r = -0,76, p = 0,004), что, скорее всего, связано с регулярностью применения терапии и комплаентностью пациенток. Это позволяет использовать исследование СТх для прогнозирования эффективности терапии.
Одним из основных вопросов эффективности применения бисфосфонатов является возможность снижения костных потерь в области кортикальной костной ткани. Согласно полученным в ходе исследования результатам, на фоне лечения алендронатом динамика МПК R33% в общем по группе была положительной, но изменения не достигали уровня достоверности даже к концу второго (р = 0,6; n = 37) (рис. 3б) и в последующем – к концу третьего года лечения (р = 0,2; n = 28), в отличие от достоверного улучшения этого параметра у пациенток после ПТЭ (рис. 3а). При этом отметим, что после операции положительная динамика наблюдалась только в 57% случаев (21/37) (+7,5 ± 8% [95% ДИ 4; 11]). В 51% случаев на фоне лечения алендронатом динамика была также достоверно положительной уже к концу первого года лечения. К концу второго года динамика МПК R33% в группе алендроната сохранилась, хотя и не достигла уровня достоверности (+4 ± 12% [-23; 32], р = 0,08), а при попарном сравнении с группой после хирургического лечения оказалась сопоставимой (р = 0,7) с динамикой МПК за 24 месяца после ПТЭ (+6 ± 8% [-0,3; 13], р = 0,03), что свидетельствует об эффективности консервативной терапии (табл. 3).
Проведенный корреляционный анализ показал, что динамика МПК на фоне терапии Фосамаксом в области лучевой кости в наибольшей мере ограничивается уровнем ПТГ (через 12 мес. r = -0,6, р = 0,00007; через 24 мес. r = -0,56, р = 0,00001), его динамикой на фоне лечения (r = -0,49, p = 0,01), а также исходной активностью показателей костной резорбции (СТх r = -0,44, р = 0,01) и способности компенсации их нарушений на фоне терапии (ОК r = -0,39, р = 0,03).
Таким образом, прогрессирование заболевания (повышение уровня ПТГ) приводит к снижению эффективности Фосамакса у пациенток с ПГПТ. Значимое влияние на состояние МПК R33% на фоне лечения оказывает также срок менопаузы на момент начала лечения (r = -0,52, р = 0,001), который обусловливает исходную потерю МПК.
В группе наблюдения в течение первого года отмечалась тенденция к снижению МПК лучевой кости при сравнительно стабильном состоянии остальных отделов. Однако двухгодичное наблюдение выявило достоверное снижение МПК L2–L4 – -4,2 ± 4,0% [95% ДИ -7,5; -0,8], TH – -3,5 ± 3,8% [95% ДИ -5,4; -1,5], R33% – -4,0 ± 6,5% [95% ДИ -7,6; -0,4], то есть как кортикальных, так и трабекулярных отделов скелета (рис. 2в и 3в). Сравнительный дисперсионный анализ динамики изменения костной плотности показал, что, несмотря на отсутствие ремиссии первичного заболевания (ПГПТ), терапия Фосамаксом приводит к статистически достоверному улучшению качества кости по сравнению с пациентами без лечения в отделах, богатых как трабекулярной, так и кортикальной костной тканью, – различия между группами 3 и 1 достоверны в отделах L2–L4 (p = 0,00004), Neck (р = 0,005), TH (р = 0,001), R33% (p = 0,006).
В целом проведенное исследование показало эффективность и безопасность применения Фосамакса у пациенток в менопаузе с ПГПТ и остеопорозом. Лечение сопровождается приростом МПК, более быстрым и выраженным в трабекулярных отделах и меньшим и более медленным – в кортикальных. По полученным результатам, наибольшей эффективности удается достичь у пациенток с относительно мягким течением ПГПТ, а у большинства более тяжелых больных – при невозможности применения хирургического лечения – прием алендроната позволяет предотвратить прогрессирующее снижение МПК, наблюдающееся при естественном течении болезни. При этом, несмотря на патогенетическую обоснованность, терапия антирезорбтивными средствами не устраняет причину заболевания, не препятствует его дальнейшему прогрессированию и по эффективности набора МПК не является альтернативой хирургическому вмешательству при ПГПТ.
При высоком хирургическом риске, связанном с сопутствующей патологией, при рецидиве ПГПТ, а также при отказе пациента от операции целесообразно назначать антирезорбтивную терапию уже на стадии остеопении. Это связано с тенденцией к снижению МПК в отсутствие лечения, а также с необходимостью длительного, не менее двух лет, лечения для получения клинически значимого результата.
1. Chow C.C., Chan W.B., Li J.K. et al. Oral alendronate increases bone mineral density in postmenopausal women with primary hyperpara- thyroidism // J. Clin. Endocrinol. Metab. 2003. Vol. 88. No 2. P. 581–587.
2. Khan A.A., Bilezikian J.P., Kung A.W. et al. Alendronate in primary hyperparathyroidism: a double-blind, randomized, placebo-controlled trial // J. Clin. Endocrinol. Metab. 2004. Vol. 89. No 7. P. 3319–3325.
3. Parker C.R., Blackwell P.J., Fairbairn K.J. et al. Alendronate in the treatment of primary hyperparathyroid-related osteoporosis: a 2-year study // J. Clin. Endocrinol. Metab. 2002. Vol. 87. No 10. P. 4482–4489.
4. Rossini M., Gatti D., Isaia G. et al. Effects of oral alendronate in elderly patients with osteoporosis and mild primary hyperparathyroidism // J. Bone Miner. Res. 2001. Vol. 16. No 1. P. 113–119.
Новости на тему
21.02.2022
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.