количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Возможности применения противовирусного препарата Кагоцел® для профилактики и лечения гриппа и других острых респираторных инфекций у часто болеющих детей младшего возраста
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эпидемиология и инфекции" № 1
- Аннотация
- Статья
- Ссылки
На основании проведенных авторами клинических исследований показана эффективность и безопасность применения препарата Кагоцел® у детей в возрасте 2–6 лет в лечении ОРВИ и гриппа независимо от этиологии и клинических проявлений заболевания, что выражалось в уменьшении продолжительности симптомов интоксикации, лихорадки, катаральных явлений в носо- и ротоглотке, основных симптомов стенозирующего ларинготрахеита; сокращении сроков антибиотикотерапии и пребывания в стационаре у детей с бактериальными осложнениями; отсутствии побочных эффектов и нежелательных явлений на фоне приема препарата.
Продемонстрирована эффективность применения препарата Кагоцел® для профилактики гриппа и других ОРВИ у детей в возрасте 3–6 лет с часто рецидивирующими бактериальными и вирусными инфекциями верхних дыхательных путей.
Продемонстрирована эффективность применения препарата Кагоцел® для профилактики гриппа и других ОРВИ у детей в возрасте 3–6 лет с часто рецидивирующими бактериальными и вирусными инфекциями верхних дыхательных путей.
На основании проведенных авторами клинических исследований показана эффективность и безопасность применения препарата Кагоцел® у детей в возрасте 2–6 лет в лечении ОРВИ и гриппа независимо от этиологии и клинических проявлений заболевания, что выражалось в уменьшении продолжительности симптомов интоксикации, лихорадки, катаральных явлений в носо- и ротоглотке, основных симптомов стенозирующего ларинготрахеита; сокращении сроков антибиотикотерапии и пребывания в стационаре у детей с бактериальными осложнениями; отсутствии побочных эффектов и нежелательных явлений на фоне приема препарата.
Продемонстрирована эффективность применения препарата Кагоцел® для профилактики гриппа и других ОРВИ у детей в возрасте 3–6 лет с часто рецидивирующими бактериальными и вирусными инфекциями верхних дыхательных путей.
Продемонстрирована эффективность применения препарата Кагоцел® для профилактики гриппа и других ОРВИ у детей в возрасте 3–6 лет с часто рецидивирующими бактериальными и вирусными инфекциями верхних дыхательных путей.
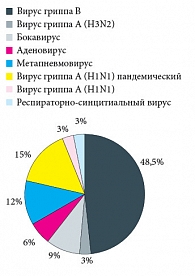
Рис. 1. Этиологическая структура моно-ОРВИ с острым стенозирующим ларинготрахеитом у детей в возрасте от 2 до 6 лет (n = 33) в январе – марте 2010 г.
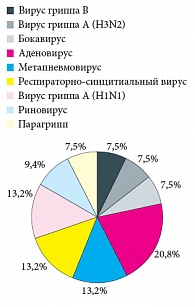
Рис. 2. Этиологическая структура микст-ОРВИ с острым стенозирующим ларинготрахеитом у детей в возрасте от 2 до 6 лет (n = 26) в январе – марте 2010 г.
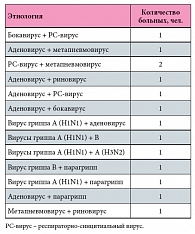
Таблица 1. Варианты сочетаний микст-инфекций у детей в возрасте от 2 до 6 лет, получавших Кагоцел® (n = 14)
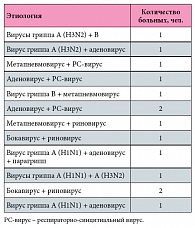
Таблица 2. Варианты сочетаний микст-инфекций у детей в возрасте от 2 до 6 лет, получавших плацебо (n = 12)
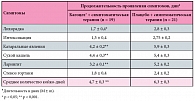
Таблица 3. Продолжительность проявления симптомов ОРВИ на фоне лечения препаратом Кагоцел® в сравнении с плацебо у детей в возрасте от 2 до 6 лет (n = 40)
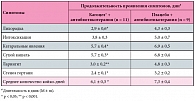
Таблица 4. Продолжительность проявления симптомов ОРВИ на фоне антибиотикотерапии при лечении препаратом Кагоцел® или плацебо у детей в возрасте от 2 до 6 лет (n = 20)
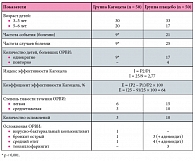
Таблица 5. Показатели эффективности препарата Кагоцел® при профилактике гриппа и других ОРВИ у детей в возрасте от 3 до 6 лет за время 4-недельного курса приема препарата
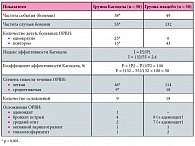
Таблица 6. Показатели эффективности препарата Кагоцел® при профилактике гриппа и других ОРВИ у детей в возрасте от 3 до 6 лет через 4 месяца после окончания приема препарата
Введение
Острые респираторные вирусные инфекции (ОРВИ) являются наиболее распространенными инфекционными заболеваниями. ОРВИ представляют собой полиэтиологичную группу инфекций. Известно более 300 вирусов, размножение которых в клетках эпителия респираторного тракта вызывает развитие клинических признаков воспаления. Для ОРВИ характерна выраженная сезонность, высокая контагиозность, аэрогенный путь передачи, острое течение. Степень тяжести данных инфекций и возможность развития осложнений зависят от многих факторов, присущих как возбудителю (антигенные свойства, лекарственная устойчивость), так и макроорганизму (особенности иммунного ответа, степень зрелости иммунитета, наличие фоновых заболеваний) [1, 2]. Эпидемический характер распространения ОРВИ, наносимый ими экономический ущерб, повышенный риск заболеваемости у детей обусловливают не только медицинскую, но и социальную значимость ОРВИ. Наиболее уязвимой для данных инфекций возрастной группой являются дети от 6 месяцев до 6 лет [3, 4].
К высокой подверженности заболеваемости ОРВИ предрасполагают анатомические особенности строения респираторного тракта у детей, постепенная утрата антител, приобретенных от матери, незрелость собственных иммунных механизмов. Иммунный ответ детей первых 5–7 лет жизни обусловлен несостоятельностью макрофагально-фагоцитарного звена, снижением продукции иммуноглобулинов (Ig) классов G и A, факторов комплемента, незрелостью Т- и В-лимфоцитов. Известно, что резистентность к инфекциям зависит от генетически детерминированной активности иммунокомпетентных клеток (ИКК) человека к выработке интерферона (ИФН). Развитие инфекционного процесса при острых респираторных инфекциях (ОРИ) реализуется в случае имеющегося дефицита синтеза ИФН и других цитокинов, являющихся гуморальными продуктами ИКК.
Для системы ИФН характерны возрастные особенности: доказано, что способность ИКК к синтезу всех видов ИФН у детей раннего возраста снижена. Так, продукция ИФН-альфа (одного из основных противовоспалительных цитокинов) в ответ на проникновение вируса примерно в 10 раз ниже, чем у взрослых. Иммунная система детей характеризуется высокой пролиферативной активностью лимфоцитов с преобладанием фракции недифференцированных, «наивных» лимфоцитов, сниженной цитотоксической и ИФН-продуцирующей активностью ИКК. Часто болеющие дети (ЧБД) составляют от 15 до 80% детского населения. ЧБД подвергаются повторному заражению дыхательных путей более 6 раз в год, а в эпидемический период подъема заболеваемости ОРИ (октябрь – март) – чаще 1 раза в месяц. Показано, что у 76,7–90,0% обследованных пациентов с наличием фоновой патологии, в том числе и у ЧБД, имеющих неблагоприятный аллергоанамнез и/или хронические очаги инфекций, имеет место снижение активности всех показателей ИФН-статуса [5]. Кроме того, способны подавлять интерфероногенез такие распространенные в педиатрической практике факторы, как искусственное вскармливание, наличие перинатальной патологии, сопутствующих и фоновых заболеваний [6–8].
Частым проявлением ОРВИ у детей первых лет жизни бывает острый обструктивный (стенозирующий) ларинготрахеобронхит, который развивается на фоне гиперчувствительности дыхательных путей. По данным нашей клиники, этот синдром чаще всего встречается у детей второго и третьего года жизни. Доказано, что при первичном и в большей степени при рецидивирующем остром обструктивном ларинготрахеобронхите воспалительная реакция в респираторном тракте развивается по типу гиперчувствительности немедленного типа (ГНТ) или гиперчувствительности замедленного типа (ГЗТ). Лежащий в их основе более выраженный отек обусловлен аллергическими реакциями на фоне избыточной продукции лейкотриенов, провоспалительных цитокинов, накопления иммунных комплексов «IgE – антиген», индуцирующих выброс биологически активных веществ (БАВ) – гистамина, серотонина и др. – и запускающих аллергическое воспаление в верхних и нижних дыхательных путях по экссудативно-деструктивному варианту [9].
В реальной практике чаще всего врачи ставят диагноз «ОРВИ» клинически, до получения результатов специфических лабораторных тестов (методами полимеразной цепной реакции (ПЦР) и иммуноферментного анализа (ИФА)), что во многом определяет и тактику лечения – необходимость выбора и назначения препаратов, обладающих широким спектром противовирусного действия, повышающих неспецифическую резистентность организма, а также безопасных при использовании у детей, особенно в случае неблагоприятного аллергоанамнеза [10]. К препаратам, стимулирующим неспецифическую защиту организма, предъявляются определенные требования: они должны быть эффективны, доступны, безопасны и удобны при приеме (прежде всего это касается неинъекционного способа применения). Этим условиям отвечает отечественный индуктор ИФН противовирусный препарат Кагоцел®, который хорошо зарекомендовал себя в многочисленных экспериментальных и клинических исследованиях у взрослых и детей. В 2006 г. в НИИ вирусологии им. Д.И. Ивановского противовирусная активность препарата Кагоцел® была изучена и показана в культуре клеток, зараженных высокопатогенным вирусом гриппа А (Н5N1).
В 2009 г. в НИИ гриппа СЗО РАМН и НИИ вирусологии им. Д.И. Ивановского проводились исследования, в ходе которых изучалась вирус-ингибирующая активность препарата Кагоцел® в отношении вируса гриппа А (H1N1/Калифорния/07/09) в культуре клеток и была установлена высокая эффективность препарата [11–12]. В 2007–2009 гг. в НИИ вирусологии им. Д.И. Ивановского, ГП ГНЦ «Институт иммунологии ФМБА», на кафедре инфекционных болезней у детей педиатрического факультета ГОУ ВПО РГМУ Росздрава проведены рандомизированные слепые плацебоконтролируемые исследования безопасности и эффективности применения препарата Кагоцел® для лечения и профилактики гриппа и других ОРВИ у детей старше 6 лет [13].
Противовирусный препарат Кагоцел® (ООО «НИАРМЕДИК ПЛЮС», Россия, регистрационный номер Р N002027/01 от 19.11.07) представляет собой высокомолекулярное соединение, синтезированное на основе натриевой соли карбоксиметилцеллюлозы и низкомолекулярного природного полифенола, получаемого из растительного сырья (хлопчатника) путем химического синтеза. Кагоцел® выпускается в форме таблеток, содержащих 12 мг активного вещества кагоцел®. Основным механизмом действия препарата Кагоцел® является способность индуцировать образование в организме человека так называемого позднего ИФН, являющегося смесью ИФН-альфа и ИФН-бета, обладающих высокой противовирусной активностью. Кагоцел® вызывает продукцию ИФН практически во всех популяциях клеток, принимающих участие в противовирусном ответе организма: Т- и В-лимфоцитах, макрофагах, гранулоцитах, фибробластах, эндотелиальных клетках.
Острые респираторные вирусные инфекции (ОРВИ) являются наиболее распространенными инфекционными заболеваниями. ОРВИ представляют собой полиэтиологичную группу инфекций. Известно более 300 вирусов, размножение которых в клетках эпителия респираторного тракта вызывает развитие клинических признаков воспаления. Для ОРВИ характерна выраженная сезонность, высокая контагиозность, аэрогенный путь передачи, острое течение. Степень тяжести данных инфекций и возможность развития осложнений зависят от многих факторов, присущих как возбудителю (антигенные свойства, лекарственная устойчивость), так и макроорганизму (особенности иммунного ответа, степень зрелости иммунитета, наличие фоновых заболеваний) [1, 2]. Эпидемический характер распространения ОРВИ, наносимый ими экономический ущерб, повышенный риск заболеваемости у детей обусловливают не только медицинскую, но и социальную значимость ОРВИ. Наиболее уязвимой для данных инфекций возрастной группой являются дети от 6 месяцев до 6 лет [3, 4].
К высокой подверженности заболеваемости ОРВИ предрасполагают анатомические особенности строения респираторного тракта у детей, постепенная утрата антител, приобретенных от матери, незрелость собственных иммунных механизмов. Иммунный ответ детей первых 5–7 лет жизни обусловлен несостоятельностью макрофагально-фагоцитарного звена, снижением продукции иммуноглобулинов (Ig) классов G и A, факторов комплемента, незрелостью Т- и В-лимфоцитов. Известно, что резистентность к инфекциям зависит от генетически детерминированной активности иммунокомпетентных клеток (ИКК) человека к выработке интерферона (ИФН). Развитие инфекционного процесса при острых респираторных инфекциях (ОРИ) реализуется в случае имеющегося дефицита синтеза ИФН и других цитокинов, являющихся гуморальными продуктами ИКК.
Для системы ИФН характерны возрастные особенности: доказано, что способность ИКК к синтезу всех видов ИФН у детей раннего возраста снижена. Так, продукция ИФН-альфа (одного из основных противовоспалительных цитокинов) в ответ на проникновение вируса примерно в 10 раз ниже, чем у взрослых. Иммунная система детей характеризуется высокой пролиферативной активностью лимфоцитов с преобладанием фракции недифференцированных, «наивных» лимфоцитов, сниженной цитотоксической и ИФН-продуцирующей активностью ИКК. Часто болеющие дети (ЧБД) составляют от 15 до 80% детского населения. ЧБД подвергаются повторному заражению дыхательных путей более 6 раз в год, а в эпидемический период подъема заболеваемости ОРИ (октябрь – март) – чаще 1 раза в месяц. Показано, что у 76,7–90,0% обследованных пациентов с наличием фоновой патологии, в том числе и у ЧБД, имеющих неблагоприятный аллергоанамнез и/или хронические очаги инфекций, имеет место снижение активности всех показателей ИФН-статуса [5]. Кроме того, способны подавлять интерфероногенез такие распространенные в педиатрической практике факторы, как искусственное вскармливание, наличие перинатальной патологии, сопутствующих и фоновых заболеваний [6–8].
Частым проявлением ОРВИ у детей первых лет жизни бывает острый обструктивный (стенозирующий) ларинготрахеобронхит, который развивается на фоне гиперчувствительности дыхательных путей. По данным нашей клиники, этот синдром чаще всего встречается у детей второго и третьего года жизни. Доказано, что при первичном и в большей степени при рецидивирующем остром обструктивном ларинготрахеобронхите воспалительная реакция в респираторном тракте развивается по типу гиперчувствительности немедленного типа (ГНТ) или гиперчувствительности замедленного типа (ГЗТ). Лежащий в их основе более выраженный отек обусловлен аллергическими реакциями на фоне избыточной продукции лейкотриенов, провоспалительных цитокинов, накопления иммунных комплексов «IgE – антиген», индуцирующих выброс биологически активных веществ (БАВ) – гистамина, серотонина и др. – и запускающих аллергическое воспаление в верхних и нижних дыхательных путях по экссудативно-деструктивному варианту [9].
В реальной практике чаще всего врачи ставят диагноз «ОРВИ» клинически, до получения результатов специфических лабораторных тестов (методами полимеразной цепной реакции (ПЦР) и иммуноферментного анализа (ИФА)), что во многом определяет и тактику лечения – необходимость выбора и назначения препаратов, обладающих широким спектром противовирусного действия, повышающих неспецифическую резистентность организма, а также безопасных при использовании у детей, особенно в случае неблагоприятного аллергоанамнеза [10]. К препаратам, стимулирующим неспецифическую защиту организма, предъявляются определенные требования: они должны быть эффективны, доступны, безопасны и удобны при приеме (прежде всего это касается неинъекционного способа применения). Этим условиям отвечает отечественный индуктор ИФН противовирусный препарат Кагоцел®, который хорошо зарекомендовал себя в многочисленных экспериментальных и клинических исследованиях у взрослых и детей. В 2006 г. в НИИ вирусологии им. Д.И. Ивановского противовирусная активность препарата Кагоцел® была изучена и показана в культуре клеток, зараженных высокопатогенным вирусом гриппа А (Н5N1).
В 2009 г. в НИИ гриппа СЗО РАМН и НИИ вирусологии им. Д.И. Ивановского проводились исследования, в ходе которых изучалась вирус-ингибирующая активность препарата Кагоцел® в отношении вируса гриппа А (H1N1/Калифорния/07/09) в культуре клеток и была установлена высокая эффективность препарата [11–12]. В 2007–2009 гг. в НИИ вирусологии им. Д.И. Ивановского, ГП ГНЦ «Институт иммунологии ФМБА», на кафедре инфекционных болезней у детей педиатрического факультета ГОУ ВПО РГМУ Росздрава проведены рандомизированные слепые плацебоконтролируемые исследования безопасности и эффективности применения препарата Кагоцел® для лечения и профилактики гриппа и других ОРВИ у детей старше 6 лет [13].
Противовирусный препарат Кагоцел® (ООО «НИАРМЕДИК ПЛЮС», Россия, регистрационный номер Р N002027/01 от 19.11.07) представляет собой высокомолекулярное соединение, синтезированное на основе натриевой соли карбоксиметилцеллюлозы и низкомолекулярного природного полифенола, получаемого из растительного сырья (хлопчатника) путем химического синтеза. Кагоцел® выпускается в форме таблеток, содержащих 12 мг активного вещества кагоцел®. Основным механизмом действия препарата Кагоцел® является способность индуцировать образование в организме человека так называемого позднего ИФН, являющегося смесью ИФН-альфа и ИФН-бета, обладающих высокой противовирусной активностью. Кагоцел® вызывает продукцию ИФН практически во всех популяциях клеток, принимающих участие в противовирусном ответе организма: Т- и В-лимфоцитах, макрофагах, гранулоцитах, фибробластах, эндотелиальных клетках.
При приеме внутрь одной дозы препарата Кагоцел® титр ИФН в сыворотке крови достигает максимальных значений через 48 ч. Интерфероновый ответ организма на введение препарата Кагоцел® характеризуется продолжительной (до 4–5 суток) циркуляцией ИФН в кровотоке. Препарат Кагоцел® при назначении в терапевтических дозах не токсичен, не накапливается в организме. Препарат не обладает мутагенными и тератогенными свойствами, не канцерогенен и не оказывает эмбриотоксического действия. Перечисленные свойства препарата Кагоцел®, полученные результаты клинических исследований у детей в возрасте от 6 лет, накопленный опыт применения у детей и взрослых явились основанием для проведения исследования по изучению лечебной и профилактической эффективности и безопасности препарата Кагоцел® при гриппе и ОРВИ у детей в возрасте от 2 до 6 лет. Цель исследования заключалась в оценке эффективности и безопасности препарата Кагоцел® в рандомизированном слепом плацебоконтролируемом исследовании при лечении и профилактике гриппа и других ОРВИ у детей в возрасте от 2 до 6 лет.
Эффективность и безопасность препарата Кагоцел® при лечении ОРВИ у детей в возрасте 2–6 лет
Материалы и методы
В исследовании по оценке клинической эффективности и безопасности препарата Кагоцел® участвовали 60 детей в возрасте от 2 до 6 лет. Из них на момент поступления в инфекционное отделение Морозовской ДГКБ у 41 ребенка отмечались клинические признаки ОРВИ в форме стенозирующего ларинготрахеита со стенозом гортани 1-й степени, у 13 детей – со стенозом 2-й степени, у 6 детей был ларингит без признаков стеноза (из них у 4 – в виде ларинготрахеобронхита и у 2 – с признаками бронхообструкции). Из исследования исключались больные, участвовавшие в других клинических испытаниях в течение последних 4 недель; больные с повышенной чувствительностью к любому из компонентов препарата Кагоцел®; страдающие хроническими почечными, эндокринными, гематологическими, иммунными, неврологическими, психическими, сердечно-сосудистыми заболеваниями, а также с другими заболеваниями/состояниями, которые, по мнению врача, могли повлиять на результаты исследования; дети, получавшие лечение какими-либо иммуномодуляторами в течение 28 дней, предшествовавших 1-му дню исследования. Пациенты были распределены по случайному признаку на 2 группы: испытуемая (группа 1) и сравнения (группа 2), по 30 детей в каждой. Дети в обеих группах были сопоставимы по возрасту, полу и клиническим проявлениям ОРВИ.
В первую группу вошли 12 девочек и 18 мальчиков. У 19 больных был стеноз гортани 1-й степени (в том числе у 3 – в сочетании с проявлениями бронхообструкции), у 7 пациентов – стеноз гортани 2-й степени, у 4 детей наблюдались только симптомы ларингита без признаков стеноза. Рецидивирующий круп диагностирован у 6 детей. Из сопутствующей патологии у 4 детей отмечен отит, у 1 ребенка – конъюнктивит, у 3 – дисбактериоз, у 1 – бронхиальная астма и у 1 – гастроэнтерит. Антибактериальная терапия проводилась у 11 больных в связи с отитом и бронхитом вирусно-бактериальной этиологии.
Во вторую группу также вошли 12 девочек и 18 мальчиков. Клинические проявления стеноза гортани 1-й степени отмечены у 22 больных (из них у 1 с признаками бронхообструкции), 2-й степени стеноза – у 6 детей. У 6 детей имел место стенозирующий ларинготрахеобронхит, у 2 – ларингит без признаков стеноза, у 4 – рецидивирующий круп. Из сопутствующей патологии у 4 детей выявлен отит, у 1 ребенка – конъюнктивит, у 3 – дисбактериоз, у 2 – реактивный панкреатит, у 1 – кандидоз. Антибактериальная терапия проводилась у 9 больных в связи с отитом и бронхитом вирусно-бактериальной этиологии.
Пациенты первой группы получали Кагоцел® в течение 4 дней по 1 таблетке 2 раза в день в течение первых 2 дней, затем по 1 таблетке 1 раз в день в течение последующих 2 дней. Дети во второй группе получали плацебо по такой же схеме в течение 4 дней. Все пациенты, независимо от группы, получали симптоматическое лечение в полном объеме (ингаляции, микстура от кашля, капли в нос, жаропонижающие препараты по показаниям и десенсибилизирующие средства), за исключением противовирусных препаратов и иммуномодуляторов. Больным с бактериальными осложнениями проводилась терапия антибиотиками широкого спектра действия (цефалоспоринами или макролидами). Учет основных клинических симптомов в соответствии с индивидуальной картой больного проводился до начала лечения, ежедневно в течение 5 дней от начала приема препарата и при необходимости на 7-й и 9-й дни. У всех участников исследования в 1-й день (до лечения) и на 5-й (после лечения) проводились общий анализ крови, общий анализ мочи, биохимический анализ крови. Вирусологические исследования проводились методом ПЦР у всех больных, включенных в исследование, до назначения терапии (в 1-й день исследования).
Клиническая эффективность препарата оценивалась на основании частоты и длительности основных симптомов болезни и динамики лабораторных показателей. При этом учитывались сроки нормализации температуры и исчезновения симптомов токсикоза (интоксикации); сроки обратного развития катаральных симптомов, сухого кашля и начала продукции мокроты, исчезновения симптомов ларингита, стеноза гортани и бронхита; возникновение осложнений в процессе лечения. В качестве параметров безопасности учитывали возможность появления нежелательных явлений, изменения показателей общего анализа крови и мочи, повышение уровня печеночных ферментов.
Результаты и их обсуждение
Всего под наблюдением находились 60 детей в возрасте от 2 до 6 лет. Этиология заболевания была расшифрована методом ПЦР у 59 (98,3%) больных из 60 обследованных. Среди них у 33 (55%) пациентов была выявлена моноинфекция и у 26 (43,3%) детей диагностирована микст-инфекция, в том числе: парагрипп – в 4 (6,6%) случаях, грипп В – в 20 (33,3%), грипп А (H3N2) – в 5 (8,3%), грипп А (H1N1) – в 8 (13,3%), грипп А (H1N1/Калифорния/04/09) пандемический – в 5 (8,3%), аденовирусная инфекция – в 13 (21,6%), респираторно-синцитиальная (РС) инфекция – в 8 (13,3%), бокавирусная инфекция – в 7 (11,6%), метапневмовирусная – в 11 (18,3%) и риновирусная – в 5 (8,3%) случаях (рис. 1 и 2). У 25 пациентов микст-инфекция была диагностирована в сочетании 2 вирусов, у 1 больного одновременно определились нуклеиновые кислоты 3 вирусов, среди них чаще встречались аденовирус, РС-вирус и вирус гриппа А (H1N1) (табл. 1 и 2). Характерной особенностью клинических проявлений при гриппе, в том числе пандемическом, были более выраженные и продолжительные, чем при других ОРВИ, симптомы интоксикации и лихорадки, а также присоединение острого среднего отита. У больных с бокавирусной и метапневмовирусной инфекциями (в моно- и микст-вариантах) в основном тотально поражались верхние и нижние дыхательные пути, что клинически проявлялось симптомами ларинго- и бронхообструкции. У пациентов с аденовирусной инфекцией отмечались характерные для этой инфекции проявления конъюнктивита.
В группе детей, получавших Кагоцел® на фоне симптоматической терапии, у 19 (63,3%) пациентов симптомы интоксикации и лихорадки купировались к 4-му дню терапии, при этом продолжительность лихорадки в этой группе составила в среднем 1,7 ± 0,4 дня, а интоксикации – 1,3 ± 0,4 дня. В контрольной группе детей, получавших плацебо, в 17 (56,7%) случаях симптомы интоксикации сохранялись до 5-го дня терапии, при этом средняя продолжительность симптомов интоксикации составила 2,75 ± 0,2 дня, а лихорадки – 2,8 ± 0,3 дня (табл. 3). Продолжительность проявления катаральных симптомов была статистически достоверно (р ≤ 0,001) короче в основной группе по сравнению с группой больных, получавших плацебо: в среднем 4,2 ± 0,2 дня против 5,9 ± 0,3 дня соответственно (табл. 3). В исследуемых группах также статистически достоверно различались темпы исчезновения сухого кашля и появления продукции мокроты. Так, на фоне приема препарата Кагоцел® исчезновение сухого кашля наступало достоверно (р < 0,001) быстрее, в сравнении с больными, получавшими плацебо: в среднем за 4,4 ± 0,3 дня против 5,4 ± 0,3 дня соответственно (табл. 3). У детей, получавших Кагоцел®, симптомы ларингита исчезали достоверно (р < 0,001) быстрее (в среднем спустя 3,2 ± 0,1 дня), чем у детей, получавших плацебо (в среднем спустя 5,2 ± 0,2 дня) (табл. 3).
Симптомы стеноза гортани у детей, получавших Кагоцел®, купировались ко 2-му дню терапии в 100% случаев, средняя продолжительность проявления симптомов составила 1,8 ± 0,4 дня. При этом на 2-й день терапии симптомы стеноза гортани сохранялись у 20% детей, получавших плацебо, в этой группе средняя продолжительность проявления симптомов составила 2,4 ± 0,2 дня (табл. 3). Количество койко-дней, проведенных детьми в стационаре, на фоне терапии препаратом Кагоцел® достоверно сокращалось в сравнении с таковым при приеме плацебо и составило в среднем 4,7 ± 0,3 дня против 6,3 ± 0,3 дня (р < 0,001) соответственно (табл. 3). В таблице 4 представлены результаты исследования влияния препарата Кагоцел® в сравнении с плацебо у детей, получавших антибиотики в составе комплексной терапии бактериальных осложнений – отита и бронхита. Как видно из данных таблицы 4, на фоне приема препарата Кагоцел® отмечено статистически достоверное в сравнении с группой плацебо уменьшение времени проявления симптомов заболевания (лихорадки, катаральных явлений, ларингита и стеноза гортани) и, соответственно, сокращение сроков применения антибиотикотерапии. Количество койко-дней, проведенных в стационаре детьми, получавшими антибиотикотерапию, достоверно (р < 0,05) сокращалось на фоне лечения препаратом Кагоцел® в сравнении с таковым при получении плацебо и составило в среднем 6,1 ± 0,3 дня против 7,3 ± 0,4 дня соответственно (табл. 4).
У пациентов на фоне терапии препаратом Кагоцел® не было выявлено статистически значимой зависимости между темпами купирования основных клинических симптомов гриппа и ОРВИ и этиологией заболевания (моно- или микст-инфекции). В процессе терапии у всех больных наблюдалась хорошая переносимость препарата Кагоцел®, развития побочных реакций не отмечено, что подтверждалось отсутствием отрицательной динамики в состоянии больных и показателях периферической крови, а также данными биохимического анализа крови и общего анализа мочи. Таким образом, на примере оценки клинической эффективности и безопасности препарата Кагоцел® у детей начиная с двухлетнего возраста нам удалось показать темпы воздействия препарата на инфекционный процесс при различных этиологических вариантах ОРВИ, протекающей, что очень важно отметить, с особым синдромом – ларингообструкцией, – указывающим на исходную иммунопатологию, сопровождающуюся дефицитом интерферонообразования и цитокинов, со сдвигом в Т-клеточном иммунитете в сторону ответа по Th2-типу, а также дефицитом в системе мононуклеарных фагоцитов [13].
Эффективность и безопасность препарата Кагоцел® при профилактике гриппа и ОРВИ у детей в возрасте 3–6 лет
В период, предшествующий росту заболеваемости гриппом и другими ОРВИ, было проведено слепое рандомизированное плацебоконтролируемое исследование эффективности и безопасности применения препарата Кагоцел® для профилактики гриппа и других ОРВИ у детей в возрасте от 3 до 6 лет.
Материалы и методы
В исследование включались дети с часто рецидивирующими бактериальными и вирусными инфекциями верхних дыхательных путей (не менее 6 раз за предыдущий год) и не имеющие симптомов ОРИ на момент включения в исследование. Всего под наблюдением находились 100 детей, которые были рандомизированы на 2 группы – испытуемая группа (50 детей, получавших Кагоцел®) и группа сравнения (50 детей, получавших плацебо). Кагоцел® назначали 7-дневными циклами: первые 2 дня по 1 таблетке 1 раз в день, 5 дней перерыв, затем цикл повторяли. Длительность профилактического курса составила 4 недели. Плацебо назначали по такой же схеме. По окончании профилактического курса приема препарата пациенты в течение последующих 4 месяцев находились под наблюдением врачей-исследователей. Досрочного выбытия пациентов из исследования в обеих группах не было.
В группу детей, получавших Кагоцел®, вошли 30 (60%) детей в возрасте от 3 до 5 лет, а также 20 (40%) детей в возрасте 5–6 лет. В группе детей, получавших плацебо, 33 (66%) ребенка были в возрасте от 3 до 5 лет и 17 (34%) – 5–6 лет. У детей в испытуемой группе наблюдалась следующая сопутствующая патология: у 10 – хронический тонзиллит, у 7 – атопический дерматит, у 9 – аденоидит, у 5 – инфекция мочевыводящих путей, у 1 – рецидивирующий обструктивный бронхит, у 1 – ангиоматоз гортани, у 1 – вирусная инфекция Эпштейна – Барр, у 1 – реактивный панкреатит, у 3 – дисбактериоз кишечника, у 1 – гастродуоденит, у 8 – пищевая аллергия, у 3 – дискинезия желчевыводящих путей, у 2 – бронхиальная астма. В группе сравнения из сопутствующей патологии у 11 детей был выявлен хронический тонзиллит, у 5 – атопический дерматит, у 9 – аденоидит, у 3 – инфекция мочевыводящих путей, у 7 – рецидивирующий бронхит, у 8 – рецидивирующий круп, у 5 – дискинезия желчевыводящих путей, у 2 – хронический гастрит, у 1 – реактивный панкреатит, у 1 – гастродуоденит, у 2 – дисбактериоз, у 5 – пищевая аллергия, у 2 – гипертензионно-гидроцефальный синдром.
Результаты и их обсуждение
В группе детей, получавших Кагоцел®, за время профилактического 4-недельного приема препарата ОРВИ болели 9 детей (18%), все дети болели однократно. У 6 (66,7%) детей отмечена легкая форма ОРВИ, а у 3 (33,3%) – среднетяжелая. У 3 детей ОРВИ протекала с осложнениями (у 1 ребенка был диагностирован вирусно-бактериальный конъюнктивит, у 1 – бронхит и у 1 – острый средний отит), по поводу которых больные получали антибактериальную терапию (табл. 5). В контрольной группе детей, получавших плацебо, в течение 4-недельного периода ОРВИ зарегистрирована у 21 (42%) ребенка: из них по 1 эпизоду ОРВИ отмечено у 17 (34%) детей и по 2 и более эпизодов болезни – у 4 (8%) детей. Всего зарегистрировано 25 случаев болезни, из них 10 – осложненных бактериальной инфекцией. Легкая форма ОРВИ диагностирована в 15 (60%) случаях болезни, среднетяжелая – в 10 (40%). У 10 детей с ОРВИ, осложненных бактериальной инфекцией (бронхит + аденоидит – у 3 пациентов, тонзиллофарингит – у 3 пациентов, отит + аденоидит – у 4 пациентов), проводилась терапия антибиотиками широкого спектра действия.
Все пациенты, независимо от группы наблюдения, при заболевании ОРВИ получали симптоматическое лечение в полном объеме (микстура от кашля, капли в нос, жаропонижающие и десенсибилизирующие средства), за исключением иммуномодуляторов. Результаты исследований свидетельствуют о том, что при проведении 4-недельного профилактического курса приема препарата Кагоцел® количество болеющих ОРВИ в группе Кагоцела регистрировалось в 2,3 раза меньше, а по частоте эпизодов – в 2,8 раза реже в сравнении с соответствующими показателями в группе контроля. Индекс эффективности приема препарата Кагоцел® составил 2,8, а коэффициент эффективности – 64% (табл. 5). В течение последующих 4 месяцев наблюдения за детьми установлено, что в группе детей, получавших Кагоцел®, ОРВИ болели 38 (76%) детей, из них 25 (50%) болели однократно, а 13 (26%) детей болели повторно. Всего зарегистрировано 55 случаев болезни: из них у 46 (83,6%) детей диагностирована легкая форма болезни, у 9 (16,3%) – среднетяжелая, у 9 детей протекала с осложнениями (аденоидит был у 1 ребенка, бронхит – у 4, острый средний отит – у 2, ларинготрахеит – у 1 и тонзиллофарингит – у 1 ребенка), по поводу которых пациенты получали антибактериальную терапию (табл. 6).
В контрольной группе детей, получавших плацебо, в течение наблюдательного периода в 4 месяца ОРВИ регистрировалась у 49 (98%) детей, из них у 6 (12%) детей – по 1 эпизоду и у 43 (86%) детей – в виде 2 и более эпизодов болезни. Всего зарегистрировано 132 случая болезни, в том числе 18, осложненных бактериальной инфекцией. Легкая форма заболевания отмечена в 114 (86,3%) случаях, среднетяжелая – в 18 (13,6%). У 18 детей с ОРВИ, осложненных бактериальной инфекцией (бронхит + аденоидит – у 8 пациентов, тонзиллофарингит – у 2 пациентов, отит + аденоидит – у 7 пациентов, ларинготрахеит – у 1), проводилась терапия антибиотиками широкого спектра действия (табл. 6). Результаты исследования свидетельствуют о том, что при наблюдении за детьми в течение 4 месяцев после окончания профилактического курса приема препарата Кагоцел® количество болеющих ОРВИ регистрировалось в 1,3 раза меньше, а по частоте эпизодов – в 2,4 раза реже в сравнении с группой контроля, получавшей плацебо. Индекс эффективности приема препарата Кагоцел® составил 2,4, а коэффициент эффективности – 58% (табл. 6).
Количество детей, заболевших ОРВИ в легкой форме, в основной группе было в 2,5 раза меньше, чем в контрольной группе, а количество случаев среднетяжелых форм болезни в контрольной группе было в 2 раза больше, чем в группе детей, получавших Кагоцел®. При применении препарата Кагоцел® не было зарегистрировано ни одного случая проявления побочных эффектов и развития нежелательных явлений. Препарат хорошо переносился детьми. Таким образом, в результате проведенного исследования установлено, что применение препарата Кагоцел® для профилактики гриппа и других ОРВИ у детей в возрасте от 3 до 6 лет с часто рецидивирующими бактериальными и вирусными инфекциями верхних дыхательных путей (не менее 6 раз за предыдущий год) эффективно. Полученные в ходе исследования данные служат доказательством благоприятного профилактического влияния препарата Кагоцел® на частоту и тяжесть течения ОРВИ, что позволяет уменьшить число назначений антибиотиков при бактериальных осложнениях ОРВИ у детей. Это прогностически важно для сокращения частоты рецидивов основного заболевания и является обоснованием для применения данного индуктора ИФН с профилактической целью в период, предшествующий росту заболеваемости ОРИ.
Выводы
На фоне терапии препаратом Кагоцел® у детей в возрасте начиная с 2 лет при ОРВИ и гриппе, независимо от этиологии и клинических проявлений заболевания, достоверно сокращается продолжительность симптомов интоксикации, лихорадки, катаральных явлений в носо- и ротоглотке и основных симптомов стенозирующего ларинготрахеита (бронхита). Ни в одном случае применения данного индуктора ИФН не было зарегистрировано побочных эффектов, препарат хорошо переносится детьми начиная с 2-летнего возраста. Кагоцел® сокращает сроки антибиотикотерапии и пребывания в стационаре и может быть рекомендован для применения в педиатрической практике для лечения гриппа и ОРВИ у детей в возрасте 3 года и старше. Препарат Кагоцел® рекомендуется для профилактики гриппа и других ОРВИ независимо от их этиологии у детей в возрасте начиная с 3 лет. Прием препарата Кагоцел® с профилактической целью способствует значительному снижению заболеваемости ОРВИ у часто болеющих детей. Полученные данные позволяют рекомендовать Кагоцел® в качестве препарата первого выбора для лечения и профилактики ОРВИ и гриппа, а также для включения в программы иммунореабилитации у часто болеющих детей в возрасте 3 года и старше.
NB
Противовирусный препарат Кагоцел®
- Выпускается в форме таблеток, содержащих 12 мг активного вещества кагоцел®.
- При приеме внутрь одной дозы препарата титр ИФН в сыворотке крови достигает максимальных значений через 48 ч.
- Интерфероновый ответ организма на введение препарата характеризуется продолжительной (до 4–5 суток) циркуляцией ИФН в кровотоке.
- При назначении в терапевтических дозах не токсичен, не накапливается в организме.
- Не обладает мутагенными и тератогенными свойствами, не канцерогенен и не оказывает эмбриотоксического действия.
1. Позднякова М.Г., Шелехова С.Е., Ерофеева М.К. Эпидемиология ОРВИ и возможность их профилактики // РМЖ. 2011. № 23. С. 1434–1435.
2. Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Острые респираторные вирусные инфекции. СПб.: Фолиант, 2007. 253 с.
3. Самсыгина Г.А. Инфекции респираторного тракта у детей раннего возраста. M.: Миклош, 2008. 280 с.
4. Коровина Н.А., Заплатников А.Л. Острые респираторные вирусные инфекции в амбулаторной практике врача-педиатра: Пособие для врачей. М.: Медпрактика, 2004. 237 с.
5. Образцова Е.В., Осидак Л.В., Головачева Е.Г. Препараты интерферона и его индукторы при гриппе и ОРИ у детей // Детские инфекции. 2010. Т. 9. № 1. С. 35–40.
6. Щеплягина Л.А., Круглова И.В. Механизмы иммунной защиты // РМЖ. 2009. № 23. С. 1564–1569.
7. Абатуров А.Е., Юлиш И.Е. Роль интерферонов в защите респираторного тракта // Здоровье ребенка. 2007. № 5 (8). С. 136–144.
8. Современные подходы к лечению и реабилитации часто болеющих детей / Под ред. Л.С. Балевой, Н.А. Коровиной. М.: Агентство медицинского маркетинга, 2006. 53 с.
9. Кладова О.В. Иммунопатогенез, клиника и лечение рецидивирующего крупа у детей: Автореферат дисс. … докт. мед. наук. М., 2003. 55 с.
10. Ершов Ф.И., Касьянова Н.В., Полонский О.В. Возможна ли рациональная фармакотерапия гриппа и других ОРВИ? // Consilium medicum. 2003. Т. 5. № 6. С. 129–135.
11. Киселев О.И. Изучение вирусингибирующей активности Кагоцела в отношении вируса гриппа А (H1N1)sw. Отчет НИР НИИ гриппа СЗО РАМН. СПб., 2009.
12. Временные методические рекомендации Минздравсоцразвития РФ «Схемы лечения и профилактики гриппа, вызванного высокопатогенным вирусом типа A/H1N1, для взрослых» № 24-0/10/1-4053 от 30.06.2009.
13. Харламова Ф.С., Учайкин В.Ф., Бевза С.Л. и др. Клиническая эффективность Кагоцела при ОРВИ со стенозирующим ларинготрахеитом у детей // Детские инфекции. 2008. № 4. C. 28–35.
Новости на тему
22.02.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
На основании проведенных авторами клинических исследований показана эффективность и безопасность применения препарата Кагоцел® у детей в возрасте 2–6 лет в лечении ОРВИ и гриппа независимо от этиологии и клинических проявлений заболевания, что выражалось в уменьшении продолжительности симптомов интоксикации, лихорадки, катаральных явлений в носо- и ротоглотке, основных симптомов стенозирующего ларинготрахеита; сокращении сроков антибиотикотерапии и пребывания в стационаре у детей с бактериальными осложнениями; отсутствии побочных эффектов и нежелательных явлений на фоне приема препарата.
Продемонстрирована эффективность применения препарата Кагоцел® для профилактики гриппа и других ОРВИ у детей в возрасте 3–6 лет с часто рецидивирующими бактериальными и вирусными инфекциями верхних дыхательных путей.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Продемонстрирована эффективность применения препарата Кагоцел® для профилактики гриппа и других ОРВИ у детей в возрасте 3–6 лет с часто рецидивирующими бактериальными и вирусными инфекциями верхних дыхательных путей.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
