Пандемия COVID-19: второе дыхание гликлазида МВ в эпоху новой реальности
- Аннотация
- Статья
- Ссылки
- English
В многочисленных исследованиях было показано, что сахарный диабет (СД) 2 типа является одним из основных факторов риска тяжелого течения COVID-19, часто приводящего к госпитализации или летальному исходу. Патофизиологические механизмы COVID-19 необходимо учитывать при выборе сахароснижающей терапии. Известно, что производные сульфонилмочевины (ПСМ) не увеличивают экспрессию ангиотензинпревращающего фермента 2 на поверхности клеток, вследствие чего риск вирусной нагрузки не повышается. Из всех ПСМ гликлазид МВ обеспечивает хорошую динамику снижения не только уровня гликированного гемоглобина на любой стадии заболевания, но и микроальбуминурии. Как следствие, данный препарат способен оказывать нефропротективное воздействие. Кроме того, на фоне приема гликлазида МВ гипогликемии развиваются значимо реже, чем при применении других представителей данного класса. У пациентов с СД 2 типа гликлазид МВ также снижает экспрессию маркеров воспаления и влияет на эндотелиальную дисфункцию. Противовирусная активность препарата реализуется за счет влияния на ионные каналы вирусов. Доказано, что гликлазид МВ у пациентов с СД 2 типа способен уменьшать патогенность SARS-CoV-2, блокируя в его структуре ионный канал, образованный вирулентным белком Е.
Антиоксидантное, противовоспалительное и противовирусное свойства являются дополнительными преимуществами гликлазида МВ. Плейотропные эффекты способствуют как улучшению долгосрочного прогноза у пациентов с СД 2 типа, так и более легкому течению COVID-19, что особенно важно при наличии коморбидной патологии.
В многочисленных исследованиях было показано, что сахарный диабет (СД) 2 типа является одним из основных факторов риска тяжелого течения COVID-19, часто приводящего к госпитализации или летальному исходу. Патофизиологические механизмы COVID-19 необходимо учитывать при выборе сахароснижающей терапии. Известно, что производные сульфонилмочевины (ПСМ) не увеличивают экспрессию ангиотензинпревращающего фермента 2 на поверхности клеток, вследствие чего риск вирусной нагрузки не повышается. Из всех ПСМ гликлазид МВ обеспечивает хорошую динамику снижения не только уровня гликированного гемоглобина на любой стадии заболевания, но и микроальбуминурии. Как следствие, данный препарат способен оказывать нефропротективное воздействие. Кроме того, на фоне приема гликлазида МВ гипогликемии развиваются значимо реже, чем при применении других представителей данного класса. У пациентов с СД 2 типа гликлазид МВ также снижает экспрессию маркеров воспаления и влияет на эндотелиальную дисфункцию. Противовирусная активность препарата реализуется за счет влияния на ионные каналы вирусов. Доказано, что гликлазид МВ у пациентов с СД 2 типа способен уменьшать патогенность SARS-CoV-2, блокируя в его структуре ионный канал, образованный вирулентным белком Е.
Антиоксидантное, противовоспалительное и противовирусное свойства являются дополнительными преимуществами гликлазида МВ. Плейотропные эффекты способствуют как улучшению долгосрочного прогноза у пациентов с СД 2 типа, так и более легкому течению COVID-19, что особенно важно при наличии коморбидной патологии.

Введение
За последние два столетия вирусные пандемии стали угрозой здоровью населения всего мира. Вирусы способны поражать разные ткани и органы человеческого организма. Так, риновирусы, коронавирусы, грипп прежде всего поражают верхние дыхательные пути и легкие, вирусы гепатита В и С – печень, вирус полиомиелита – серое вещество спинного мозга, вирус Эбола – эндотелиальные клетки сосудов, вирус иммунодефицита человека – лейкоциты крови.
Кроме того, вирусные заболевания нередко становятся причиной колоссального количества смертей. В частности, в 2012 г. в Саудовской Аравии было выявлено заболевание, вызываемое коронавирусом Ближневосточного респираторного синдрома (MERS-CoV). Согласно данным 2023 г., лабораторно было подтверждено 2600 случаев заражения, из них 937 случаев с летальным исходом [1]. В марте 2020 г. Всемирная организация здравоохранения объявила вспышку пандемии COVID-19. Инфекция, вызванная SARS-CoV-2, ассоциировалась с развитием острого тяжелого респираторного синдрома [2, 3]. По состоянию на декабрь 2023 г. SARS-CoV-2 было инфицировано более 700 млн человек, умерло около 7 млн. При этом число новых случаев заражения продолжает стремительно расти.
Появления новых вирусных пандемий невозможно избежать, поэтому вопросы противовирусной терапии сохраняют свою актуальность.
Причинно-следственные связи между сахарным диабетом 2 типа и тяжелым течением COVID-19
В многочисленных исследованиях установлено, что сахарный диабет (СД) 2 типа является одним из основных факторов риска тяжелого течения COVID-19, часто сопряженного с госпитализацией или летальным исходом. Повышенная вирусная нагрузка у пациентов с СД 2 типа обусловлена наличием коморбидных заболеваний, ожирения, а также гипергликемии, которая способна подавлять функцию нейтрофилов, нарушать фагоцитоз путем активации протеинкиназы С [4]. О снижении противовирусного ответа у больных СД свидетельствует уменьшение продукции интерферона α [5]. При повышении уровня глюкозы в крови происходит гликозилирование иммуноглобулинов, нарушение гуморального иммунитета и активации системы комплемента, снижение цитокинового ответа. На фоне повышенного гликозилирования подавляется выработка лимфоцитами и макрофагами интерлейкина (ИЛ) 10, который обладает мощным противовоспалительным и иммуномодулирующим воздействием [6]. В результате указанных иммунных нарушений риск заражения любой инфекцией увеличивается.
На поверхности SARS-CoV-2 представлены гликопротеины, с помощью которых вирус активно связывается с рецептором ангиотензинпревращающего фермента 2 (АПФ2) и проникает в клетку. АПФ2 является белком цитоплазматической мембраны, локализующимся в легких, а также во многих других органах, включая сердце, почки и, что особенно важно, в β-клетках поджелудочной железы [7, 8]. Поражение β-клеток вирусом, опосредованное АПФ2, может привести к их повреждению и апоптозу, что усилит нарушения углеводного обмена.
У пациентов с СД 2 типа важную роль в патогенном ответе на COVID-19 играют адипоциты и адипоцитоподобные клетки, ассоциированные с повышенной экспрессией АПФ2. Таким образом жировая ткань превращается в резервуар для коронавируса.
Еще одним фактором тяжелого течения инфекции, вызванной SARS-CoV-2, является окислительный стресс вследствие хронической гипергликемии. Он способствует интерстициальному повреждению легких, в основном за счет микроангиопатий альвеолярных капилляров и неферментативного гликирования белков.
Распространенность СД 2 типа и смертность среди больных COVID-19 в разных странах значительно различаются (табл. 1) [7].
В нескольких крупных исследованиях продемонстрирована существенно более высокая степень тяжести состояния и частоты летального исхода при сочетании COVID-19 и СД 2 типа [9]. Так, в Англии смертность от коронавирусной инфекции среди пациентов с СД 2 типа достигла 37%. В Китае нарушения углеводного обмена имели место у 5% больных, 7% из них умерли. Центры по контролю и профилактике заболеваний в США сообщили о наличии СД 2 типа у 5% из более чем 1,5 млн больных, а также о 12-кратном повышении риска неблагоприятного исхода в отличие от пациентов без сопутствующего заболевания (см. табл. 1) [10–15].
Таким образом, при выборе сахароснижающей терапии необходимо учитывать патофизиологические механизмы COVID-19.
Производные сульфонилмочевины (ПСМ) не увеличивают экспрессию АПФ2 на поверхности клеток, поэтому риск возрастания вирусной нагрузки при продолжении приема препаратов этого класса не повышается.
Эффективность и безопасность применения производных сульфонилмочевины при COVID-19
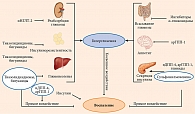
В связи с появлением новых классов сахароснижающих препаратов (ССП), оказывающих кардиопротективный и нефропротективный эффекты, перспективы применения препаратов старых классов в научной литературе стали обсуждаться все реже. Однако среди используемых в настоящее время ССП некоторые обладают противовоспалительной активностью [16], что позволяет улучшать клинические результаты лечения (рис. 1) [17]. Активность воспалительного процесса может снижаться косвенно – путем компенсации гипергликемии при воздействии препаратов на органы-мишени. В то же время ряд препаратов способны оказывать прямой противовоспалительный эффект.
Пандемия COVID-19 послужила поводом для изучения плейотропных эффектов ПСМ. Следует напомнить, что ПСМ были разработаны как антибактериальные средства при пневмонии. В ходе проведения экспериментальных исследований были обнаружены побочные эффекты лечения в виде гипогликемии [18]. По прошествии нескольких лет были представлены первые данные о сахароснижающем действии ПСМ, после чего эти препараты приобрели широкое клиническое применение в диабетологии. На сегодняшний день ПСМ занимают второе место среди часто назначаемых сахароснижающих препаратов [19].
Установлено, что СД 2 типа повышает длительность госпитализации по поводу COVID-19, а также риск развития осложнений коронавирусной инфекции и смерти от нее. Однако убедительные рекомендации по ведению пациентов с СД 2 типа и COVID-19 отсутствуют.
При выборе пероральных ССП (ПССП) необходимо учитывать тяжесть состояния, эффективность контроля гликемии и наличие побочных реакций терапии. При легком и среднетяжелом течении COVID-19 в условиях стационара к применению разрешены метформин, ингибиторы дипептидилпептидазы 4 (иДПП-4), агонисты рецепторов глюкагоноподобного пептида 1 (арГПП-1), ингибиторы натрий-глюкозного котранспортера 2 (иНГЛТ-2) и ПСМ [20]. Лечение ПСМ ассоциировано с более низким уровнем лейкоцитов, С-реактивного белка (СРБ), ИЛ-6 и креатинфосфокиназы (КФК). Эти данные получены в ретроспективном исследовании при анализе клинических характеристик пациентов с СД 2 типа и COVID-19, применявших разные классы ПССП [21]. В обзоре по оценке риска летального исхода у пациентов с СД 2 типа и COVID-19, получавших разные ПССП, сообщалось о пяти исследованиях, в которых были продемонстрированы более низкие показатели смертности при приеме ПСМ [22]. В работе K. Khunti и соавт. [23] о связи между назначением некоторых сахароснижающих препаратов и смертностью от COVID-19 статистически доказан более низкий риск неблагоприятного исхода у пациентов, принимавших ПСМ. В систематическом обзоре и метаанализе 31 исследования с участием 66 914 пациентов статистически значимо меньший риск смерти от COVID-19 отмечен у лиц с СД 2 типа, получавших ПСМ [24]. Из группы ПСМ особого внимания заслуживает гликлазид МВ, доказавший преимущества в отношении эффективности и безопасности [25, 26]. Так, гликлазид МВ обеспечивал оптимальную динамику снижения не только уровня гликированного гемоглобина (HbA1c) на любой стадии заболевания, но и микроальбуминурии, что способствовало нефропротекции [27]. Кроме того, частота развития гипогликемий при применении гликлазида МВ оказалась значимо ниже, чем при приеме других ПСМ [28, 29].
Гликлазид МВ
Противовоспалительная активность
Согласно данным за 2021 г., в России 24,8% пациентов с СД 2 типа получали монотерапию ПСМ [30]. В связи с этим вопросы о плейотропных эффектах гликлазида МВ при COVID-19 и других вирусных инфекциях не теряют актуальности.
Как было отмечено ранее, гликлазид МВ снижает экспрессию маркеров воспаления и таким образом влияет на эндотелиальную дисфункцию. Антиоксидантное свойство гликлазида может быть связано с наличием в его структуре аминоазабициклооктильного кольца, которое способно нейтрализовывать свободные радикалы [31]. R.C. O'Brien и соавт. [32] в 2000 г. опубликовали результаты исследования гликлазида и его особых свойств. В исследовании приняли участие 44 пациента с СД 2 типа, получавших гликлазид в течение десяти месяцев. На фоне приема препарата отмечено снижение маркера неферментативного окисления фосфолипидов клеточных мембран, увеличение антиоксидантной активности и существенная задержка окисления липопротеинов низкой плотности, что приводит к снижению их атерогенных свойств [32, 33].
Благодаря антиоксидантному эффекту гликлазид также может обеспечивать дополнительную протекцию β-клеток, чувствительных к проявлениям оксидативного стресса.
При СД 2 типа нередко отмечается ожирение, которое усугубляет течение COVID-19 [34]. У пациентов с ожирением повышены концентрации провоспалительных цитокинов, а именно фактора некроза опухоли (ФНО), ИЛ-6, и снижена концентрация адипонектина, играющего роль противовоспалительного адипокина, что в свою очередь способствует нарушению иммунного ответа [35, 36].
Противовоспалительное действие гликлазида МВ доказано в исследовании Е.В. Пекаревой [37], в которое было отобрано 24 пациента с плохо контролируемым СД 2 типа. У всех больных исходно определили уровень HbA1c, ИЛ-6 и ФНО. После двухнедельного вводного периода был назначен гликлазид МВ. По истечении 12 недель отмечалось снижение уровня глюкозы в крови натощак, а также повышение уровня адипонектина в плазме и незначительное снижение уровня ИЛ-6 и ФНО. Аналогичные данные, а именно положительное влияние такой терапии на маркеры воспаления, были получены ранее J. Drzewoski и соавт. [38].
Противовирусная активность
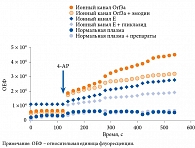
В настоящее время с целью разработки этиотропного лечения активно исследуется структура вирусов. Установлено, что ионные каналы вирусов могут служить мишенями для препаратов. У коронавирусов такой мишенью является белок Е. Из всех структурных белков коронавируса белок Е наименее изучен в отношении механизма действия и структуры. Белки Е нескольких коронавирусов, включая SARS-CoV-1, коронавирус MERS, коронавирус человека 229E, вирус инфекционного бронхита, обладают активностью ионных каналов. Ионная активность имеет решающее значение для вирулентности коронавирусов. P.P. Singh Tomar и соавт. [39] провели три генетических теста и доказали, что данный белок SARS-CoV-2 является потенциальным виропорином. В продолжении научной работы исследователи отобрали 372 соединения из MedChemExpress (Нью-Джерси, США) в разделе «Мембранный транспортер/ионный канал». Белок Е SARS-CoV-2 ингибировали несколькими препаратами, в том числе гликлазидом. Авторы исследования сделали вывод, что использование гликлазида при СД 2 типа способно уменьшить патогенность SARS-CoV-2 благодаря блокированию в его структуре вирулентного белка Е. Позже аналогичные данные были получены H.G. Yu и соавт. [40]. Ученые предположили, что два ионных канала – Orf3a и E, непосредственно влияющих на вирулентность, могут стать мишенями для обнаружения и ингибирования репликации SARS-CoV-2 независимо от штамма. У пациентов с COVID-19 может оказаться перспективным применение лекарственных средств, воздействующих на ионные каналы. Было установлено, что клинически значимые мутации вируса не влияли на активность каналов Orf3a/E. В ходе исследования в штаммах Alpha, Beta и Delta SARS-CoV-2 активность каналов Orf3a и E была обнаружена и ингибирована препаратами эмодин и гликлазид соответственно (рис. 2) [40]. Для запуска реакции флуоресценции ученые использовали краситель 4-аминопиридин (4-AP). В качестве контроля они применяли нормальную плазму, не инфицированную вирусом, демонстрирующую отсутствие ответа на препараты.
Влияние гликлазида МВ на клинический статус и гликемический профиль у пациентов с COVID-19 было оценено Т.А. Некрасовой и соавт. [41]. В исследование включали больных СД 2 типа, госпитализированных по поводу COVID-19. Пациенты основной группы (n = 20) получали гликлазид МВ, пациенты контрольной группы (n = 20) – инсулин. В основной группе препарат обеспечивал стабильные цифры гликемии в пределах целевых, наблюдалась значимая положительная клинико-лабораторная динамика в виде уменьшения объема поражения легких по результатам компьютерной томографии органов грудной клетки (КТ ОГК), уровней СРБ и D-димера, а также коагуляционных параметров крови, что указывало на активное купирование характерных для COVID-19 местных и системных нарушений гемостаза.
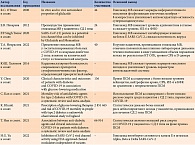
Исследования, в которых были продемонстрированы плейотропные эффекты гликлазида МВ, а именно противовоспалительный и противовирусный, представлены в табл. 2 [21–24, 32, 33, 37, 39–41].
Заключение
В многочисленных исследованиях гликлазид МВ продемонстрировал не только хорошую эффективность, но и хороший профиль безопасности. Кроме того, на сегодняшний день установлено, что данный препарат обладает рядом особенных свойств, в частности антиоксидантным, противовоспалительным и противовирусным. Плейотропные эффекты способствуют улучшению долгосрочного прогноза у пациентов с СД 2 типа, а также более легкому течению COVID-19, что особенно важно при наличии коморбидных состояний.
Конфликт интересов
Статья подготовлена при информационной поддержке компании «Сервье» (Франция).
Источники финансирования
Работа выполнена по инициативе авторов без привлечения финансирования.
L.A. Suplotova, MD, PhD, Prof., A.I. Lyapunova
Tyumen State Medical University
Contact person: Lyudmila A. Suplotova, suplotovala@mail.ru
The World Health Organization declared the COVID-19 outbreak a pandemic causing severe acute respiratory syndrome SARS-CoV-2 in march 2020. The emergence of new viral pandemics in the future cannot be avoided, so the issues of antiviral therapy remain relevant to this day.
Numerous studies show that type 2 diabetes mellitus is one of the main risk factors for a severe course of COVID-19, often accompanied by hospitalisation or death. The choice of sugar-lowering therapy should take into account the pathophysiological mechanisms of COVID-19. Sulfonylurea (SU) derivatives do not increase angiotensin converting enzyme 2 expression on the cell surface by their mechanism of action. As a consequence, there is no risk of viral load increase with continued use of drugs of this group. Among sulfonylurea drugs gliclazide MR provides favourable dynamics of glycated hemoglobin reduction at any stage of the disease, reduces the level of microalbuminuria, has nephroprotective properties, the frequency of hypoglycemia development when using gliclazide MR is significantly lower in comparison with other SUs. Gliclazide MR reduces the expression of inflammatory markers and affects endothelial dysfunction in patients with type 2 diabetes mellitus, showing anti-inflammatory activity. Antiviral activity is realised through the effect on virus ion channels. It has been proved in studies that using gliclazide MR in type 2 diabetes, it is possible to reduce pathogenicity of SARS-CoV-2 virus by blocking the ion channel formed by virulent protein E in its structure. Antioxidant properties, the presence of anti-inflammatory and antiviral activity are the advantages of using the drug gliclazide MR. Pleiotropic effects contribute to both improved long-term prognosis in patients with type 2 diabetes mellitus and easier course of COVID-19, which is especially important for patients with comorbid pathology.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.