Возможности профилактики формирования пневмофиброза у пациентов с остаточными изменениями в легких после перенесенного COVID-19
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Участниками исследования стали 57 пациентов (30 мужчин и 27 женщин, средний возраст – 57,82 ± 1,7 года), находившихся на амбулаторном лечении в Александро-Мариинской областной клинической больнице (г. Астрахань), спустя три месяца после выписки из стационара. Основную группу составили пациенты, перенесшие идентифицированную новую коронавирусную инфекцию, осложненную двусторонней полисегментарной пневмонией, среднетяжелого и тяжелого течения, с сохранявшимися жалобами на одышку, общую слабость, кашель, эпизоды затрудненного дыхания и изменениями на компьютерной томограмме (КТ) легких с объемом поражения 40–70%. Эти пациенты получали бовгиалуронидазы азоксимер (Лонгидаза) в режиме 15 инъекций (одна инъекция в пять дней) и 15 ректальных суппозиториев (один суппозиторий в три дня). В группе сравнения этот препарат не назначали.
Результаты. В основной группе отмечалась более четкая положительная клиническая динамика и динамика по данным КТ легких, чем в группе сравнения. В основной группе в большей степени, чем в группе сравнения, уменьшились одышка, кашель и слабость, повысилась толерантность к физической нагрузке, улучшились спирографические показатели. По данным КТ легких, исчезли признаки «матового стекла», значительно уменьшились ретикулярные изменения.
Заключение. Исследование показало эффективность применения данного препарата у пациентов с остаточными изменениями в легких после перенесенного COVID-19, что делает возможным его применение у пациентов в постковидном периоде, особенно у лиц, имеющих ограничения для назначения пероральных глюкокортикостероидов.
Материал и методы. Участниками исследования стали 57 пациентов (30 мужчин и 27 женщин, средний возраст – 57,82 ± 1,7 года), находившихся на амбулаторном лечении в Александро-Мариинской областной клинической больнице (г. Астрахань), спустя три месяца после выписки из стационара. Основную группу составили пациенты, перенесшие идентифицированную новую коронавирусную инфекцию, осложненную двусторонней полисегментарной пневмонией, среднетяжелого и тяжелого течения, с сохранявшимися жалобами на одышку, общую слабость, кашель, эпизоды затрудненного дыхания и изменениями на компьютерной томограмме (КТ) легких с объемом поражения 40–70%. Эти пациенты получали бовгиалуронидазы азоксимер (Лонгидаза) в режиме 15 инъекций (одна инъекция в пять дней) и 15 ректальных суппозиториев (один суппозиторий в три дня). В группе сравнения этот препарат не назначали.
Результаты. В основной группе отмечалась более четкая положительная клиническая динамика и динамика по данным КТ легких, чем в группе сравнения. В основной группе в большей степени, чем в группе сравнения, уменьшились одышка, кашель и слабость, повысилась толерантность к физической нагрузке, улучшились спирографические показатели. По данным КТ легких, исчезли признаки «матового стекла», значительно уменьшились ретикулярные изменения.
Заключение. Исследование показало эффективность применения данного препарата у пациентов с остаточными изменениями в легких после перенесенного COVID-19, что делает возможным его применение у пациентов в постковидном периоде, особенно у лиц, имеющих ограничения для назначения пероральных глюкокортикостероидов.

Пандемия нового коронавируса SARS-CoV-2, провоцирующего COVID-19, начавшаяся в Китае и распространившаяся по всему миру с начала 2020 г., подтолкнула не только к активному изучению новых подходов к лечению самой инфекции, но и к поиску методов профилактики последствий данного заболевания [1].
Несмотря на то что большинство людей полностью выздоравливают от инфекции SARS-CoV-2, в 10–20% случаев симптомы сохраняются. В случае если симптомы сохраняются свыше 12 недель, а другие причины отсутствуют, говорят о состоянии после COVID-19, или постковидном синдроме (длительный COVID) [1, 2]. Стойкая одышка – один из частых симптомов затяжного COVID [2–4]. При этом нередко наблюдается значительное нарушение функции легких [5, 6].
У части пациентов имеют место малообратимые изменения в легких с формированием дыхательной недостаточности и пневмофиброза, что может приводить к продолжительной временной и стойкой утрате трудоспособности.
По данным литературы, пневмофиброз развивается в среднем у 10% пациентов, перенесших COVID-19. После перенесенного острого респираторного дистресс-синдрома на фоне тяжелой пневмонии, ассоциированной с SARS-CoV-2, пневмофиброз регистрируется в два раза чаще и в 30–36% случаев выявляется через три и шесть месяцев после инфицирования [7, 8].
С учетом актуальности проблемы формирования и прогрессирования пневмофиброза после перенесенного COVID-19 в настоящее время обсуждается вопрос о применении различных лекарственных средств [2, 7] и активно ведется поиск эффективных препаратов, тормозящих фиброзообразование легочной ткани [2, 9–11].
В последнее время ученые особое внимание уделяют вопросу применения фермента гиалуронидазы у пациентов, перенесших COVID-19, который может воздействовать на соединительную ткань, препятствуя образованию коллагеновых волокон. При этом обсуждается назначение гиалуронидазы как в ранние, так и в отдаленные периоды после перенесенной коронавирусной инфекции в тяжелой форме, осложненной двусторонней пневмонией.
Гиалуроновая кислота (ГК) – один из основных компонентов легочного внеклеточного матрикса. Продукты деградации ГК, обнаруженные в высоких концентрациях в секрете бронхиального дерева у пациентов с различными воспалительными процессами в легких, могут играть определенную роль в патогенезе болезней дыхательной системы [12–14].
Кроме того, при тяжелом течении COVID-19, сопровождающемся дыхательной недостаточностью, отмечается повышенное накопление ГК в альвеолах [15]. При этом картина «матового стекла» может быть обусловлена и гигроскопическими свойствами ГК [16].
Препараты на основе гиалуронидазы малоэффективны при парентеральном введении, поскольку быстро инактивируются ингибиторами сыворотки крови. В связи с этим был создан препарат бовгиалуронидазы азоксимер (Лонгидаза), который при сохраненных свойствах гиалуронидазы более устойчив во внутренней среде организма и практически лишен побочных эффектов [17, 18]. Одновременное присутствие гидролитического фермента и носителя обеспечивает связывание освобождающихся ингибиторов фермента и стимуляторов синтеза коллагена (ионы железа, меди, гепарин и др.). Благодаря указанным свойствам Лонгидаза способна не только деполимеризовать матрикс соединительной ткани в фиброзно-гранулематозных образованиях, но и подавлять обратную (регуляторную) реакцию, направленную на синтез компонентов соединительной ткани. В результате деполимеризации (разрыва связи между С1 ацетилглюкозамина и С4 глюкуроновой или индуроновой кислоты) под влиянием Лонгидазы гликозаминогликаны утрачивают свои основные свойства (вязкость, способность связывать воду, ионы металлов), замедляется формирование коллагеновых белков в волокнах, увеличивается проницаемость тканевых барьеров [19–21]. Действующее вещество препарата регулирует синтез медиаторов воспаления (интерлейкина 1 и фактора некроза опухоли), влияя на острую фазу воспаления, повышает резистентность организма к инфекции и гуморальный иммунный ответ.
В данном аспекте представляется актуальной оценка возможности применения препарата бовгиалуронидазы азоксимера (Лонгидаза) для лечения остаточных изменений и улучшения функции легких после перенесенного COVID-19.
Цель исследования – проанализировать эффективность препарата бовгиалуронидазы азоксимера (Лонгидазы) у пациентов с остаточными изменениями в легких после перенесенного COVID-19.
Материал и методы
В исследовании приняли участие 57 пациентов – 30 (53%) мужчин и 27 (47%) женщин (средний возраст – 57,82 ± 1,7 года).
Все больные обратились в консультативную поликлинику Александро-Мариинской областной клинической больницы (Астрахань) спустя почти три месяца после выписки из стационара. Критерии отбора в исследование:
- перенесенная идентифицированная новая коронавирусная инфекция среднетяжелого и тяжелого течения, осложненная двусторонней полисегментарной пневмонией;
- срок обращения – около трех месяцев после выписки из стационара;
- сохранение жалоб на одышку при незначительной физической нагрузке, общую слабость, кашель, а также эпизоды затрудненного дыхания и чувство заложенности в груди;
- по данным компьютерной томографии (КТ), изменения легких, соответствовавшие объему поражения легочной ткани 40–70%.
32 пациента основной группы получали бовгиалуронидазы азоксимер (Лонгидазу) 3000 МЕ внутримышечно один раз в пять дней, курс – 15 инъекций, далее в ректальных суппозиториях один раз в три дня – 15 введений, продолжительность лечения – четыре месяца.
25 пациентам группы сравнения бовгиалуронидазы азоксимер (Лонгидазу) не назначали.
Следует отметить, что только пациенты группы сравнения получали пероральные глюкокортикостероиды в средней дозе 12–16 мг/сут (курс – до 7–10 дней с последующей ступенчатой отменой) в первый месяц после выписки из стационара.
Пациентам обеих групп также назначали дыхательную гимнастику, поливитамины, иммуномодулирующую терапию, ацетилцистеин 600 мг/сут из-за плохой переносимости более высоких доз препарата, продолжена антикоагулянтная терапия, согласно методическим рекомендациям по реабилитации пациентов, перенесших новую коронавирусную инфекцию, осложненную вирусной пневмонией.
Эффективность бовгиалуронидазы азоксимера (Лонгидазы) оценивали после четырехмесячного курса лечения по динамике следующих показателей:
- клиническая симптоматика (общая слабость, одышка по шкале mMRS, кашель);
- толерантность к физической нагрузке (тест с шестиминутной ходьбой);
- результаты КТ органов грудной клетки (ОГК);
- функция внешнего дыхания – показатели спирографии;
- данные пульсоксиметрии.
Проводили статистическую обработку количественных данных. Результат считали статистически значимым при р < 0,05.
Результаты и обсуждение
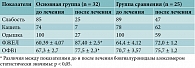
Согласно результатам исследования, в течение четырехмесячного периода наблюдения за пациентами положительная динамика в разрешении симптомов отмечалась в обеих группах. Но на фоне применения бовгиалуронидазы азоксимера (Лонгидаза) улучшение самочувствия у пациентов основной группы было более отчетливым, чем у пациентов группы сравнения. Это проявлялось в более выраженном субъективном уменьшении общей слабости, одышки и кашля (таблица). Слабость купировалась более чем у 2/3 больных основной группы и менее чем у половины пациентов группы сравнения. Кашель исчез у подавляющего большинства пациентов основной группы и сохранялся у больных группы сравнения (78%). Аналогичная тенденция прослеживалась в отношении одышки. Она уменьшилась у 3/4 пациентов основной группы (снижение интенсивности на 2 балла по шкале mMRS) и только у половины больных группы сравнения (на 1–2 балла по шкале mMRS).
Всем пациентам было проведено комплексное исследование функции внешнего дыхания. По его результатам зафиксирована статистически значимая положительная динамика показателей форсированной жизненной емкости легких (ФЖЕЛ) и объема форсированного выдоха за первую секунду у пациентов, получавших бовгиалуронидазы азоксимер. Так, до лечения препаратом средние показатели ФЖЕЛ составляли 60,39 ± 4,07%, после лечения – 87,40 ± 2,5% (р < 0,05). В группе сравнения также наблюдалась тенденция к повышению данных показателей, но в меньшей степени (таблица).
Уровень насыщения крови кислородом (SpO2) перед началом исследования составлял в среднем 94 ± 2,1% в обеих группах. После исследования в первой группе показатель SpO2 увеличился до 98 ± 2,5%, во второй группе – до 96 ± 2,8%. Несмотря на то что различия в показателях не являются статистически значимыми, отмечалось более быстрое восстановление оксигенации крови у пациентов, получавших бовгиалуронидазы азоксимер.
Степень толерантности к физической нагрузке у пациентов определялась на основании стандартизированного теста с шестиминутной ходьбой.
За время наблюдения в обеих группах отмечалось повышение толерантности к физической нагрузке. Тем не менее в основной группе пройденное расстояние за шесть минут статистически значимо увеличивалось по сравнению со второй группой (р < 0,05) – 200 и 90 метров соответственно (рис. 1).
У пациентов основной группы, получавших препарат гиалуронидазы, имела место отчетливая положительная динамика по результатам контрольной КТ легких (через четыре месяца от начала курса лечения). До начала курсового лечения на КТ ОГК изменения в легких представляли собой в основном двусторонние плотные участки консолидации, распространенные ретикулярные изменения и участки «матового стекла». Объем поражения легочной ткани – 40–70%.
На контрольных КТ легких ни у одного из пациентов основной группы не зарегистрировано изменений по типу «матового стекла», а фокусы уплотненной легочной ткани и ретикулярных изменений сохранялись у 7 (21%) больных. Объем поражения легких в среднем уменьшился на 50–60%. В группе сравнения, несмотря на положительную динамику по данным лучевой диагностики, изменения по типу «матового стекла» сохранялись у 35% пациентов, но прослеживалась тенденция к уменьшению их интенсивности и распространенности (на 10–20% от исходного объема поражения). Регресс ретикулярных изменений был не таким явным, как в основной группе.
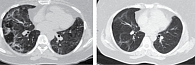
Для наглядности на рис. 2 представлена динамика изменений на КТ ОГК пациентки А. из основной группы (перед началом лечения бовгиалуронидазы азоксимером и через четыре месяца после проведенного лечения). Пациентка поступила в стационар с тяжелой формой коронавирусной инфекции, осложненной двусторонней полисегментарной пневмонией с объемом поражения легочной ткани 70%. После выписки из стационара она проходила длительный реабилитационный период. После лечения препаратом гиалуронидазы значительно улучшилось состояние, уменьшилась одышка и слабость, купировался кашель, увеличилась толерантность к физическим нагрузкам. При этом тест с шестиминутной ходьбой изменился с 200 до 490 м, значительно увеличился показатель ФЖЕЛ – с 65 до 88%, сатурация крови кислородом в покое возросла с 94 до 97%.
Результаты исследования подтвердили хорошую переносимость лекарственного препарата, о чем свидетельствует отсутствие осложнений на фоне лечения бовгиалуронидазы азоксимером (Лонгидаза) у всех пациентов.
Заключение
Проведенное исследование продемонстрировало улучшение функционального состояния легких, уменьшение респираторных симптомов, увеличение толерантности к физическим нагрузкам и более быстрое разрешение остаточных изменений в легких после перенесенной коронавирусной инфекции, осложненной двусторонней пневмонией, на фоне лечения бовгиалуронидазы азоксимером. Несмотря на существенный срок, прошедший после выписки из стационара (три месяца), у всех пациентов сохранялись описанные выше изменения. В том числе на КТ визуализировались участки уплотнения легочной ткани по типу «матового стекла», что, видимо, в большей степени является точкой приложения для действия гиалуронидазы.
Показано, что воздействие на ГК гиалуронидазой, конъюгированной с азоксимером, улучшает функцию легких у пациентов в постковидном периоде (заметные улучшения ФЖЕЛ, пульсоксиметрии и шкалы диспноэ mMRC) в большей степени, чем скорость восстановления легочной ткани по данным КТ ОГК.
В целом полученные данные свидетельствуют о том, что бовгиалуронидазы азоксимер (Лонгидаза) оказывает противовоспалительное действие и может предотвращать формирование фибротических процессов в легких.
Возможность воздействия на ГК в отстроченном периоде после острой вирусной инфекции (в данном случае через три месяца после выписки из стационара) на фоне положительной динамики клинической картины открывает обнадеживающие перспективы в отношении более высокой эффективности от такого лечения в ранние сроки его назначения для предотвращения осложнений постковидного периода.
Применение препарата бовгиалуронидазы азоксимера (Лонгидаза) эффективно в постковидном периоде с остаточными изменениями в легких, особенно у пациентов с ограничениями или противопоказаниями к применению ацетилцистеина и пероральных глюкокортикостеридов.
G.N. Mukhambetova, PhD, T.R. Kasyanova, PhD, Prof., N.R. Kuleshevskaya, PhD, Ye.M. Lipchanskaya, V.N. Gorovenko, PhD
Alexander-Mariinsky Regional Clinical Hospital, Astrakhan
Astrakhan State Medical University
Contact person: Tatyana R. Kasyanova, kasyanova.tatjana@yandex.ru
Purpose to evaluate the effectiveness of bovhyaluronidase azoximer (Longidaza) in patients with residual changes in the lungs after COVID-19.
Material and methods. The study involved 47 patients (25 men and 22 women, mean age 57.82 ± 1.7 years). The study was conducted in patients undergoing outpatient treatment at the Regional Clinic Hospital, Astrakhan, 3 months after discharge from the hospital. The study group included patients who had an identified novel coronavirus infection complicated by bilateral polysegmental pneumonia, of moderate to severe course, with persistent complaints of shortness of breath, general weakness, cough, episodes of shortness of breath and changes in computed tomography (CT) of the lungs with the volume of the lesion 40–70%.
Results. In the group of patients using the drug bovhyaluronidase azoximer (Longidaza) in the regimen of 15 injections (1 injection in 5 days) and 15 rectal suppositories (1 suppository in 3 days), there was a clearer positive clinical dynamics and dynamics according to CT of the lungs than in the comparison group . In the main group, to a greater extent than in the comparison group (without prescribing the drug), shortness of breath, cough and weakness decreased, exercise tolerance increased, and spirographic parameters improved. According to the CT scan of the lungs, the signs of ‘ground glass’ disappeared, and reticular changes significantly decreased.
Conclusion. The study showed the effectiveness of this drug in patients with residual changes in the lungs after suffering COVID-19, which makes it possible to prescribe it to patients in the post-COVID period, especially in those who have restrictions on the use of oral glucocorticosteroids.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.