Расширение возможностей медикаментозного контроля течения СД 2 типа привело к переосмыслению целей и стратегии терапии и определению новых критериев выбора лекарственных препаратов. На сегодняшний день почти все международные алгоритмы терапии СД 2 типа включают инкретиновые препараты, однако в большинстве случаев они рекомендованы к применению в рамках комбинированной терапии на 2–3-м этапах интенсификации лечения. Национальные стандарты оказания помощи больным сахарным диабетом, изданные в 2011 г., содержат рекомендации по применению этих веществ на самых ранних этапах медикаментозного лечения как в монотерапии, так и в комбинации с метформином и даже инсулинотерапией, ставя перед врачом непростую задачу адекватного выбора между традиционными, «старыми» препаратами и современным классом инкретинов.
Вопрос о том, какой медикаментозный подход является более эффективным и обоснованным, остается наиболее интересным и обсуждаемым во всем мире. Насколько обосновано стремительное и широкомасштабное вытеснение проверенных десятилетиями гипогликемизирующих агентов, сопряженное с удорожанием лечения, пока не совсем понятно, но с практической точки зрения нацеливает врачей на оценку индивидуальных потребностей пациента и возможных отдаленных преимуществ.
Обсуждая вопрос оптимального и пациент-ориентированного выбора лекарственной терапии, следует помнить, что СД 2 типа гетерогенен, а клиническая характеристика больных чрезвычайно разнообразна. Страдающие СД 2 типа пациенты могут быть как худыми, так и с ожирением, иметь преимущественные нарушения гликемии как натощак, так и постпрандиально или характеризоваться сочетанием обоих дефектов сразу. Известно, что при СД 2 типа может иметь место как достаточно высокая, так и низкая инсулиновая секреция при различной длительности заболевания, при этом инсулинорезистентность (ИР) тканей-мишеней может быть очень выраженной, хотя нередко у больных сохраняется высокая чувствительность к эффектам инсулина.
Кроме того, существенно меняют портрет пациента такие факторы, как наличие или отсутствие сопутствующих факторов кардиоваскулярного риска (и особенно их количество), сердечно-сосудистых заболеваний, хронической болезни почек, а также возраст и склонность к гипогликемическим реакциям. Таким образом, гетерогенность больных СД 2 типа предопределяет, что контроль течения этого серьезного, хронического, перманентно прогрессирующего заболевания не может быть обеспечен только благодаря универсальным эффектам какого-либо одного класса гипогликемизирующих препаратов. Выбор медикаментозной стратегии является сложной комплексной задачей и должен опираться на данные долгосрочных наблюдений доказательной медицины как с позиции достигнутых результатов, так и исходя из динамики «суррогатных» параметров-маркеров формирования отдаленных осложнений.
Таким образом, комплексная терапия СД 2 типа должна быть адаптирована к потребностям каждого больного и учитывать его клинические особенности. Только такой путь может привести к улучшению результатов, уменьшить экономические потери и продлить жизнь больных, что и является основой современных международных алгоритмов лечения. Так, предложенные в последние годы алгоритмы достижения целевого гликемического контроля фокусируют внимание врачей на важности внедрения в клиническую практику программ по изменению образа жизни и снижению массы тела, которые необходимо инициировать в дебюте СД 2 типа и поддерживать на протяжении всех лет болезни.
Рекомендации диетологов, адресованные пациентам с СД 2 типа, в первую очередь акцентируют внимание на важности контроля суточного количества калорий, размерах порций съедаемых продуктов и блюд, необходимости дробного приема пищи и лишь в последнюю очередь – на подсчете углеводов и учете их гликемического индекса. Однако, несмотря на несомненную эффективность снижения веса и приобщения к здоровому образу жизни, врачи-клиницисты вынуждены констатировать чрезвычайно низкий процент больных, достигающих серьезного результата и приверженных этим рекомендациям в течение длительного времени.
В силу ряда причин пациенты с СД 2 типа с трудом модифицируют свой образ жизни, что приводит к быстрой декомпенсации углеводных нарушений, прогрессированию заболевания, а также к сосудистым и неврологическим нарушениям. В результате эксперты упраздняют этап немедикаментозной коррекции углеводных нарушений, отводя им лишь второстепенную роль, и настойчиво требуют раннего назначения медикаментозной терапии в целях профилактики диабетических осложнений и замедления прогрессирования СД.
С первого дня обнаружения сахарного диабета больным требуется обязательная медикаментозная поддержка. Препаратом выбора на первом этапе противодиабетической терапии во всем мире признан метформин, поскольку он обладает высокой эффективностью и безопасностью, положительным влиянием на вес, доказанной способностью снижать нежелательные сердечно-сосудистые исходы и целым рядом других потенциальных преимуществ. Арсенал первой линии терапии, предложенный российскими рекомендациями, значительно шире и наряду с метформином включает инкретиновые препараты обоих доступных классов.
Российские эксперты выделили ключевые параметры, позволяющие индивидуализировать стратегию гипогликемизирующей терапии, четко обозначив критерии назначения монотерапии, комбинированных препаратов и инсулинотерапии как в дебюте болезни, так и на последующих этапах. Особое внимание уделено месту препаратов класса сульфонилмочевины (СМ), долгие годы занимавших лидирующие позиции среди всех ПСП. С учетом возможности препаратов, стимулирующих секрецию инсулина, вызывать большую вариабельность гликемического профиля, повышать риск гипогликемий, способствовать истощению бета-клеток, препараты СМ были смещены в градацию альтернативного выбора, особенно на ранних сроках СД 2 типа и при уровне НbА1с ≤ 7,5%.
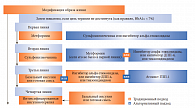
Однако такого мнения придерживаются не все эксперты международного уровня, что нашло отражение в соответствующих рекомендациях. Надо отметить, что эксперты Международной диабетической федерации (IDF) в декабре 2011 г., обновив свой алгоритм лечения СД 2 типа, указали на особое место препаратов СМ (ПСМ) и ингибитора альфа-гликозидазы в качестве терапии первой линии при невозможности применения метформина, вне зависимости от других факторов (рис.). Кроме того, следует отметить, что именно эта группа лекарственных препаратов осталась приоритетным выбором интенсификации терапии второй и третьей линии. Что же послужило основанием для такого неожиданного решения?
Второй аргумент – это понимание реальной картины современной фармакотерапии СД 2 типа: из всех ПСП врачи-клиницисты наиболее часто назначают метформин и ПСМ. Как правило, международные эксперты по рациональному использованию лекарственных средств не рекомендуют спешить с включением принципиально новых препаратов в формулярные списки, за исключением тех редких ситуаций, когда новый препарат позволяет «произвести революцию» в терапии какого-либо заболевания. В значительной степени это обусловлено тем, что истинная безопасность фармакологического препарата может быть определена в среднем лишь спустя 10 лет его широкого применения в реальной медицинской практике.
В перечне жизненно важных препаратов ВОЗ указаны только метформин и глибенкламид, а значит, именно они имеют наибольшую доказательную базу как по эффективности, так и по безопасности и наилучшее из всех ПСП соотношение «эффективность – безопасность – стоимость лечения». Действительно, наиболее цитируемое длительное проспективное независимое исследование в области СД 2 типа UKPDS (United Kingdom Prospective Diabetes Study) оценивало клинические эффекты метформина и глибенкламида.
Подчеркивается, что основные выводы и наиболее полные представления о возможностях контроля течения СД 2 типа были получены на фоне применения этих препаратов. Другое крупномасштабное исследование ADOPT (A Diabetes Outcome Progression Trial), продолжительностью 5 лет, оценивавшее эффективность и безопасность метформина, глибенкламида и росиглитазона у больных СД 2 типа, также убедительно показало высокую эффективность двух «старых» препаратов и превосходящую безопасность в сравнении с «новым» росиглитазоном.
Третий аргумент – важность достижения самого по себе хорошего гликемического контроля как наиболее доказанного способа предотвращения и замедления скорости прогрессии микро- и макрососудистых осложнений. Именно это положение имеет наивысший уровень доказательности и было подтверждено большим числом эпидемиологических, экспериментальных и клинических наблюдений. Данные многих исследований подтверждают факт этиологической и патогенетической взаимосвязи между гипергликемией и оксидативным стрессом, который представляется одной из основных причин развития макро- и микроангиопатических осложнений при СД 2 типа.
Современные данные позволяют с уверенностью говорить, что гипергликемия, наряду со свободными жирными кислотами (СЖК) и инсулинорезистентностью, приводит к развитию оксидативного стресса, активации протеинкиназы-C (PKC) и активации рецепторов конечных продуктов гликирования (RAGE), что вызывает вазоконстрикцию, воспаление и тромбозы. Постоянно увеличивающаяся доказательная база убедительно подтверждает ассоциированность постпрандиальной гипергликемии с оксидативным стрессом, толщиной intima media сонных артерий и эндотелиальной дисфункцией, известных как маркеры сердечно-сосудистых заболеваний (ССЗ).
Доказана также взаимосвязь постпрандиальной гипергликемии с ретинопатией, когнитивной дисфункцией у лиц пожилого возраста и некоторыми видами рака. Анализ 12 исследований с описанием показателей ГПН и 6 исследований, в которых были представлены данные по ППГ, вновь продемонстрировал линейное, беспороговое повышение частоты развития ССЗ в зависимости от уровней ППГ, в то время как для ГПН был выявлен возможный порог ее влияния, равный 5,5 ммоль/л. Аналогично Балтиморское исследование старения (Baltimore Longitudinal Study of Aging), в которое было включено 1236 мужчин, находившихся под наблюдением 13,4 лет, выявило взаимосвязь между уровнями ГПН и ППГ с показателями смертности от всех причин.
Было четко показано увеличение показателей смертности от всех причин при уровне ГПН выше 6,1 ммоль/л (110 мг%), но не при более низких уровнях, а также значительное возрастание риска при увеличении показателей ППГ более 7,8 ммоль/л (140 мг%). Кроме того, следует вновь вспомнить данные исследования UKPDS, доказавшего, что снижение уровня НbА1с на 1% сопряжено со снижением риска развития кумулятивных микрососудистых осложнений на 37% и инфаркта миокарда на 14%.
Четвертый аспект связан с вопросом безопасности применения ПСП и инсулина с позиции их потенциального влияния не только на печень, почки и другие жизненно важные органы, но и на сердечно-сосудистую систему, прибавку массы тела, риски гипогликемических реакций. Анализируя профиль безопасности ключевых «старых» ПСП и инсулина, можно отметить, что каждый отдельный класс имеет свои наиболее ожидаемые нежелательные эффекты, среди которых в основном указываются гипогликемические реакции, повышение веса, сердечно-сосудистые риски или более специфические реакции.
Однако подчеркивается наиболее важный аргумент: для «старых» ПСП побочные реакции хорошо изучены и почти все ожидаемы и предсказуемы, в то время как для «новых» ПСП инкретинового ряда могут быть непредвиденными, а потенциальные токсические эффекты – внезапными. Вот почему так важны долгосрочные исследовательские и наблюдательные программы, особенно для лекарственных препаратов с многочисленными потенциальными органами-мишенями, эффекты которых распространяются на многочисленные гомеостатические системы.
Так, например, росиглитазон, представитель группы тиазолидиндионов, имевший много потенциальных мишеней воздействия, находился в практическом применении около 8 лет, когда впервые в рамках долгосрочных клинических исследований был выявлен новый побочный эффект – остеопороз. В последующем было установлено, что этот эффект, характерный и для пиоглитазона, чаще развивается у женщин, сопряжен с повышением частоты переломов, преимущественно дистальных отделов верхних и нижних конечностей. Последующие метаанализы показали повышение риска развития инфаркта миокарда при лечении росиглитазоном и риска развития рака мочевого пузыря на фоне приема пиоглитазона.
Надо отметить, что некоторые побочные эффекты ПСП могут быть особенно «разрушительными» у наиболее типичных больных СД 2 типа. Даже такие последствия, как гипогликемия, нарастание веса, не говоря об угрозе развития отеков, остеопороза, хронической сердечной недостаточности (ХСН), очень неблагоприятны для больных СД 2 типа, чрезвычайно предрасположенных к сочетанной патологии. Понимая указанные выше аспекты, более предусмотрительно начинать лечение с наиболее изученных препаратов, имеющих не только хороший профиль безопасности, но и высочайшую гипогликемизирующую эффективность. Отмечается, что «новые» препараты не только не успели доказать свою долгосрочную безопасность, но и – что очень важно – не продемонстрировали превосходящий, более мощный гипогликемизирующий эффект по сравнению с традиционными, «старыми» ПСП.
Эти выводы базируются на обзоре 216 контролируемых когортных исследований и 2 метаанализах, изучавших ПСП, представленные на рынке США. Для препаратов СМ, особенно глибенкламида, как наиболее мощного представителя этого класса, гипогликемические реакции являются наиболее частым побочным явлением, хотя тяжелые эпизоды гипогликемических реакций зарегистрированы не более чем у 1,9–3,5% больных, получающих ПСМ. Надо подчеркнуть, что серьезные последствия тяжелых гипогликемий – транзиторная гемиплегия, конвульсии, кардиальные аритмии и другие – преимущественно встречаются среди пациентов старшей и пожилой возрастной группы и при длительном стаже СД 2 типа.
Кроме того, идентифицированы другие причины гипогликемических реакций, такие как нарушение правил приема пищи, физическая активность, нарушения функции почек, потребление алкоголя, которые необходимо учитывать. Однако важно понимать, что мы имеем очень эффективные возможности минимизации гипогликемических реакций с помощью терапевтического обучения больных и самоконтроля глюкозы крови.
Пятый аргумент возвращает нас к современному пониманию патогенетической основы СД 2 типа, отражающей тенденцию к прогрессированию вне зависимости от качества и способа контроля модифицируемых факторов риска. Не вызывает сомнений перманентное усиление основных патологических дефектов, характерных для этого заболевания, что обусловливает ослабление качественного контроля гликемических параметров независимо от вида терапии и необходимость слежения за своевременной интенсификацией лечения. На сегодняшний день международные эксперты определили необходимость инициации комбинированной терапии при уровне НbА1с > 8,5%.
Российские стандарты медицинской помощи при СД 2 типа также указывают на необходимость перехода на комбинированное лечение, однако при уровне НbА1с от 7,6 до 9,0%, учитывая выраженность и скорость достижения желаемого гипогликемизирующего эффекта. Независимо от длительности СД и его отдаленных последствий, возраста больного и других факторов риска, особое внимание уделяется низкодозовым, фиксированным комбинациям, которые должны комплексно воздействовать на фундаментальные патогенетические дефекты, обеспечивать синергизм гипогликемизирующей эффективности, минимизировать нежелательные побочные явления.
Потенциально возможно до 150 в той или иной мере эффективных комбинаций ПСП и инсулина, однако как российские, так и международные эксперты, говоря о первом шаге интенсификации на второй линии терапии СД 2 типа, рациональными и приоритетными признают две комбинации ПСП: метформин + ПСМ и метформин + ингибиторы дипептидилпептидазы-4 (ДПП-4). Однако эксперты IDF в своих последних рекомендациях 2011 г. (рис.) отдают предпочтение ПСМ, подчеркивая их значимость. В качестве альтернативы ПСМ указаны ингибиторы альфа-глюкозидазы и только потом ингибиторы ДПП-4.
Очевидно, что основные расхождения взглядов локализуются на этапах интенсификации лечения после неэффективности максимальных рекомендованных терапевтических доз метформина, в качестве дополнения или альтернативы метформину. Неоднозначность выбора первого шага интенсификации терапии предопределяет дилемма между ожиданием лучших исходов при применении «новых» инкретиновых веществ и предсказуемостью эффективности, безопасности и в целом позитивного прогноза как минимум на 5–10 лет при назначении ПСМ, что подтверждает обширная доказательная база. Какой из этих аргументов более весом, на сегодняшний день однозначно решить невозможно, потребуются длительные наблюдения, клинические исследования и накопление практического опыта.
Итак, на выбор способа коррекции СД 2 типа может повлиять множество факторов, начиная от важности модификации патогенетических дефектов – ИР и/или инсулинсекреторной способности бета-клеток, наличия весомой доказательной базы, вопросов безопасности и переносимости – до потребностей и желания пациента, учета способа введения вещества и даже экономических аспектов. Что считать оптимальным взвешенным выбором?
Так, ключевым аргументом, положенным в основу Консенсуса по ведению пациентов с СД 2 типа Европейской ассоциации по изучению диабета (EASD) и Американской диабетической ассоциации (ADA), выработанного еще в 2009 г. и подтвержденного в 2011 г., стало наличие достаточной доказательной (исследовательской) базы, подтверждающей преимущества и безопасность любого класса ПСП и инсулина с позиции отдаленных осложнений и продолжительности жизни. Таким образом, сколь заманчивыми ни казались бы возможные преимущества инновационных ПСП, их использование остается перспективой, требующей подтверждения практикой. На современном этапе в Европе и США подавляющее большинство пациентов продолжают лечиться проверенными и хорошо изученными «старыми» препаратами.
Эксперты-диабетологи IDF, предлагая новый алгоритм лечения СД 2 типа в 2011 г., опираясь на обширный накопленный практический и научный потенциал, учитывая достижения последних лет, а также подтвержденный профиль безопасности всех современных гипогликемизирующих средств, вновь отдали предпочтение веществам с большой доказательной базой. Ключевым, приоритетным медикаментозным средством в дебюте СД 2 типа остается метформин, с учетом всех его положительных эффектов, а производные СМ – приоритетным классом ПСП для интенсификации лечения и перехода на комбинированную терапию на всех этапах контроля течения СД.
Если учитывать вопросы безопасности лечения больных, достижения лучших отдаленных результатов, влияния на качество и продолжительность жизни, а также экономическую целесообразность, «старые» классические, традиционные препараты – метформин и производные СМ – остаются международным стандартом в лечении СД 2 типа, по крайней мере до тех пор, пока не станет доступна дополнительная информация о новых средствах и крупные исследования не продемонстрируют их более высокую эффективность по сравнению с традиционными препаратами.
В связи с этим хочется вновь привлечь внимание к наиболее часто используемому, самому мощному и самому изученному классу гипогликемических лекарственных средств – препаратам СМ, появившимся на рынке противодиабетических препаратов в 1960-е гг. и к настоящему времени прочно укрепившим свои позиции. Наряду с метформином ПСМ и сегодня занимают важное место в контроле течения СД 2 типа во всем мире, являются наиболее хорошо апробированными в условиях реальной клинической практики веществами.
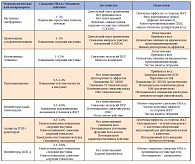
К основным достоинствам ПСМ относят быстрое и предсказуемое гипогликемическое действие, понятный механизм действия, опосредованный связыванием со специфическими рецепторами, небольшое количество побочных эффектов, способность снижать риски развития всех микрососудистых осложнений, а также выгодное соотношение «стоимость/эффект». Доступные на сегодняшний день данные доказательной медицины пока не продемонстрировали существенных преимуществ «новых» препаратов инкретиновых классов по влиянию на «суррогатные» промежуточные точки, а их влияние на «твердые» конечные точки (риски микро- и макрососудистых осложнений и их исходов, заболеваемость и смертность) не изучены (табл.).
Группа ПСМ представлена на рынке большим количеством молекул, поэтому выбор среди них может вызывать определенные трудности. Основным органом-мишенью ПСМ, как известно, являются бета-клетки панкреатических островков, в плазматической мембране которых располагаются специфические рецепторы к сульфонилмочевине. Взаимодействие ПСМ с субъединицами этих специфических рецепторов приводит к закрытию указанных каналов, что ведет к прекращению трансмембранного потока ионов калия. Возникающая при этом деполяризация мембраны активирует потенциалзависимые кальциевые каналы, поступление Са2+ внутрь клеток увеличивается, что ведет к сокращению внутриклеточных миофибрилл и секреции инсулина, синтезированного ранее и накопленного в виде гранул.
В настоящее время роль АТФ-зависимых К+-каналов считается ключевой в процессе регуляции инсулиновой секреции. Терапия ПСМ сопряжена с повышением чувствительности бета-клеток к глюкозному стимулу, что улучшает их функциональные свойства, уменьшая дефицит инсулина, способствует улучшению гликемического контроля. Однако разные ПСМ имеют разную аффинность к SUR1- и SUR2-рецепторам, различаются по биодоступности, скорости всасывания и элиминации. Эти фармакокинетические параметры определяют гипогликемизирующую активность, продолжительность действия, режим дозирования и безопасность.
В многочисленных исследованиях неоднократно сравнивались эффективность и безопасность отдельных секретагогов, однако только глибенкламид выделен ВОЗ и Минздравом России как наиболее рекомендованный к применению представитель ПСМ, сохранивший жизнь огромному количеству больных во всем мире. Глибенкламид действительно обладает уникальным механизмом действия, а также является единственным ПСМ, безопасность которого продемонстрирована при беременности. Имеющиеся данные также свидетельствуют о том, что он не проникает в молоко матери и безопасен для детей, находящихся на грудном вскармливании.
Эффективность и безопасность глибенкламида были проверены многочисленными проспективными рандомизированными долгосрочными исследованиями в области СД 2 типа, впервые доказавшими дополнительное влияние глибенкламида на снижение микрососудистых осложнений при длительном применении. Даже монотерапия глибенкламидом на протяжении многих десятилетий рассматривалась как приоритетное, порой единственно эффективное лечение. Наблюдательные исследовательские программы ADOPT (продолжительностью 5 лет) и UKPDS (продолжительностью 10 лет) подтвердили высокую эффективность и безопасность глибенкламида, а также метформина, в том числе и в отношении сердечно-сосудистых заболеваний.
Следует отметить и избирательность действия глибенкламида в отношении поджелудочной железы: его сродство к АТФ-зависимым К+-каналам кардиомиоцитов более чем в 1000 раз ниже, чем к аналогичным каналам в бета-клетках поджелудочной железы, в связи с чем в дозах, применяемых для лечения СД 2 типа, он не оказывает неблагоприятного влияния на сердце. Напротив, в ряде работ показан кардиопротективный, антиаритмический эффект глибенкламида при ишемии или инфаркте миокарда, который связывают с его способностью предотвращать чрезмерную потерю К+ кардиомиоцитами.
Так, крупный австралийский ретроспективный анализ историй болезни 56 715 пациентов с острым инфарктом миокарда с СД 2 типа и без него показал, что частота фибрилляции желудочков у больных СД 2 типа, получавших глибенкламид, была такой же, как у пациентов без СД, – 11,8% и 11% соответственно, но меньшей, чем у пациентов, принимавших гликлазид и инсулин. В проспективном исследовании LAMBDA (Langendreer Myocardial Infarction and Blood Glucose in Diabetic Patients Assessment) продемонстрировано отсутствие негативного влияния глибенкламида на выживаемость больных СД 2 типа после перенесенного инфаркта миокарда. Кроме того, показано наличие у глибенкламида протективного эффекта в отношении поражений сосудистого эндотелия, вызванных гипергликемией.
В дополнение к этому в 2007 г. был опубликован метаанализ 21 рандомизированного клинического исследования, проведенного за период 1966–2005 гг. Одной из целей метаанализа явилось сравнение безопасности монотерапии глибенкламидом, другими секретагогами и инсулином в отношении риска развития кардиоваскулярных событий. Авторами сделан вывод: применение глибенкламида не сопровождается повышением риска развития кардиоваскулярных событий и смерти к концу периода наблюдения. Таким образом, было признано, что глибенкламид не обнаружил связи с риском развития сердечно-сосудистых событий, повышения смертности и является наиболее серьезно изученным и, вполне оправданно, наиболее часто назначаемым представителем класса СМ, доказавшим свою безопасность.
Более 10 лет назад в клиническую практику пришла микронизированная форма глибенкламида, обладающая лучшей – практически 100%-ной – биодоступностью (в отличие от 70% у своего немикронизированного предшественника), действие которого начинается существенно быстрее, достигая Сmax в плазме уже через 30 мин после его приема. Микронизация способствует значительному увеличению растворимости молекулы глибенкламида и обеспечивает полное высвобождение действующего вещества в течение 5 мин после растворения, быстрое всасывание и возможность приема непосредственно перед едой.
Практически полная биодоступность микронизированной формы позволяет снизить суточную потребность в глибенкламиде на 30–40% и уменьшить риск развития гипогликемии. При этом длительность гипогликемизирующего действия микронизированной формы (24 ч) аналогична таковой у кристаллического глибенкламида. В результате в большей степени достигается совпадение секреции инсулина и повышение гликемии после приема пищи, а значит, снижается риск гипогликемий, достигается большее удобство применения и комплаентность лечения.
В заключение следует подчеркнуть, что по совокупности данных на сегодняшний день приоритет отдается комбинированной терапии, что позволяет реализовать стратегию интенсивной терапии на более ранних этапах болезни и повышает возможности своевременного достижения целевого долгосрочного гликемического контроля. Кроме того, ранняя комбинированная терапия глибенкламидом (представителем класса СМ) и метформином приводит к комплексной коррекции различных патофизиологических нарушений, присущих СД 2 типа. Учитывая гетерогенную природу СД, прогрессирующий характер и множественность патогенетических дефектов, это является несомненным преимуществом.
Фиксированная комбинация глибенкламида и метформина позволяет использовать простые, гибкие схемы терапии, повышает комплаентность больных, приверженность лечению, обеспечивает психологический комфорт и улучшает качество жизни. К важнейшим преимуществам фиксированных комбинаций следует отнести низкие дозы каждого лекарственного компонента без потери противодиабетической эффективности, существенное сокращение побочных эффектов со стороны ЖКТ и минимизацию рисков гипогликемических реакций, нарастания массы тела и др.
Таким образом, на современном этапе метформин и препараты СМ являются основой терапии СД 2 типа и представляют собой наиболее часто используемые классы противодиабетических препаратов, несмотря на появление в последние годы множества новых фармакологических средств, таких как ингибиторы альфа-глюкозидазы, тиазолидиндионы, агонисты ГПП-1 рецепторов и ингибиторы ДПП-4. Результаты долгосрочных клинических исследований и огромный опыт, приобретенный в рутинной практике, по-видимому, являются самыми надежными и наиболее обоснованными аргументами для выбора пациент-ориентированной медикаментозной терапии, позволяющими реально взвешивать соотношение «риск/эффект», а также оценивать преимущества и недостатки в отдаленной перспективе.