XII Конгресс «Сердечная недостаточность» – 2012: Сердечная недостаточность и ассоциированные заболевания: профилактика, диагностика и лечение
- Аннотация
- Статья
- Ссылки
Тема, традиционно обсуждаемая на кардиологических и терапевтических конгрессах, – повышение качества оказания помощи пациентам с ХСН. На объединенной сессии ОССН (Общества специалистов по сердечной недостаточности) и НОАТ (Национального общества по атеротромбозу), прошедшей под председательством профессора Е.П. Панченко, были затронуты проблемы, связанные с лечением пациентов с сердечной недостаточностью и анемией, повышением эффективности и безопасности терапии варфарином, снижением риска внезапной смерти у больных ХСН. На сессии обсуждались вопросы выбора группы препаратов в зависимости от клинической ситуации, влияния диуретиков на жизненный прогноз и ряд других.
Тема, традиционно обсуждаемая на кардиологических и терапевтических конгрессах, – повышение качества оказания помощи пациентам с ХСН. На объединенной сессии ОССН (Общества специалистов по сердечной недостаточности) и НОАТ (Национального общества по атеротромбозу), прошедшей под председательством профессора Е.П. Панченко, были затронуты проблемы, связанные с лечением пациентов с сердечной недостаточностью и анемией, повышением эффективности и безопасности терапии варфарином, снижением риска внезапной смерти у больных ХСН. На сессии обсуждались вопросы выбора группы препаратов в зависимости от клинической ситуации, влияния диуретиков на жизненный прогноз и ряд других.

![Рис. 1. Выживаемость больных с хронической сердечной недостаточностью в зависимости от уровня гемоглобина (адаптировано по [1])](/upload/resize_cache/iblock/57a/195_350_1/57a865d761d38679820de1dd589abb2f.jpg)
![Рис. 2. Взаимосвязь смертности больных с хронической сердечной недостаточностью с уровнем гемоглобина (адаптировано по [2])](/upload/resize_cache/iblock/5d1/195_350_1/5d193ed4d5e76eb7129545d13a0da168.jpg)




![Рис. 5. Влияние приема пищи на динамику концентрации бисопролола в плазме [8]](/upload/resize_cache/iblock/307/195_350_1/3072988100640d9420e74e4274f3a692.jpg)
![Рис. 6. Выживаемость участников исследования CIBIS III в течение года (адаптировано по [5])](/upload/resize_cache/iblock/15b/195_350_1/15bf80202d6a5806728331a44e919fd1.jpg)
Анемия и хроническая сердечная недостаточность: миф или реальность?
По мере развития сердечной недостаточности периферические органы и ткани получают все меньше кислорода, что приводит к запуску компенсаторных механизмов. Увеличивается выработка эритропоэтина, происходит мобилизация железа, депонируемого в печени, что в конечном счете приводит к восстановлению транспорта кислорода и уменьшению гипоксии. Данные процессы подтверждают наличие связи между ХСН и анемией.
Как отметил заместитель проректора МГУ им. М.В. Ломоносова, д.м.н., профессор В.Ю. МАРЕЕВ, у пациентов с ХСН, не имеющих каких-либо других заболеваний, анемия не развивается, а напротив, должно наблюдаться компенсаторное повышение уровня гемоглобина. В случае если анемия все-таки развилась (происходит это, по данным разных авторов, в 10–56% случаев), можно предположить, что у пациента имеется нарушение функции почек, печени или костного мозга. Падает уровень гемоглобина и по мере повышения функционального класса (ФК) ХСН по классификации Нью-Йоркской ассоциации кардиологов (NYHA, New York Heart Association) – у больных I и II ФК он составляет в среднем 13,7 и 13,4 г/дл соответственно, а у пациентов с IV ФК – 10,9 г/дл.
Среди причин анемии при ХСН можно выделить кровопотери, гемодилюцию, снижение чувствительности костного мозга к эритропоэтину, повышение уровня фактора некроза опухоли альфа, хроническую почечную недостаточность (и связанное с ней снижение выработки эритропоэтина). Кроме того, анемия может быть результатом дефицита железа или витаминов группы B, а также нежелательным эффектом лечения, развившимся на фоне применения ингибиторов ангиотензинпревращающего фермента (АПФ).
При анемии осуществляется запуск ряда физиологических и патологических процессов, приводящих к дилатации левого желудочка (ЛЖ) и в конечном счете – к фиброзу миокарда и гипертрофии ЛЖ. Кроме того, анемия играет ключевую роль в развитии синдрома кардиоренальной анемии. Влияет анемия и на жизненный прогноз пациентов с ХСН. Данные исследований свидетельствуют о том, что анемия у пациентов с ХСН является независимым фактором риска госпитализации и смерти. Считается, что она увеличивает относительный риск смерти в 1,47 раза, а госпитализации – в 1,43 раза. Имеются данные, указывающие на уменьшение выживаемости больных по мере падения уровня гемоглобина (рис. 1) [1].
Можно ли рассматривать анемию, значительно отягчающую жизненный прогноз пациента с ХСН, как модифицируемый фактор риска ХСН, и как ее можно модифицировать? Несмотря на достаточное количество данных, указывающих на целесообразность повышения уровня гемоглоблина у пациентов с ХСН и анемией, лечение таких больных сопряжено с рядом трудностей. Так, оптимальный уровень гемоглобина для больных с ХСН неизвестен, хотя очевидно, что он должен составлять более 12 г/дл. Кроме того, каким должен быть оптимальный способ терапии: следует ли применять препараты железа или эритропоэз-стимулирующие препараты?
Показано, что терапия дарбэпоэтином к 12-й неделе повышает среднюю концентрацию гемоглобина на 2 г/дл, при этом относительный риск смерти и госпитализации составляет 0,76 и 0,66 соответственно (по результатам трех исследований 2-й фазы). Однако при использовании препаратов, стимулирующих эритропоэз в реальной клинической практике, а не в процессе проведения исследований, очень сложно удержать уровень гемоглобина в пределах 15 г/дл, в то время как превышение этого порога скачкообразно увеличивает риск смерти пациентов с ХСН (рис. 2) [2].
На фоне применения дарбэпоэтина порой наблюдается выраженное субъективное улучшение одновременно с существенным ухудшением прогноза, обусловленным повышением артериального давления (АД), поражениями эндотелия, повышением адгезии тробоцитов, увеличением веса и токсичностью терапии. Кроме того, наиболее распространенной причиной анемии у пациентов с ХСН высоких ФК является дефицит железа. При этом железо, как и эритропоэтин, играет ключевую роль в эритропоэзе, без него невозможно созревание эритроцитов. Дефицит железа также негативно сказывается на активности респираторных ферментов, что, наряду со снижением уровня гемоглобина, в конечном счете приводит к падению парциального давления кислорода (pVO2).
Для коррекции относительного дефицита железа (как правило, он наблюдается у пациентов с ХСН) может с успехом применяться препарат Феринъект (Феринжект) на основе феррокарбоксимальтозы, стабильного полинуклеарного комплекса железа, контролируемо выделяющегося в депо и позволяющего тем самым избежать токсичности и развития окислительного стресса. Феринъект характеризуется широким терапевтическим окном, хорошей переносимостью и высокой безопасностью (препарат может применяться без тестовой дозы). Феринъект отличается также удобством применения: доза 1000 мг железа может быть введена в течение 15 минут, что сокращает затраты на пребывание в клинике.
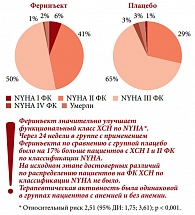
Эффективность Феринъекта была подтверждена в исследовании FAIR-HF (Ferinject Assessment in Patients with Iron Deficiency and Chronic Heart Failure –Исследование Феринжекта у пациентов с дефицитом железа и хронической сердечной недостаточностью), показавшем, что препарат достоверно улучшает как субъективную оценку здоровья, так и ФК ХСН (рис. 3) [3]. Результаты 6-минутного теста ходьбы в группе, получавшей Феринъект, достоверно улучшились уже на 4-й неделе терапии, увеличилась также скорость клубочковой фильтрации. Кроме того, в группе Феринъекта наблюдалось достоверно меньше пациентов с неблагоприятными исходами заболевания – смертью и госпитализацией. Случаев развития тяжелых аллергических реакций на фоне использования Феринъекта зарегистрировано не было. В целом, как отметил профессор В.Ю. Мареев, терапия препаратом Феринъект благотворно влияла на функциональный статус, симптоматику и качество жизни больного.
Что можно сделать для повышения эффективности и безопасности лечения варфарином? Предварительные результаты исследования ВАРФАГЕН (WARFAGEN)
Варфарин широко используется в кардиологической практике. Он применяется для профилактики инсульта у больных с фибрилляцией предсердий, тромбозов искусственных клапанов сердца, лечения венозных тромбозов, а в ряде случаев (при непереносимости антиагрегантов) – для профилактики сердечно-сосудистых заболеваний (ССЗ). Как отметила профессор Е.П. ПАНЧЕНКО (Институт кардиологии им. А.Л. Мясникова ФГБУ РКНПК МЗ РФ), для ряда пациентов альтернативы варфарину нет, как нет и указаний на то, что она может появиться в скором времени.
Единственной сложностью, возникающей при использовании варфарина, является его узкое терапевтическое окно: диапазон, позволяющий существенно снижать риск развития ишемических событий, но при этом не очень сильно повышающий риск развития кровотечений (в том числе наиболее опасных – внутричерепных), чрезвычайно узок. Многочисленные исследования показывают, что риск развития кровотечений выше в начале лечения, в период подбора дозы. Около 30% всех кровотечений происходит при значениях международного нормализованного отношения (МНО) 2–3.
Поддерживающая доза варфарина широко варьирует: есть пациенты, которым достаточно суточной дозы 1 мг и менее, в то время как другим больным требуется более 10 мг препарата. Кровотечения чаще наблюдаются у пациентов, принимающих сравнительно небольшие дозы препарата, < 5,6 мг/сут. Различия между пациентами, нуждающимися в приеме варфарина, заключаются в уровне оптимальной дозы препарата и колебаниях МНО на фоне терапии – в то время как у одних больных данный показатель отличается низкой вариабельностью, у других он выходит за пределы терапевтических значений.
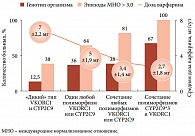
Предполагается, что индивидуальная чувствительность к варфарину может быть связана с его метаболизмом, осуществляемым системой цитохрома P4502C9 (CYP2C9). Полиморфизм гена CYP2C9 является одной из ключевых причин изменения скорости метаболизма варфарина, а значит, и величины дозы препарата (больным с быстрым метаболизмом требуются большие дозы варфарина). Фармакодинамические различия в действии варфарина могут быть обусловлены полиморфизмом гена, отвечающего за синтез эпоксидредуктазы витамина К (vitamin K epoxide reductase complex 1, VKORC1). Оптимальная доза варфарина зависит от генотипа больного (рис. 4). Это необходимо учитывать при назначении лечения, поскольку, согласно данным исследований, пациенты, для которых средняя доза варфарина будет отличаться от средней в популяции больных, составляют значительную часть больных, нуждающихся в терапии варфарином (алгоритм расчета индивидуальной дозы варфарина указан на сайте www.warfarindоsing.org). Фармакогенетические исследования CYP2C9 позволяют в 5 раз снизить частоту кровотечений и существенно уменьшить длительность подбора адекватной дозы варфарина.
Зарубежные специалисты достаточно хорошо изучили проблему генетического полиморфизма в контексте дозирования варфарина, однако переносить эти результаты на российскую популяцию нецелесообразно, поскольку распространенность тех или иных аллелей у наших соотечественников может существенно отличаться. Для повышения качества терапии варфарином в России было решено провести исследование ВАРФАГЕН (WARFAGEN). В ходе работы сравнивались стандартный и фармакогенетический подходы к подбору дозы варфарина, а целью исследования являлась оптимизация периода достижения терапевтических значений, стабильности МНО и частоты кровотечений. В исследовании участвовало 232 пациента (мужчины – 52,6%, женщины – 47,4%; средний возраст – 63,5 ± 11,7 лет), нуждающихся в длительной антикоагулянтной терапии, ранее не принимавших варфарин или принимавших его без достижения целевых значений МНО.
В ходе исследования было установлено, что у пациентов, которым доза варфарина назначалась с учетом результатов генотипирования, терапевтические значения МНО достигались достоверно быстрее (табл. 1), а кровотечения развивались реже (табл. 2), хотя статистически достоверных величин достигла только разница между частотой серьезных кровотечений. В экспериментальной группе также достоверно реже наблюдались эпизоды подъема МНО > 4,0 (в 3,95 и 33,3% случаев соответственно).
В процессе проведения исследования были сделаны выводы о целесообразности внедрения в широкую клиническую практику фармакогенетических исследований с целью определения индивидуальной чувствительности к варфарину, было подчеркнуто также, что наибольшую пользу этот подход принесет носителям сочетания полиморфизмов в генах CYP2C9 и VKORC1, или генотипа АА гена VKORC1, или аллельных вариантов *3 гена CYP2C9.
Пациент с хронической сердечной недостаточностью: можно ли снизить риск внезапной смерти?
Как подчеркнул в начале своего выступления заведующий кафедрой терапии ГБОУ ВПО «РНИМУ им. Н.И. Пирогова», д.м.н., профессор Г.П. АРУТЮНОВ, в соответствии с последними национальными рекомендациями, основную роль в борьбе с внезапной смертью теперь будут играть врачи первичного звена, терапевты, которые и должны определять наиболее «опасную» с точки зрения риска внезапной смерти группу пациентов. Внезапная сердечная смерть (ВСС) чаще всего поражает пациентов с ХСН низких ФК. Так, среди пациентов с II ФК частота ВСС составляет 60%, а среди больных с IV ФК она примерно в два раза ниже. В любом случае наличие ХСН является серьезнейшим предиктором ВСС – согласно результатам Фремингемского исследования, на фоне ХСН риск внезапной смерти увеличивается в 6–9 раз. Выявлены основные факторы риска ВСС, на которые должны обращать внимание терапевты. К наиболее опасным факторам относятся:
- остановка кровообращения в анамнезе;
- эпизоды синкопе;
- гемодинамически значимая устойчивая желудочковая тахикардия;
- инфаркт миокарда в анамнезе;
- фракция выброса ЛЖ < 40%;
- желудочковая экстрасистолия;
- эпизоды неустойчивой желудочковой тахикардии.
- больные с гипертрофической, дилатационной и правожелудочковой кардиомиопатией;
- больные с синдромом удлиненного интервала QT;
- больные с синдромом Brugada;
- больные с катехоламинергической полиморфной желудочковой тахикардией.
- пациенты с ишемическим и неишемическим генезом ХСН;
- пациенты с синдромом удлиненного QT;
- пациенты с аритмогенной дисплазией правого желудочка;
- пациенты с аортальным стенозом.
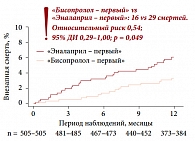
С целью изучения безопасности и эффективности лечения ХСН на начальной стадии с использованием монотерапии бета-адреноблокатором (препарат Конкор) по сравнению с монотерапией ингибиторами АПФ (эналаприлом) было проведено исследование CIBIS III (The Third Cardiac Insufficiency BIsoprolol Study – Третье исследование бисопролола при сердечной недостаточности). В ходе исследования одна группа пациентов начинала лечение с терапии препаратом Конкор, к которому спустя 6 месяцев добавлялся эналаприл; во второй группе пациентов препаратом стартовой терапии являлся эналаприл. В ходе работы было показано, что стратегия «Конкор – первый» увеличивает выживаемость в ранней фазе исследования (рис. 6) [5], позволяя впоследствии большему числу пациентов получить эффект от комбинированной терапии. Однако в целом результаты исследования CIBIS III поддерживают концепцию свободного выбора, оставляя за лечащим врачом право решать, начинать терапию с бета-адреноблокатора или ингибитора АПФ. Первый вариант целесообразнее назначать при лечении пациентов с тахикардией, инфарктом миокарда в анамнезе, аритмиями и почечной недостаточностью, второй вариант предпочтителен для больных с брадикардией.
Результаты исследования CIBIS III также продемонстрировали, что в группе, в которой использовалась стратегия «Конкор – первый», достоверно снизилось число внезапных смертей в течение года наблюдения (рис. 7). Селективность бета-адреноблокаторов напрямую зависит от дозы препарата и проявляется лишь при использовании низких доз: по мере увеличения количества препарата в организме он начинает блокировать бета-адренорецепторы, расположенные не в только в сердце, но и в других органах. Однако селективные бета-адреноблокаторы в низких дозах меньше влияют на периферические сосуды и бронхи, а также не вызывают гипогликемию. Наиболее кардиоселективным из современных бета-адреноблокаторов считается бисопролол, два других распространенных бета-адреноблокатора (карведилол и небиволол) характеризуются также способностью к вазодилатации. Достоверной разницы между этими препаратами с точки зрения влияния на риск ВСС, согласно последним данным, не существует.
Бета-адреноблокаторы обладают высшим уровнем доказательности (Ia) именно как средства для профилактики ВСС, то же относится и к ингибиторам АПФ, препаратам, способным, согласно метаанализу, проведенному M.J. Domanski и соавт., на 20% снижать риск ВСС [6]. Безопасность и эффективность высоких и низких доз ингибиторов АПФ были подтверждены многочисленными исследованиями, в частности результатами исследования ATLAS (Assessment Of Treatment With Lisinopril And Survival – Исследование терапии лизиноприлом и выживаемости) [7], в ходе которой были выделены следующие предикторы ВСС:
- ишемическая этиология ХСН;
- прием длительно действующих нитратов;
- лечение ингибиторами АПФ до начала исследования (тяжелое течение болезни).
Заключение
Негативное влияние на жизненный прогноз осложнений сердечно-сосудистых заболеваний и болезней почек сегодня может быть существенно уменьшено благодаря своевременному и адекватному назначению лекарственных средств, как инновационных, так и проверенных временем. Так, современный препарат Феринъект помогает бороться с анемией, нередко развивающейся у пациентов с ХСН, а хорошо известный российским врачам препарат варфарин способен уменьшить риск развития тромбозов. Применение последнего, впрочем, должно осуществляться в соответствии с результатами наиболее актуальных научных исследований, поскольку только так можно сократить риск развития нежелательных явлений и сделать применение варфарина наиболее эффективным. Препарат Конкор при использовании правильной стратегии применения у больных ХСН также способен существенно снизить риск ВСС, сердечно-сосудистых осложнений и летальных исходов.
Тема, традиционно обсуждаемая на кардиологических и терапевтических конгрессах, – повышение качества оказания помощи пациентам с ХСН. На объединенной сессии ОССН (Общества специалистов по сердечной недостаточности) и НОАТ (Национального общества по атеротромбозу), прошедшей под председательством профессора Е.П. Панченко, были затронуты проблемы, связанные с лечением пациентов с сердечной недостаточностью и анемией, повышением эффективности и безопасности терапии варфарином, снижением риска внезапной смерти у больных ХСН. На сессии обсуждались вопросы выбора группы препаратов в зависимости от клинической ситуации, влияния диуретиков на жизненный прогноз и ряд других.
