Влияние кардиометаболической патологии и приверженности терапии у пациентов с тахииндуцированной кардиомиопатией
- Аннотация
- Статья
- Ссылки
- English

Введение
Сердечная недостаточность с низкой фракцией выброса (СНнФВ) является результатом прогрессирующего развития сердечно-сосудистой патологии и одной из ключевых причин инвалидизации и смерти среди трудоспособного населения РФ [1, 2]. Фибрилляция предсердий (ФП) и трепетание предсердий (ТП) – наиболее распространенные предсердные тaхиаритмии, на долю которых приходится более 70% всех наджелудочковых нарушений ритма сердца. ФП и ТП возникают как первично, так и вторично, в том числе на фоне хронической сердечной недостаточности (ХСН), усугубляя систолическую дисфункцию левого желудочка (ЛЖ) за счет ремоделирования миокарда, и приводят к тахииндуцированной кардиомиопатии (ТИКМП) c последующим формированием миокардиального фиброза [3]. Залогом сохранения адекватного качества жизни пациента с ТИКМП, снижения частоты регоспитализаций, прогрессирования клинических симптомов ХСН и риска развития летальных исходов является устранение такого патогенетического каскада путем эффективного инвазивного метода лечения ФП и/или ТП [4–6].
Эффективность первичной катетерной аблации при ТП составляет 75–90%, повторной по поводу рецидивов ТП – около 100%. При этом частота осложнений не превышает 0,81%. К редким осложнениям после радиочастотной аблации (РЧА) относят развитие полной атриовентрикулярной (АВ) блокады, окклюзию правой коронарной артерии, тампонаду сердца и пневмоторакс [7–9].
В настоящее время нет единого мнения о применении РЧА в качестве эталонного метода лечения типичного ТП при СНнФВ, преимущественно за счет отсутствия данных крупномасштабных проспективных клинических многоцентровых исследований относительно успешности проведения РЧА при ТП у пациентов с нарушенной систолической функцией ЛЖ [10–12].
В одной из наших недавних публикаций [13] мы поделились собственным клиническим опытом применения криобаллонной аблации при ТИКМП. В данной статье представлены клинические случаи катетерного лечения типичного ТП, приведшего к развитию ТИКМП.
Клинический случай 1
Пациент В., 50 лет, поступил в стационар с жалобами на одышку при минимальной физической нагрузке и в покое, отеки и трофические изменения на ногах, увеличение живота, перебои в работе сердца.
Из анамнеза известно, что в течение двух лет у пациента отсутствовала оптимальная кардиальная терапия, несмотря на наличие постоянной формы ТП, артериальной гипертонии на фоне ожирения 2-й степени (индекс массы тела – 36,65 кг/м²).
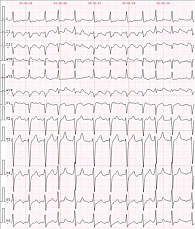
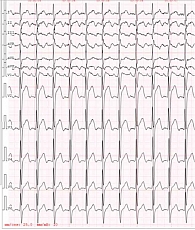
Состояние при поступлении в стационар тяжелое, выраженные отеки на обеих нижних конечностях до верхней трети бедра, трофические изменения голеней, асцит, цианоз носогубного треугольника, частота дыхательных движений – 26–28 в минуту, аускультативно дыхание везикулярное с жестким оттенком, ослабленное в нижних отделах легких с обеих сторон, рассеянные влажные хрипы; тоны сердца приглушены, ритм неправильный, частота сердечных сокращений (ЧСС) – 128 в минуту, дефицит пульса – 15 уд/мин (ТП), артериальное давление на обеих руках – 100/60 мм рт. ст. Электрокардиограмма, выполненная при госпитализации, показала типичное ТП с ЧСС 128 в минуту (рис. 1).
В анализах крови повышение уровней NT-proBNP до 20 100 пг/мл, С-реактивного белка (СРБ) до 48,15 мг/л, креатинфосфокиназа (КФК) – 46,5 ЕД/л (КФК-МВ – 7,6 ЕД/л), липопротеины низкой плотности (ЛПНП) – 2,22 ммоль/л, липопротеины высокой плотности – 0,58 ммоль/л, триглицериды (ТГ) – 1,10 ммоль/л, тиреотропный гормон (ТТГ) – 4,95 мМЕ/л, скорость клубочковой фильтрации (по формуле CKD-EPI ) – 41 мл/мин/1,73м2, гликированный гемоглобин – 7,2%.
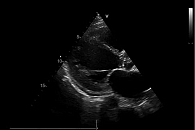
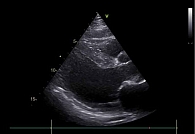
Данные трансторакальной эхокардиографии (ЭхоКГ): выраженная дилатация левых и правых отделов сердца со снижением ФВ ЛЖ до 25%, конечный диастолический объем ЛЖ – 289 мл, толщина межжелудочковой перегородки – 0,9 см, толщина задней стенки желудочка – 1,0 см, объем левого предсердия – 167 мл, систолическое давление в легочной артерии – 45 мм рт. ст. (рис. 2), перикардиальный выпот, в левой полости до 350 мл свободной жидкости, в правой – около 600 мл.
Ультразвуковое исследование (УЗИ) органов брюшной полости: 3000 мл свободной жидкости, гепатомегалия, диффузные изменения печени и поджелудочной железы.
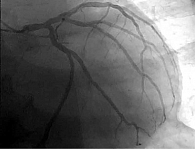
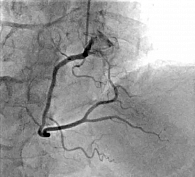
Для исключения ишемического генеза кардиомиопатии пациенту была выполнена селективная коронароангиография, по данным которой атеросклеротического поражения коронарного русла, требующего хирургического лечения, не выявлено (рис. 3).
Данные холтеровского мониторирования электрокардиограммы (ХМ ЭКГ): на протяжении всего исследования регистрировалось ТП с АВ проведением 2:1 и ЧСС 85–103–149 в минуту, пауз не выявлено.
На основании результатов клинико-лабораторных исследований пациенту выставлен диагноз: тахииндуцированная неишемическая кардиомиопатия. Нарушение ритма сердца: постоянная форма трепетания предсердий, тахиситолический вариант (CHA2DS2-VAS – 3 балла, HAS-BLED – 2 балла) mEHRA III. ХСН со сниженной ФВ ЛЖ. Недостаточность кровообращения (НК) стадии IIБ, функциональный класс (ФК) IV по NYHA. Перикардиальный выпот. Двусторонний гидроторакс. Асцит. Гипертоническая болезнь стадии III, контролируемая артериальная гипертензия, риск сердечно-сосудистых осложнений – 4. Ожирение 2-й степени. Впервые выявленный сахарный диабет 2-го типа. Целевой уровень HbA1c < 7,0%. Хроническая болезнь почек стадии IIIБ. Некротические трофические язвы голени. Первичный гипотиреоз, впервые выявленный.
Ведущим синдромом в клинической картине была ХСН со сниженной ФВ ЛЖ на фоне тахиформы ТП. Пациенту оптимизировали кардиальную терапию: валсартан/сакубитрил 100 мг/сут с постепенным увеличением дозы до 200 мг/сут, дапаглифлозин 10 мг/сут, амиодарон в насыщаемой дозе 600 мг/сут под контролем QTc, ривароксабан 20 мг/сут, спиронолактон 100 мг/сут, фуросемид 140 мг/сут. Учитывая некротические трофические язвы голеней и повышенный уровень белков воспаления, пациенту назначили антимикробную терапию.
Пациент выписан на седьмые сутки из стационара с положительной динамикой: увеличение дистанции ходьбы до ФК III по NYHA, исчезновение одышки в покое, уменьшение выпота в брюшной и плевральной полостях по данным контрольных УЗИ, урежение среднесуточной ЧСС на фоне ТП до 82 в минуту по данным контрольного ХМ ЭКГ.
Через месяц пациент повторно был госпитализирован с клинической картиной декомпенсации ХСН. Кроме того, в анализе крови обращало на себя внимание повышение уровня СРБ до 87,05 мг/л, прокальцитонина до 0,10 нг/мл, NT-proBNP – 16 400 пг/мл, ТТГ – 5,69 мМЕ/л, гликированный гемоглобин – 106 г/л. При этом, по данным ЭхоКГ, зафиксировано увеличение ФВ ЛЖ до 36%. По данным УЗИ, в левой плевральной полости 250 мл свободной жидкости, в правой – 300 мл, в брюшной полости – до 1000 мл.
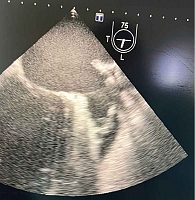
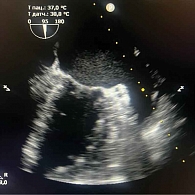
Чреспищеводная (ЧП) ЭхоКГ показала тромбоз ушка левого предсердия, в связи с чем пациент был переведен на варфарин под контролем целевого уровня международного нормализованного отношения (МНО) (рис. 4).
Пациент находился на стационарном лечении 16 суток. Отмечалась положительная динамика в клиническом состоянии на фоне кардиальной и антибактериальной терапии. С учетом повышения ФВ ЛЖ и отсутствия жизнеугрожающих аритмий по данным ХМ ЭКГ было принято решение о проведении РЧА кавотрикуспидального перешейка для лечения ТП после нормализации маркеров воспаления в крови и регресса внутрисердечного тромбоза.
Однако через три недели пациент был повторно госпитализирован в стационар с клинической картиной острой сердечно-легочной недостаточности. Результаты мультиспиральной компьютерной томографии органов грудной клетки с внутривенным контрастированием показали правостороннюю тромбоэмболию легочной артерии мелких ветвей в отсутствие признаков тромбоза по данным ультразвуковой допплерографии вен нижних конечностей. МНО при поступлении – 2,45. Прогрессирование полиорганной недостаточности на фоне исходной декомпенсированной ХСН и полиморбидности привело к летальному исходу через 48 часов от момента госпитализации.
Клинический случай 2
Пациент О., 74 года, поступил в стационар с жалобами на приступы учащенного сердцебиения, одышку при незначительной физической нагрузке и в покое.
Из анамнеза известно, что в течение двух лет пациент страдал пароксизмальной формой ТП. За последние шесть месяцев было предпринято несколько попыток применения медикаментозной и электрической кардиоверсии.
Общее состояние при поступлении в стационар средней тяжести, отеки голеней и стоп. При поступлении на ЭКГ трепетание предсердий, типичная форма, ЧСС – 123 в минуту (рис. 5).
В анализах крови NT-proBNP – 1900 пг/мл, СРБ – 2,04 мг/л, КФК – 74,3 ЕД/л, КФК-МВ – 7,10 ЕД/л, ЛПНП – 1,58 ммоль/л, ТГ – 0,57 ммоль/л, ТТГ – 1,69 мМЕ/л, свободный тироксин (Т4) – 17,06 пмоль/л, клиренс креатинина (по формуле Кокрофта – Голта со стандартизацией на площадь поверхности тела) – 48 мл/мин/1,73м2.
ЭхоКГ показала дилатацию правых камер сердца со снижением ФВ ЛЖ до 34% (рис. 6).
ЧП ЭхоКГ – без дополнительных эхо-сигналов (рис. 7).
Результаты ХМ ЭКГ: на протяжении всего исследования зафиксировано типичное ТП с коэффициентом проведения 2:1–4:1.
Селективная коронароангиография – без ангиографически значимых сужений (рис. 8).
На основании полученных результатов выставлен диагноз: тахииндуцированная неишемическая кардиомиопатия. Нарушение ритма сердца: длительно персистирующий пароксизм типичного ТП (CHA2DS2-VAS – 2 балла, HAS-BLED – 1 балл), mEHRA III. ХСН со сниженной ФВ ЛЖ. НК стадии IIБ, ФК IV по NYHA. Гипертоническая болезнь стадии III, контролируемая артериальная гипертензия, риск сердечно-сосудистых осложнений – 4. Гипертоническая нефроангиопатия. Хроническая болезнь почек стадии IIIА. Учитывая клиническую картину прогрессирования ХСН на фоне тахиформы ТП с высоким риском развития фатальных осложнений, пациенту провели РЧА кавотрикуспидального перешейка с восстановлением синусового ритма с ЧСС 62 в минуту во время аблации (рис. 9). В удовлетворительном состоянии пациент выписан под амбулаторное наблюдение.
При контрольном обследовании через шесть месяцев отмечалось увеличение дистанции ходьбы без одышки (повышение ФК до I–II). ЭхоКГ показала возрастание ФВ ЛЖ до 51%. В анализах крови снижение уровня NT-proBNP до 408 пг/мл. По данным ХМ ЭКГ, зарегистрирован синусовый ритм с ЧСС 49–58–97 в минуту, один неустойчивый пароксизм наджелудочковой тахикардии длительностью 4 секунды с ЧСС 105 в минуту, 28 пароксизмов нетипичного ТП с максимальной продолжительностью 2 минуты 53 секунды.
Обсуждение
В настоящее время отсутствуют четкие рекомендации по лечению тахииндуцированной кардиомиопатии [14]. По мнению T. González-Ferrero и соавт., диагноз ТИКМП подтверждается, когда кардиомиопатия регрессирует после устранения индуцированной аритмии [15]. Такая потенциальная «обратимость» ТИКМП, на наш взгляд, служит убедительным основанием для ранней диагностики и своевременного оперативного вмешательства, которые в совокупности приводят к значительному улучшению систолической функции миокарда ЛЖ и клинических долгосрочных результатов лечения.
Представленные нами клинические наблюдения демонстрируют не только необходимость персонифицированного подхода к выбору тактики ведения пациентов с ТИКМП для своевременного выполнения РЧА и назначения оптимальной медикаментозной терапии, но и необходимость более широкого применения катетерной аблации при ТП у пациентов с ХСН со сниженной ФВ ЛЖ. Как видим, индивидуально подобранное адекватное комплексное лечение ТП приводит к улучшению качества жизни, систолической функции миокарда ЛЖ и снижению повторных госпитализаций.
Появление новых методов лечения ТИКМП, в частности РЧА на фоне оптимальной медикаментозной терапии, дают возможность опосредованно влиять на структурное ремоделирование миокарда на фоне длительно существующей аритмии. Однако в значительной степени декомпенсированное течение СНнФВ в сочетании с АГ, сахарным диабетом, ожирением, хронической болезнью почек, трофическими изменениями кожных покровов само по себе служит независимым фактором риска развития жизнеугрожающих состояний. Результаты второго клинического наблюдения подтверждают, что пациенты с ТИКМП независимо от возраста получают пользу от аблации при ТП со значительным улучшением ФВ ЛЖ.
Значительная часть проведенных клинических исследований и рекомендаций касается пациентов с ТИКМП и исключает индивидуальную коморбидность. По нашему мнению, отсутствие единого подхода к оценке сопутствующей патологии негативно отражается на эффективности лечения, прогнозе заболевания и продолжительности жизни пациентов. Ю.В. Фроловой и соавт. установлено, что тяжелая коморбидность у пациентов с ХСН со сниженной ФВ ЛЖ является независимым фактором риска смертельных исходов, что и продемонстрировано в первом клиническом случае. Ведение полиморбидных пациентов представляет сложную клиническую задачу для любого практического врача, поскольку требует масштабного учета нескольких аспектов лечения, что затрудняет контроль эффективности терапии, увеличивает вероятность полипрагмазии и расходы на стационарное лечение в связи с проведением полифармакотерапии, существенно ухудшает долгосрочный прогноз.
Наиболее частым клиническим вариантом патологий, ассоциированных с высоким риском неблагоприятных исходов, считается сочетание ССЗ и метаболических расстройств (сахарный диабет 2-го типа, ожирение и/или метаболический синдром). ТП с последующим развитием ТИКМП в первом случае – это не только манифестация основного заболевания, но и следствие прогрессирующего метаболического синдрома. Несмотря на оптимизацию лечения по поводу декомпенсированного течения ХСН на фоне ТИКМП, состояние пациента дополнительно усугубилось мультисистемным органным поражением. Несколько повторных госпитализаций не позволили стабилизировать статус пациента для проведения коррекции нарушений ритма хирургическим путем. Тяжелая коморбидность стала ключевым фактором, приведшим к летальному исходу: пациент скончался в результате острой сердечно-легочной недостаточности, вызванной тромбоэмболией легочной артерии.
В последнее десятилетие долгосрочный прогноз у пациентов с ТИКМП значительно улучшился благодаря развитию высокотехнологичных современных подходов к лечению ТП и ХСН. Подобные тенденции связаны с внедрением и реализацией стандартов оптимизированной кардиальной терапии ХСН, а также с более широким внедрением катетерных методов лечения сопутствующих нарушений ритма сердца. На наш взгляд, целесообразно продолжить разработку индивидуализированных подходов к оценке исходного статуса и лечению коморбидных пациентов, имеющих высокий риск летального исхода.
Практикующие врачи должны помнить, что ТИКМП неишемического генеза возникает в любом возрасте. До сих пор отсутствуют проспективные клинические и эпидемиологические данные о ее распространенности, хотя клиническая картина аритмогенной кардиомиопатии (АКМП) известна уже несколько десятилетий [16]. Допускаем, что значимость АКМП в прогрессировании клинических признаков ХСН не всегда своевременно определяется врачами в общей клинической практике. Вероятно, это обусловлено тем, что тахисистолическую аритмию нередко считают результатом или следствием любой другой патологии, а не этиологической причиной развития систолической дисфункции ЛЖ [17].
Независимо от возраста пациента, наличия коморбидных заболеваний и типа аритмии следует рассматривать возможность своевременного применения катетерной аблации как метода выбора долгосрочного прогноза у пациентов с ХСН. Безусловно, требуются дальнейшие клинические исследования для всестороннего изучения преимуществ катетерной аблации при лечении пациентов с ТИКМП и/или ХСН со сниженной ФВ ЛЖ, ведь выбор терапии (медикаментозной и/или хирургической) зависит как от вида тахиаритмии, сопутствующих заболеваний, так и от предпочтений пациента. После восстановления систолической функции ЛЖ необходим постоянный мониторинг, особенно если аномальный субстрат миокарда сохраняется. Амбулаторное проведение ХМ ЭКГ играет ключевую роль в скрининге и адекватной диагностике ТИКМП. Точная своевременная диагностика и лечение ТИКМП у пациентов с ХСН и сниженной ФВ ЛЖ способны повысить качество жизни, улучшить клинические результаты, а также сократить период госпитализации, ее частоту и общие расходы на здравоохранение. Во втором клиническом случае продемонстрировано, что возобновление систолической функции ЛЖ путем устранения ТП с помощью оптимальной медикаментозной терапии и РЧА не только подтверждает диагноз ТИКМП, но и значительно улучшает долгосрочные результаты лечения.
Заключение
Тахииндуцированная кардиомиопатия – обратимая кардиомиопатия, характеризующаяся значительным разнообразием клинических проявлений – от бессимптомных до тяжелых симптомов ХСН. Клиницисты должны уделять должное внимание своевременной диагностике ТИКМП, особенно если речь идет о пациентах с тахисистолическими аритмиями, в частности ТП.
Персонифицированная стратегия лечения полиморбидных пациентов с наджелудочковыми тахиаритмиями и СНнФВ ЛЖ предполагает на первом этапе оптимизированную медикаментозную терапию, так называемую квадротерапию, на втором – своевременное выполнение хирургического лечения ТП с помощью РЧА. В совокупности такой комплексный подход к лечению пациентов с ТИКМП обеспечивает уменьшение клинических симптомов прогрессирования ХСН и снижение уровня сердечных биомаркеров, оптимизирует модуляцию сердечной сократимости на фоне улучшения систолической функции ЛЖ, а также способствует повышению качества жизни пациентов и замедлению прогрессирования сопутствующих нозологий, определяя долгосрочный прогноз.
Авторы заявляют об отсутствии потенциального конфликта интересов.
I.G. Polozkova, N.B. Korchazhkina, M.S. Rybachenko, A.A. Mikhailova, Ye.P. Yevseev, Yu.V. Frolova
B.V. Petrovsky Russian Research Centre of Surgery
L.A. Vorokhobov City Clinical Hospital № 67
Contact person: Irina G. Polozkova, dr.irinapolozkova@gmail.com
The purpose of this article is to describe two clinical cases of the development of tachycardia-induced cardiomyopathy (TICMP) against the background of long-standing atrial fibrillation (AF) and the absence of initially optimal medical therapy (OMT). It is known that TICMP has a ‘reversibility’ after adequate comprehensive AF treatment, including radiofrequency ablation. In the first case, the role of timely diagnosis of tachycardia-induced cardiomyopathy and OMT initiation in determining the management strategy for a polymorbid patient with heart failure with reduced left ventricular ejection fraction, intracardiac thrombosis is evaluated. In the second case, the result of successful catheter treatment of AF in a patient with TICMP with subsequent improvement in left ventricular myocardial systolic function and quality of life is considered. It should be noted that in both presented cases, the clinical manifestation of chronic heart failure decompensation leading to the formation of TICMP occurred 2 years after the onset of AF. The choice of TICMP treatment tactics and its timeliness are limited by the severity of structural myocardial pathology and the presence of severe concomitant diseases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.