XVI Российский онкологический конгресс: Внутривенное железо в онкологии: эволюция терапии
- Аннотация
- Статья
- Ссылки







Патогенез анемии, которая определяется как снижение уровня гемоглобина < 12 г/дл, при опухолевых заболеваниях многообразен. Она может развиться как самостоятельно, в результате онкологического процесса, так и под воздействием лучевой или химиотерапии. Согласно данным H. Ludwig и соавт.1, обобщивших результаты крупнейшего исследования ECAS (European Cancer Anemia Survey – Европейское исследование анемии при раке), анемия диагностируется у 53% пациентов с лимфомой/миеломой и лейкемией и у 25% пациентов с раком головы и шеи. Частота анемии находится в прямой зависимости от локализации, распространенности процесса и от проводимого лечения. Железодефицитная анемия отмечается у 40% онкологических больных, не получающих противоракового лечения. Однако химиотерапия увеличивает количество больных с анемией уже до 75%. Как отметил профессор Мэтти ААПРО (Matti S. Aapro, директор Многопрофильного института онкологии, Клиника Женолье, Швейцария), эритропоэз у онкологических больных, получающих химиотерапию, существенно снижен. «Конечно, лечение не может не влиять на ситуацию с эритропоэзом. Общий воспалительный процесс ведет к снижению возможности усваивать и использовать железо, и по этой причине мы должны рассматривать вопрос введения препаратов железа вместе или даже вместо эритропоэз-стимулирующих агентов», – пояснил он.
Будучи даже умеренной, анемия значительно снижает качество жизни онкологических больных. Основной симптом анемии – слабость – приводит к снижению толерантности к умственной и физической нагрузке. Именно повышенная утомляемость является одной из причин отказа пациентов от лечения. Между тем, как было показано в исследовании J. Crawford и соавт. (2002)2, изучавших связь между уровнем гемоглобина и качеством жизни пациентов, получавших химиотерапию, повышение содержания гемоглобина крови до 12–13 г/дл приводит к значительному улучшению качества жизни и выживаемости онкологических больных, по сравнению с пациентами, у которых уровень гемоглобина (Hb) составил 10–11 г/дл и ниже. В ряде исследований было также показано, что у онкологических больных может варьировать степень дефицита железа. Согласно данным исследования, в котором приняли участие 1052 больных раком поджелудочной железы, у 46% пациентов выявлялось железодефицитное состояние, у 33% – анемия3. Известно, что 1/3 случаев анемии у взрослых обусловлена недостаточным питанием, дефицитом витаминов (фолиевой кислоты, витамина B12), как, например, у больных раком легких. Безусловно, прежде чем приступить к лечению анемии, необходимо исключить нарушения нутритивного статуса у пациентов.
Профессор М. Аапро акцентировал внимание участников симпозиума на необходимости определения статуса дефицита железа у больных злокачественными образованиями для выбора оптимальной тактики лечения. При абсолютном дефиците железа отмечается истощение запасов железа и низкий уровень ферритина (< 100 мкг/л), при функциональном дефиците железа – нормальный или даже повышенный уровень ферритина (> 100 мкг/л). Дефицит железа определяется по степени насыщения трансферрина железом. «Иными словами, мы говорим о ключевом факторе, а именно – об уровне насыщения трансферрина железом, который у больных абсолютным или функциональным дефицитом железа составляет менее 20%», – уточнил он. Патогенетическим методом коррекции анемии является введение эритропоэтина. Применение внутривенных препаратов железа в комбинации с эритропоэтинами существенно влияет на эффективность терапии эритропоэтинами. Это подтверждают результаты 7 рандомизированных клинических исследований, в которых продемонстрировано, что внутривенное введение железа позволяло увеличить частоту ответа на лечение эритропоэтинами с 25–73% до 68–87%4–10.
«Почему мы говорим о необходимости использования эритропоэтинов, хотя, казалось бы, есть простой и привычный способ коррекции анемии с помощью гемотрансфузии? Потому что, как показывают данные исследования датских ученых DAHANCA (Danish Head and Neck Cancer Group – Датская рабочая группа по раку головы и шеи)11, гемотрансфузии не только не привели к повышению уровня гемоглобина и улучшению прогноза для пациентов с онкологическими заболеваниями головы и шеи, получавших лучевую терапию, но и отрицательно сказались на показателях выживаемости», – констатировал профессор М. Аапро. Результаты многочисленных исследований нашли отражение в документах Европейского общества медицинской онкологии (European Society for Medical Oncology, ESMO 2010), в которых рекомендации по применению эритропоэтинов у онкологических больных с анемией основываются, в частности, на необходимости сокращения потребности в гемотрансфузиях. В 2012 г. подготовлен обновленный вариант рекомендаций. «По существу, в Европе уже действуют актуализированные рекомендации ESMO. Нам известно, что подобные стандарты лечения проходят актуализацию и в России. Мы полагаем, что эти руководства будут изданы в одно и то же время, и специалисты смогут иметь фактически параллельные нормативные базы, основывающиеся на соответствующих клинических исследованиях, как в Европе, так и в России», – подчеркнул профессор М. Аапро, завершая выступление.
Дифференциальная диагностика и патогенетическое обоснование терапии нарушений обмена железа в онкологической практике
Доктор медицинских наук, профессор Валерий Григорьевич ДЕМИХОВ (ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева», Рязанский филиал) отметил, что значимость проблемы дефицита железа в России, как и в Европе, остается недооцененной. Профессор В.Г. Демихов обратил внимание слушателей на нерациональность широкого применения в современной практической онкологии пероральных препаратов железа и рассмотрел способы повышения эффективности сопроводительной терапии в плане коррекции анемии у больных с онкологическими заболеваниями. Согласно современному пониманию механизмов регуляции эритропоэза, физиологическое функционирование эритрона обеспечивается нормальной почечной продукцией эритропоэтина, функционирующим эритроидным костным мозгом и адекватным снабжением эритроидных предшественников субстратами, прежде всего железом.
Дефект какого-либо из этих ключевых компонентов механизма может привести к анемии. К основным причинам ее развития относятся железодефицитные синдромы, которые приводят к железодефицитному эритропоэзу, неадекватно низкая степени анемии продукция эритропоэтина, гипопролиферативный эритропоэз, угнетение костномозгового кроветворения, которое наиболее характерно для онкогинекологических заболеваний. В совокупности именно эти патогенетические механизмы и приводят к анемии. «Исходя из этих механизмов, возникают основные терапевтические опции, которые используются для лечения анемии при онкологических заболеваниях. Их всего пять: это препараты железа, вводимые внутривенно, препараты железа, вводимые перорально, эритропоэз-стимулирующие агенты, комбинация “препараты железа + эритропоэз-стимулирующие агенты” и гемотрансфузия. Два из пяти не относятся к методам выбора: использовать пероральные препараты железа из-за их малой эффективности и побочных эффектов нерационально, а вред гемотрансфузии был уже показан в выступлении профессора М. Аапро», – констатировал профессор В.Г. Демихов.
В качестве примера докладчик привел данные недавнего исследования L.T. Goodnough (2012)12, в ходе которого сравнивалось пероральное и внутривенное применение препарата железа у пациентов с хроническим заболеванием почек. Результаты исследования продемонстрировали более высокую эффективность внутривенной ферротерапии, по сравнению с пероральной (величина повышения уровня Hb при внутривенном введении препарата железа была в 6 раз выше, чем при пероральном), а максимальное повышение уровня Hb было достигнуто при комбинированном использовании внутривенной ферротерапии и рекомбинантного человеческого эритропоэтина. По мнению докладчика, основные причины незначительной эффективности пероральной ферротерапии заключаются в низкой всасываемости препаратов железа в кишечнике, большом количестве побочных эффектов со стороны желудочно-кишечного тракта и низкой приверженности пациентов к данному виду терапии.
В настоящее время железодефицитные синдромы принято подразделять на три большие группы: абсолютный дефицит железа, который у онкологических пациентов чаще всего связан с хронической или острой кровопотерей; функциональный дефицит железа, который, прежде всего, связан с усилением эритропоэза – либо на фоне применения рекомбинантного человеческого эритропоэтина, либо на фоне значительного усиления эритропоэтической активности костного мозга; синдром, обусловленный депонированием железа в клетках моноцитарно-макрофагальной системы, связанный с различными воспалительными процессами. Наличие у пациента одного или комбинации из двух-трех железодефицитных синдромов приводит к развитию железодефицитного эритропоэза и анемии. Для такого состояния, как абсолютный дефицит железа, характерны истощение или полное отсутствие запасов железа и низкий уровень ферритина, а для функционального дефицита железа – недостаточное поступление железа в костный мозг, низкая степень насыщения трансферрина железом.
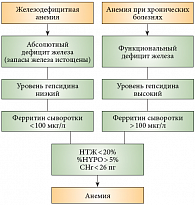
В целом, как заметил профессор В.Г. Демихов, последние 15 лет, по образному выражению ряда авторов, считаются «золотым веком в биологии железа». В это время было открыто большое количество пептидов, которые позволили значительно лучше понять патогенез нарушений метаболизма железа при различных воспалительных заболеваниях, а самым главным из них стало открытие печеночного пептида – гепсидина, который в настоящее время расценивается как основной регулятор метаболизма железа и является ключевым моментом в развитии анемии воспаления. Гепсидин, циркулирующий в плазме и выделяющийся почками, является негативным регулятором поступления железа из клеток. Гепсидин снижает функциональную активность ферропортина, связываясь с ним и вызывая его деградацию. В энтероците воздействие гепсидина приводит к уменьшению транспорта железа через базолатеральную мембрану и снижению всасывания железа, а в макрофагах и гепатоцитах – к снижению экспорта железа из клетки и, следовательно, к повышению его внутриклеточной концентрации13. Основными маркерами железа, которые используются в современной клинической практике, являются ферритин, насыщение трансферрина железом (НТЖ), сывороточный трансферриновый рецептор (сТФР), эритроцитарные индексы (HYPO, CHr) и гепсидин. Уровни всех этих маркеров, за исключением сывороточного трансферринового рецептора, должны применяться для дифференциальной диагностики абсолютного и функционального дефицита железа у пациентов со злокачественными новообразованиями (рис. 1).
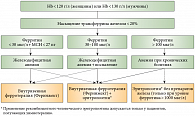
Однако, по словам профессора В.Г. Демихова, возможности лабораторной диагностики с определением данных параметров в России ничтожно малы, поэтому приходится использовать лишь два из них – НТЖ и ферритин сыворотки. На примере нескольких клинических случаев профессор В.Г. Демихов продемонстрировал возможности дифференциальной диагностики функционального и абсолютного дефицита железа у онкологических пациентов. Представляя участникам симпозиума упрощенный лечебно-диагностический алгоритм при анемиях, профессор В.Г. Демихов отметил, что использование этого алгоритма позволяет рационально подходить к назначению внутривенной ферротерапии в лечении больных с онкологическими заболеваниями (рис. 2). «Необходимым и достаточным условием применения внутривенной ферротерапии является дефицит железа, который мы определяем по степени насыщения трансферрина железом. В случае если насыщение трансферрина менее 20%, дополнительное определение ферритина помогает четко диагностировать у онкологических больных наличие абсолютного или функционального дефицита железа. При наличии абсолютного дефицита железа мы имеем право использовать внутривенную ферротерапию как монотерапию у пациента с конкретной анемией. При функциональном дефиците железа, когда ферритин составляет более 100 мкг/л, наиболее удачной комбинацией будет сочетание внутривенной ферротерапии с эритропоэз-стимулирующими агентами», – пояснил докладчик. В заключение профессор В.Г. Демихов подчеркнул, что на сегодняшний день комбинированное применение внутривенных препаратов железа и рекомбинантного человеческого эритропоэтина является наиболее рациональной тактикой коррекции анемии у пациентов с онкологическими заболеваниями, однако применение рекомбинантного человеческого эритропоэтина должно проводиться под строгим контролем и только у тех пациентов, которые получают химиотерапию.
Внутривенные препараты железа: эффективность и безопасность
Заведующий отделением гематологии и онкологии подростков и взрослых ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева», д.м.н., профессор Вадим Вадимович ПТУШКИН сказал, что однозначно утверждать, будто пероральная форма препаратов железа плохая, а внутривенная хорошая, нельзя. Для того чтобы в конечном итоге определить, какие из вариантов назначения железа у онкологических больных имеют преимущества, а какие – слабые стороны, докладчик напомнил участникам симпозиума основные сведения о всасывании, транспорте и хранении железа в организме в норме и о тех трансформациях трехвалентного железа в двухвалентное и обратно, с которыми сталкивается атом железа в процессе перехода из пищевой формы в эритроцит14. Как известно, наиболее распространенной пищевой формой является трехвалентное железо. Чтобы проникнуть внутрь клетки, оно должно с помощью специального фермента ферропортина перейти в двухвалентную форму. Атомы железа реактогенны, но белковая форма (апоферрин) может «упаковать» железо. Прежде чем железо попадет в костный мозг, оно вновь должно поменять валентность, поскольку транспортный белок (трансферрин) способен переносить железо только в трехвалентной форме. Белок трансферрин может перенести железо в костный мозг, а может – в депо, где оно хранится в виде ферритина. Когда железо проникает внутрь клетки, оно опять должно поменять свою валентность, после чего может быть утилизировано и использовано для синтеза вполне конкретных белков. Если в силу каких-либо причин железа становится больше того количества, что может связать трансферрин, образуется плохо растворимая форма под названием «гемосидерин». Для мобилизации и растворения железа из гемосидерина требуется определенное время, в результате уменьшается количество поступающего в костный мозг железа, что приводит к развитию его функционального дефицита. «Таким образом, у нас есть обмен железа и у нас есть ситуации, связанные с его дефицитным состоянием. В этом случае мы можем попытаться усилить проникновение железа в организм путем назначения пероральных или внутривенных препаратов железа. В чем различие? При пероральном приеме в организм поступает двухвалентное железо, при внутривенном – трехвалентное», – пояснил докладчик.
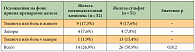
Пероральные препараты железа сопоставимы по эффективности и должны назначаться с учетом переносимости. «Железа сульфат, например, весьма эффективно восстанавливает необходимое количество железа, но отличается высокой частотой желудочно-кишечных осложнений, осложнения возникают даже на фоне приема более современного полимальтозата железа», – отметил профессор В.В. Птушкин (табл. 1)15. Инкапсулированные формы пероральных препаратов характеризуются меньшим количеством осложнений, но имеют сниженную эффективность. При пероральном применении препаратов железа осложнения могут проявляться как в виде тошноты, вздутия живота, запора или поноса, так и в виде некротизирующего гастроэнтерита, желудочно-кишечных кровотечений, отложения железа в сердце, печени, поджелудочной железе, метаболического ацидоза вплоть до комы, смерти от сердечной недостаточности. Еще одна важная проблема, связанная с применением пероральных препаратов, – как показывает опыт, далеко не все онкологические больные способны ежедневно и на протяжении нескольких лет принимать пероральные препараты железа, которые, к тому же, сопровождаются перечисленными выше побочными действиями. Приверженность к длительной терапии такими препаратами у пациентов невелика. Согласно данным ряда исследований, случаи запора, тошноты и диареи у пациентов при пероральном приеме препаратов железа встречаются в несколько раз чаще, чем при внутривенном применении. Низкая абсорбция, побочные действия со стороны желудочно-кишечного тракта и низкая приверженность к лечению являются причинами, ограничивающими использование пероральной ферротерапии16, 17.
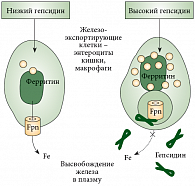
Гепсидин – полипептид, открытый около 10 лет назад, – является главным регулятором, препятствующим поступлению железа из клеток. Он снижает содержание железа в плазме 2 путями: блокирует железо в макрофагах и снижает всасывание железа из кишечника энтероцитами. Ферропортин также является рецептором к гепсидину. Связывание гепсидина с ферропортином на клеточной мембране приводит к интернализации комплекса «гепсидин – ферропортин», препятствуя клеточному экспорту железа (рис. 3). При этом, по словам докладчика, «дверь оказывается закрытой», и единственный путь – это непосредственное насыщение трансферрина, то есть внутривенное введение препаратов железа. Однако применение внутривенных препаратов железа тоже может быть сопряжено с побочными эффектами. Согласно пятилетнему отчету FDA об аллергических реакциях, связанных с применением препаратов железа (январь 1997 – сентябрь 2002), наибольшее число опасных для жизни побочных действий отмечалось при приеме декстрана железа, значительно меньшим числом побочных действий характеризовалось использование глюконата железа и самым низким – сахарата железа18. Согласно Британским рекомендациям за 2011 г., для лечения железодефицитной анемии используются три группы внутривенных препаратов железа: декстран железа, сахарат железа и карбоксимальтозат железа (табл. 2).
«Сразу же обращает на себя внимание разница во времени внутривенного капельного введения каждого препарата. Стабильный комплекс декстран железа, в силу того что он может вызвать аллергическую реакцию, вводят внутривенно капельно в течение 6 часов. Его аллергенность связана с тем, что в этом комплексе железо окружено декстраном, который и вызывает реакцию гиперчувствительности. Сахарозу в дозе 200 мг мы можем ввести внутривенно капельно в течение 10 минут, однако доза является недостаточной, поэтому либо мы ее вводим повторно, либо сразу назначаем высокую дозу, которую капельно вводим в течение 4 часов. Введение карбоксимальтозата железа возможно в дозе до 1000 мг железа в виде разовой быстрой инфузии в течение 15 минут или болюсной инъекции в дозе до 200 мг железа практически в течение нескольких минут», – пояснил профессор В.В. Птушкин. Чем более лабильно железо, тем большее количество перекисных соединений оно способно образовать, поэтому нужна структура, которая бы уберегала ядро железа от реакции с водой, кислородом, и близкая к этому структура уже создана. Стабильный комплекс железа – железа карбоксимальтозат (Феринжект) – устойчив к неприятностям, связанным с перекисным соединением, что объясняется характером производства этой микрочастицы, содержащей несколько тысяч атомов железа. Они плотно упакованы, и эта упаковка в новой комплектации не вызывает гиперчувствительности. «Безопасность препарата только начинает подтверждаться, пока никаких негативных сигналов о высокой частоте реакций гиперчувствительности не поступало (табл. 3). На сегодняшний день мы имеем структуру, при которой токсические эффекты лабильного железа минимальны, поскольку комплекс стабильный. При этом число аллергических реакций тоже минимально, потому что оболочка сделана так, что она не вызывает реакций гиперчувствительности», – констатировал профессор В.В. Птушкин. Хотя окончательное подтверждение эффективности внутривенного применения железа как в комбинации с эритропоэтинами, так и в монотерапии – дело ближайшего времени, уже сейчас можно утверждать:
- препараты железа позволяют быстро и эффективно восполнить сниженные запасы железа и повысить уровень гемоглобина;
- переносимость препаратов железа для перорального приема не идеальна, а эффективность в условиях активации иммунной системы недостаточна;
- препараты железа для внутривенного введения высокоэффективны, в том числе в условиях анемии хронического заболевания, но большинство из них либо неудобны для введения (сахарат железа), либо небезопасны (железа декстран).
Международные рекомендации по применению рекомбинантных форм эритропоэтина и внутривенных препаратов железа в онкологии
По данным, представленным в докладе доцента кафедры онкологии с курсами по онкологии и патологической анатомии ИПО Башкирского государственного медицинского университета, заведующей отделением паллиативной помощи РКОД, главного внештатного онколога г. Уфы, к.м.н. Любови Николаевны КУДРЯШОВОЙ, анемия, ассоциированная с химиолучевым лечением, встречается в 54% случаев, при этом анемия слабой степени – в 39% случаев, анемия средней степени – в 14%, анемия тяжелой степени – в 1% случаев. По данным Европейского исследования раковой анемии ECAS (European Cancer Anemia Survey), анемия имела место у 39% онкологических больных1. Если на момент постановки диагноза у больных не было анемии, то с высокой вероятностью (62%) она развивалась в процессе лечения, а при проведении химиотерапии – в 88% случаев. Выделяют 4 степени анемии, причем 4-я степень, когда уровень гемоглобина составляет менее 6,5 г/дл, является угрожающей для жизни пациента. Анемия отрицательно сказывается на всех органах и системах. Доказано, что риск смерти у больных анемией в целом на 65% выше, чем у больных без анемии, при этом различие зависело от локализации опухоли и колебалось от 19% при раке легкого до 75% у больных с опухолями головы и шеи19. Гипоксия влияет на биологию опухоли. Клетка, находящаяся в состоянии кислородного голодания, с одной стороны, меняет пути метаболизма, а с другой стороны, включает компенсаторные механизмы, такие как активация генов семейства HIF (hypoxia inducible factor – факторы, индуцируемые гипоксией)-1, что способствует увеличению выработки сосудистого эндотелиального фактора роста (vascular endothelial growth factor, VEGF). VEGF отвечает за образование новых сосудов в опухоли, способствуя ее росту и метастазированию. Клетка, находящаяся в состоянии глубокой гипоксии, отличается увеличением частоты спонтанных мутаций и поломкой гена p53, определяющего апоптоз. Подавление апоптоза уменьшает чувствительность опухоли к цитостатической и лучевой терапии.
Рациональное лечение анемии необходимо, и оно может влиять как на эффективность лечения, так и на качество и продолжительность жизни пациента. Основными вариантами лечения анемии, индуцированной химиотерапией, являются переливание крови, терапия эритропоэтинами без препаратов железа, с пероральными препаратами железа и с внутривенными препаратами железа. Переливание крови обеспечивает быструю коррекцию анемии, но связано с целым рядом рисков, в первую очередь с реакцией на трансфузию. При исследовании 366 нежелательных реакций, связанных с переливанием крови, было установлено, что в 52% случаев осложнения были связаны с переливанием недоброкачественных компонентов крови, в 15% имела место острая трансфузионная реакция, в 14% случаев – отсроченная трансфузионная реакция. Гемотрансфузии также несут серьезную опасность риска передачи вирусов гепатита и ВИЧ-инфекции. Существенным недостатком такой коррекции гемоглобина является кратковременность эффекта. До 1987 г. трансфузии оставались наиболее распространенным методом коррекции анемии. Новый этап в лечении анемии у онкологических больных начался с появлением эритропоэтинов. Эритропоэтины впервые были использованы у больных с терминальными заболеваниями почек и дали хорошие результаты. Это послужило толчком для исследования их эффективности у больных, получающих цитостатики. Анализ данных многочисленных контролируемых исследований показал, что применение эритропоэтинов у онкологических больных с анемией, индуцированной химиотерапией, способно повышать показатели гемоглобина, улучшать качество жизни и сокращать потребность в гемотрансфузии (Agency for Healthcare Research and Quality, 2006). Однако дальнейшие исследования продемонстрировали, что при этом могут развиваться нежелательные эффекты в виде тромбоэмболических осложнений, а также возможно уменьшение общей выживаемости у больных, получающих эритропоэтины20. В метаанализе H. Ludwig и соавт., включившем около 60 исследований, было показано, что наиболее часто осложнения развивались у тех онкологических больных, у которых уровень гемоглобина превышал 12 г/дл, а лечение продолжалось даже в отсутствие ответа на терапию эритропоэтинами, при этом проводились гемотрансфузии1.
Эти данные нашли отражение в рекомендациях по лечению анемии при злокачественных опухолях. Они сводятся к следующему: если при назначении эритропоэз-стимулирующих агентов за 4 недели лечения происходит повышение уровня гемоглобина менее 1 г/дл, то доза вводимых препаратов должна быть увеличена, но при терапии эритропоэтином-альфа увеличение дозы не рекомендуется. Если уровень гемоглобина увеличился на 1 г/дл, дозу эритропоэз-стимулирующих агентов необходимо снизить на 25–50% или оставить прежней. В случае если уровень гемоглобина достиг 12 г/дл, дозу препарата необходимо снизить на 25–50%. При уровне гемоглобина 13 г/дл лечение эритропоэтинами необходимо приостановить, пока уровень Hb не снизится до 12 г/дл, после чего лечение необходимо возобновить, но при этом редуцировать первоначальную дозу на 25%. Если терапия эритропоэтинами была эффективной, необходимо повторить курс лечения в течение еще 4 недель после окончания химиотерапии. Лечение эритропоэз-стимулирующими агентами считается неэффективным в том случае, если в течение 8–9 недель терапии увеличение гемоглобина было менее 1 г/дл. Учитывая, что 30–50% больных не дают ответа на лечение эритропоэтинами, в руководстве Европейской организации по изучению и лечению рака (European Organization for Research and Treatment of Cancer, EORTC) указано, что перед назначением эритропоэтина необходимо устранить железодефицитную анемию21. То же можно найти и в рекомендациях Американского общества клинических онкологов (American Society of Clinical Oncology, ASCO) и ESMO.
В руководстве Национальной онкологической сети 2010 (National Comprehensive Cancer Network, NCCN 2010) указано, что пероральные препараты железа распространены больше, чем внутривенные препараты железа, но они менее эффективны. Клинические исследования по применению рекомбинантных форм эритропоэтина в комбинации с внутривенными препаратами железа4, 6–8 показали, что на фоне применения данной комбинации ответ на терапию в 1,5–2 раза выше, по сравнению с монотерапией эритропоэтинами или с пероральным приемом препаратов железа. Основываясь на данных клинических испытаний, в руководство NCCN в 2010 г. были внесены изменения. Новый алгоритм применения эритропоэтинов для лечения анемии, индуцированной химиотерапией, предполагает назначение гемотрансфузии только в случае необходимости в немедленной коррекции анемии. Эритропоэтины не показаны при терапии, направленной на излечение, их назначают только с паллиативной целью при уровне Hb < 10 г/дл. При абсолютном дефиците железа сначала необходимо устранить дефицит железа методом назначения препаратов железа внутривенно или перорально, при функциональном дефиците железа необходимо назначать комбинированное лечение эритропоэтинами с внутривенными препаратами железа. Комбинированное использование эритропоэтинов с внутривенными препаратами железа позволяет достичь 90%-ного уровня ответа на терапию, быстрого повышения уровня Hb, снижения потребности в трансфузии и улучшения качества жизни4–8, 22, 23. В заключение Л.Н. Кудряшова кратко сформулировала выводы и обозначила основные международные рекомендации по применению рекомбинантных форм эритропоэтинов и внутривенных препаратов железа в онкологии (ESMO 2010; NCCN 2012):
- эритропоэз-стимулирующие агенты (ЭСА) могут применяться только у больных с анемией, являющейся осложнением химиотерапии, при уровне Hb < 10 г/дл. Целью лечения является предотвращение гемотрансфузий и возможных осложнений, улучшение качества жизни путем повышения уровня гемоглобина;
- больным, получающим химиотерапию, уровень Hb которых составляет 10–12 г/дл, ЭСА могут быть назначены при наличии симптомов анемии или для предупреждения дальнейшего снижения концентрации Hb;
- больным, не получающим химиотерапию, ЭСА не показаны;
- алгоритм назначения ЭСА проводится согласно рекомендациям Европейского и Американского обществ клинической онкологии;
- пациентам с потенциально излечимыми опухолями следует избегать применения ЭСА (NCCN 2012);
- пациентам с потенциально излечимыми опухолями следует применять ЭСА с осторожностью (ESMO 2012);
- перед проведением терапии препаратом, стимулирующим эритропоэз, необходимо устранить дефицит железа в организме;
- у больных с анемией и дефицитом железа внутривенное введение железа приводит к более выраженному повышению уровня Hb, чем в отсутствие препаратов железа или при назначении железа перорально.
Разбор клинического случая
Старший научный сотрудник отделения изучения новых противоопухолевых лекарств РОНЦ им. Н.Н. Блохина, к.м.н. Антон Владимирович СНЕГОВОЙ предложил участникам симпозиума рассмотреть клинический случай, связанный с лечением пациентки 49 лет с плоскоклеточным ороговевшим раком нижнегрудного отдела пищевода и дисфагией 3-й степени. Пациентка на начальном этапе проконсультирована хирургами, которые сделали вывод о том, что оперативное лечение на данный момент больной не показано, а рекомендовано проведение попытки химиотерапии. Первичный осмотр больной в клинике был выполнен 26 марта 2012 г. Пациентке была рекомендована следующая схема лекарственной терапии: паклитаксел 270 мг в/в капельно 1 день с интервалом в 21 день, цисплатин 120 мг в/в капельно 1 день с интервалом в 21 день и капецитабин 3 г/сут внутрь с 1-го по 14-й день с интервалом в 7 дней. Результаты анализа крови больной: уровень гемоглобина – 5,8 г/дл, уровень MCV – 60 fl, уровень растворимых рецепторов трансферрина – 9,8 мкмоль/л, уровень ферритина – 145 мкг/л, морфология эритроцитов была представлена микроцитами и гипохромией. Докладчик спросил аудиторию, следует ли данной пациентке назначить дообследование, чтобы уточнить уровень НТЖ, гепсидина, или в нем нет необходимости. 30% присутствующих проголосовали за дообследование, лишь 10% участников разбора ответили на вопрос отрицательно. С последними согласился и сам докладчик, который заметил, что имеющихся данных вполне достаточно, чтобы поставить пациентке диагноз «железодефицитная анемия», поэтому нет необходимости в ее дообследовании.
Для того чтобы узнать, какими, по мнению участников симпозиума, должны быть дальнейшие действия врача, А.В. Снеговой предложил выбрать аудитории один из пяти вариантов ответа: ничего не делаем; переливаем кровь; переливаем кровь и назначаем эритропоэтины; вводим препараты железа и переливаем кровь, после чего повторяем анализ крови; переливаем кровь и повторяем анализ крови. Результаты голосования продемонстрировали, что наиболее эффективную тактику лечения выбрали 25% участников «мозгового штурма», которые назначили бы пациентке введение препаратов железа с последующей трансфузией и повторным анализом крови. Назначение трансфузии объяснялось угрожающе низким уровнем гемоглобина у больной (5,8 г/дл) и необходимостью его быстрой коррекции. Что выполнено? 26 марта больной внутривенно ввели Феринжект в дозе 400 мг, 27 марта было выполнено переливание 3 доз эритромассы. Возникает вопрос: при каком уровне гемоглобина, начиная с 7 г/дл и заканчивая более 11 г/дл, можно назначать пациентке химиотерапию? Большинство участников дискуссии для проведения пациентке курса химиотерапии выбрали показатель Hb = 10 г/дл. «Понятно, что чем выше уровень гемоглобина, тем более безопасной будет химиотерапия. После проведенной тактики, когда пациентке ввели Феринжект и перелили три дозы эритромассы, мы получили увеличение уровня гемоглобина до 9,8 г/дл, прирост уровня MCV, снижение показателя растворимых рецепторов трансферрина, увеличение уровня ферритина, сохранение морфологии эритроцитов в виде микроцитов и гипохромии. Спустя два дня, 30 марта, пациентке было начато лечение паклитакселом, цисплатином и капецитабином», – констатировал А.В. Снеговой.
Согласно данным исследования I. Repetto, проведенного в 2009 г. с участием 1175 онкологических больных, анемия является неблагоприятным фактором по откладыванию курса и редукции дозы, поэтому, по мнению докладчика и большинства участников симпозиума, пациентке необходимо было поддерживать уровень гемоглобина с помощью внутривенной ферротерапии совместно с рекомбинантными эритропоэтинами. 2 апреля, спустя три дня после лечения паклитакселом и цисплатином, пациентке был введен Феринжект внутривенно капельно в дозе 1000 мг (но не более 15 мг на 1 кг массы тела), назначен рекомбинантный эритропоэтин, при этом она продолжала принимать капецитабин по 3 грамма в сутки. При контрольном обследовании, спустя 11 дней с момента лечения, уровень гемоглобина оставался стабильным (9,6 г/дл), увеличились показатели МCV (73,6 фл), снизились показатели растворимых рецепторов трансферрина (7,6 мкмоль/л), увеличился уровень ферритина (502,6 мкг/л), но сохранялась измененная морфология эритроцитов (микроциты и гипохромия). По результатам голосования, несмотря на стабильно высокий уровень гемоглобина у больной, значительная часть аудитории высказалась за необходимость продолжать поддерживать уровень Hb с помощью комбинированного применения внутривенного препарата железа и эритропоэтина, что, по словам А.В. Снегового, и было реализовано на практике. Пациентке повторно был введен Феринжект в дозе 1 грамм внутривенно капельно с учетом формулы кумулятивного дефицита и рекомендовано продолжить подкожное введение рекомбинантных эритропоэтинов в течение 14 дней. При контрольном обследовании, спустя 25 дней с момента начала лечения, уровень гемоглобина у пациентки прогрессивно увеличился и на момент интервала между курсом химиотерапии составил 12,4 г/дл, повысился уровень MCV (78,8 fl), снизились показатели растворимых рецепторов трансферрина (2,7 мкмоль/л) и ферритина (111, 6 мкг/л), сохранялась морфология эритроцитов в виде микроцитов и гипохромии. Таким образом, благодаря активному лечению с применением комбинации внутривенного препарата железа Феринжекта и рекомбинантного эритропоэтина удалось не только сохранить уровень гемоглобина пациентки стабильным, но и повысить его до 12,4 г/дл.
Заключение
Подводя итоги симпозиума, профессор Мэтти Аапро отметил большое значение затронутых в ходе его работы проблем, касающихся лечения анемии у онкологических больных. Основной метод лечения – устранение абсолютного или функционального дефицита железа. Согласно обновленным Европейским рекомендациям, для коррекции абсолютного дефицита железа предпочтительно использовать монотерапию внутривенными формами железа, для коррекции функционального дефицита железа у пациентов, получающих химиотерапию, применение эритропоэтинов следует сочетать с введением внутривенных препаратов железа. По словам профессора Мэтти Аапро, актуализированные европейские руководящие принципы предусматривают сокращение использования метода трансфузии. Он высказал уверенность в том, что данный алгоритм лечения онкологических больных с анемией также найдет отражение в актуализированных российских рекомендациях.
