количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Выявление сахарного диабета на ранних стадиях
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №6
- Аннотация
- Статья
- Ссылки
В статье поднимается проблема раннего выявления сахарного диабета (СД) 2 типа, обосновывается необходимость внедрения в повседневную практику современных эффективных скрининговых программ.
Детально рассматриваются факторы риска развития СД, обсуждаются диагностические критерии и выбор диагностического оборудования для выявления ранних нарушений углеводного обмена и СД 2 типа.
В статье поднимается проблема раннего выявления сахарного диабета (СД) 2 типа, обосновывается необходимость внедрения в повседневную практику современных эффективных скрининговых программ.
Детально рассматриваются факторы риска развития СД, обсуждаются диагностические критерии и выбор диагностического оборудования для выявления ранних нарушений углеводного обмена и СД 2 типа.
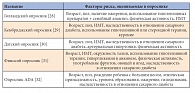
Таблица. Опросники для выявления групп риска развития сахарного диабета 2 типа

Анализатор для определения гликозилированного гемоглобина в крови HemoCue НbA1c 501
В настоящее время в мире наблюдается неуклонный рост распространенности сахарного диабета (СД). По данным Международной диабетической федерации (International Diabetes Federation, IDF), в 2012 г. СД страдают 371 млн человек, а к 2030 г., по оценкам экспертов IDF, их число возрастет до 552 млн [1]. Рост распространенности заболевания происходит в основном за счет СД 2 типа, на который приходится 85–95% всех случаев заболевания. При этом у 50% СД протекает скрыто. Самый высокий процент невыявленного СД отмечен в странах Центральной и Южной Африки (81,2% от общего числа заболевших), за ними следуют страны Ближнего Востока и Северной Африки (52,9%). В Европе на долю скрыто протекающего СД приходится до 38,6% от общего числа больных сахарным диабетом.
По мнению экспертов IDF, Россия занимает пятое место в мире по числу больных СД после Китая, Индии, США и Бразилии. Эпидемиологические исследования, проведенные в ряде областей, в частности в Московской области, свидетельствуют о том, что распространенность скрыто протекающего СД достигает 7% [2]. В то же время, согласно официальной статистике (данные Государственного регистра больных сахарным диабетом), распространенность СД среди взрослого населения Российской Федерации составляет около 3%. Социальная значимость СД 2 типа связана не только с его растущей распространенностью, но и с высокой сердечно-сосудистой заболеваемостью и смертностью среди больных СД. Согласно прогнозам IDF, в 2012 г. около 4,8 млн человек в возрасте от 20 до 79 лет умрут от причин, прямо или косвенно связанных с СД, что составит 8,2% в общей структуре смертности населения этого возраста.
Отметим, что распространенность ранних нарушений углеводного обмена также продолжает прогрессивно увеличиваться [3]. Исследования последних лет подтвердили, что нарушенная толерантность к глюкозе (НТГ) и нарушенная гликемия натощак (НГН) не только увеличивают риск развития СД 2 типа, но и повышают риск сердечно-сосудистых заболеваний. Так, результаты метаанализа, в который были включены 18 исследований (175 152 участника), продемонстрировали: НГН (уровень глюкозы плазмы натощак (ГПН) 6,1–6,9 ммоль/л) и НТГ были ассоциированы с повышенным риском сердечно-сосудистых событий – относительный риск 1,20 (95% доверительный интервал (ДИ) 1,12–1,28) и 1,20 (95% ДИ 1,07–1,34) соответственно.
При этом достоверных гендерных различий в повышении риска отмечено не было. E. Selvin и соавт. в ходе исследования, включавшего 15-летний период наблюдения за 15 792 лицами среднего возраста из 4 регионов США, установили, что уже небольшое повышение уровня гликированного гемоглобина фракции А1с (HbA1c) (> 6%) приводит к повышению риска развития не только СД 2 типа, но и ишемической болезни сердца, инсульта и смерти [4]. При оценке корреляции между риском смерти и уровнем HbA1c была выявлена J-образная зависимость, то есть риск смерти повышался не только при увеличении HbA1c более 5,5%, но и при снижении этого показателя менее 5%. Ранние нарушения углеводного обмена также повышают риск развития ретинопатии. Так, риск этого осложнения достоверно возрастает у лиц с HbA1c > 5,5% [5].
В связи с вышесказанным обоснованной представляется необходимость смены парадигмы: переход от диагностики СД 2 типа, основанной на обращении к врачу при наличии симптомов заболевания, и назначения лечения больным, у которых уже выявлены поздние осложнения СД, к работе по активному выявлению лиц с ранними нарушениями углеводного обмена и проведению эффективных профилактических мероприятий для предотвращения возникновения заболевания. Учитывая то, что СД 2 типа часто имеет длительный бессимптомный период протекания, большое значение приобретает организация скрининга для выявления нарушений углеводного обмена. В 1968 г. J. Wilson и G. Jungner в отчете Всемирной организации здравоохранения (ВОЗ) предложили 10 критериев, определяющих целесообразность проведения скрининга [6]:
- Заболевание должно представлять важную медицинскую проблему.
- Для больных с установленным диагнозом должен быть разработан и утвержден метод лечения.
- Возможности диагностики и лечения заболевания должны быть доступны.
- У заболевания есть латентная стадия или стадия с ранними клиническими симптомами, которые можно выявить при скрининге.
- Для заболевания должен существовать соответствующий тест/метод исследования.
- Метод исследования должен быть приемлем для использования в популяции.
- Необходимо адекватно понимать естественное течение болезни.
- Должна существовать согласованная политика с выделением групп пациентов, которым необходимо назначать лечение.
- Экономические расходы на выявление случаев заболевания должны быть сбалансированы с общим объемом расходов на медицинскую помощь.
- Скрининг должен представлять собой непрерывный процесс, а не разовую акцию.
Очевидно, что СД 2 типа соответствует всем вышеперечисленным требованиям. Впоследствии M. Gray, член Национального скринингового комитета Великобритании (National Screening Committee, NSC), к этим десяти критериям добавил пункт об обязательном наличии результатов контролируемых рандомизированных исследований, подтверждающих то, что скрининговые программы приводят к снижению смертности от заболевания в популяции. Внедрение скрининговых программ позволяет выявить сахарный диабет и предиабет на ранних стадиях и своевременно назначить адекватное лечение и профилактические мероприятия, что снижает вероятность развития диабетических осложнений.
Существуют следующие виды скрининга: сплошной, селективный и оппортунистический. Сплошной скрининг применяется только в популяциях с очень высоким риском СД 2 типа (индейцы пима, проживающие в Аризоне, жители государства Науру (Тихоокеанский регион)). Селективные скрининги проводятся среди лиц, относящихся к группе риска развития СД 2 типа, после обследований населения на наличие факторов риска. Оппортунистические скрининги проводятся среди лиц, обратившихся в лечебное учреждение по поводу другого заболевания, и у которых при этом была выявлена принадлежность к группе риска развития СД 2 типа.
Скрининг и последующий учет лиц с ранними нарушениями углеводного обмена могут быть организованы на базе центров здоровья и кабинетов профилактики лечебно-профилактических учреждений. Важно, чтобы подобная работа имела не эпизодический характер, а проводилась на постоянной основе. Для проведения эффективного скрининга необходима организация работы по активному выявлению лиц, относящихся к группе риска развития СД 2 типа.
В настоящее время основные факторы риска развития СД 2 типа хорошо известны и подразделяются на модифицируемые и немодифицируемые. Одним из основных факторов риска СД 2 типа является возраст [7]. Во многом это связано с тем, что с возрастом идет накопление других факторов риска развития СД 2 типа [8]. Согласно рекомендациям Американской диабетической ассоциации (American Diabetes Association, ADA) по оказанию медицинской помощи больным сахарным диабетом, к группе риска СД относятся все лица, достигшие 45 лет. Следовательно, обследование для исключения нарушений углеводного обмена должны проходить все лица этой возрастной группы. При нормальных результатах скрининг у этой категории обследуемых повторяется каждые 3 года; при наличии других факторов риска – ежегодно.
Длительное время считалось, что СД 2 типа возникает после 40 лет и до этого возраста встречается крайне редко. В последние годы отмечается возрастание распространенности СД 2 типа в более молодом возрасте. Более того, недавние публикации, посвященные эпидемиологической ситуации по СД 2 типа в США и ряде европейских стран, свидетельствуют о катастрофическом росте распространенности СД 2 типа у детей и подростков [9]. Тем не менее, несмотря на то что развитие гипергликемии является многофакторным процессом, ряд исследователей считают именно возраст одним из важных независимых факторов, приводящих к снижению чувствительности к инсулину и нарушению секреции инсулина бета-клетками поджелудочной железы [10].
Увеличение уровня глюкозы плазмы с возрастом у лиц без нарушений углеводного обмена отмечено в нескольких работах. В частности, по данным V.R. Kutty и соавт., в индийской популяции наблюдался рост уровня ГПН с возрастом, причем в молодом возрасте (20−29 лет) уровень ГПН был выше у мужчин, а в пожилом возрасте (> 69 лет) – у женщин [11]. В исследовании, проведенном в Московской области, было установлено, что у лиц без нарушений углеводного обмена имеется достоверная положительная корреляция между возрастом и уровнем глюкозы плазмы через 2 часа после приема глюкозы: r = 0,30 у мужчин и r = 0,13 у женщин (p < 0,001) [12].
Еще одним немодифицируемым фактором риска СД 2 типа является наследственная предрасположенность. Известно, что риск заболеть СД 2 типа у лиц, имеющих одного или более родственников первой линии с СД, выше в 2−6 раз, чем у тех, чьи родные не страдают этим заболеванием [13]. Родственники больных относятся к группе риска развития СД 2 типа, так как высока вероятность наличия у них генетической предрасположенности к диабету и, возможно, они имеют схожие пищевые предпочтения и образ жизни [14, 15]. Риск развития СД повышает также принадлежность к определенной этнической группе (афроамериканцы, латиноамериканцы, коренные американцы, жители Тихоокеанского региона).
К модифицируемым факторам, повышающим риск возникновения метаболических нарушений и, в частности, СД, относится абдоминальное ожирение [16, 17]. В Финляндии в процессе наблюдательного исследования среди заболевших СД в течение 10 лет 90% имели индекс массы тела (ИМТ) более 25 кг/м2 [18]. Для оценки степени метаболического риска применяется расчет ИМТ, а также окружности талии (ОТ). Использование только ИМТ для идентификации лиц группы риска может привести к искажению оценки степени риска. Так, лица, активно занимающиеся физическими упражнениями, могут иметь повышенный ИМТ за счет развития мышечной массы [19]. Более объективную оценку наличия абдоминального ожирения дает измерение ОТ. В настоящее время нет единого подхода к диагностике абдоминального ожирения. Национальная образовательная программа по холестерину (National Cholesterol Education Program, NCEP) США предлагает следующие критерии абдоминального ожирения: ОТ ≥ 102 см – для мужчин и ≥ 88 см – для женщин. IDF в 2005 г. предложила более строгие критерии (для европейцев): ≥ 94 см – для мужчин и ≥ 80 см – для женщин.
Избыточное потребление калорий является основной причиной эпидемии ожирения и СД 2 типа, однако качество пищи также может играть существенную роль. В исследовании здоровья медсестер (Nurses’ Health Study, NHS) было обнаружено, что качество жиров и углеводов играет важную роль в возникновении СД 2 типа, независимо от ИМТ выше нормы и других факторов риска [20]. В частности, более высокое содержание трансгенных жиров и простых углеводов было ассоциировано с увеличением риска СД 2 типа, в то время как увеличение потребления растительной клетчатки и полиненасыщенных жиров – со снижением риска СД 2 типа. Включение в рацион двух порций из цельного зерна приводит к снижению риска СД 2 типа на 21% [21]. Употребление подслащенных напитков увеличивает риск диабета. При этом было показано, что у людей, употреблявших 1–2 порции подслащенных напитков в день, риск СД увеличивается на 26%, по сравнению с теми, кто их практически не употреблял.
Кроме увеличения массы тела, употребление подслащенных напитков может способствовать росту кардиометаболического риска и через другие механизмы, такие как увеличение потребности в инсулине, дислипидемия и хроническое воспаление. Большое количество быстро абсорбируемых углеводов (сахарозы) в таких напитках приводит к резкому подъему уровня глюкозы крови и повышенному выбросу инсулина [22]. В настоящее время активно изучается роль повышенного потребления фруктозы в нарушении метаболизма. Фруктоза преимущественно метаболизируется до липидов в печени, что приводит к увеличению печеночного липогенеза, дислипидемии и резистентности к инсулину. Это может также способствовать развитию висцерального ожирения. Употребление трансгенных жиров увеличивает риск развития сердечно-сосудистых заболеваний и, возможно, ведет к нарастанию инсулинорезистентности и хроническому воспалению.
Гиподинамия также относится к факторам риска развития СД 2 типа, в то время как физическая активность обладает протекторным действием. Уменьшение риска развития СД при усиленной физической активности связывают с усилением чувствительности тканей к инсулину, причем этот эффект, по-видимому, не зависит от пола, возраста и наличия ожирения.
Сердечно-сосудистые заболевания и СД 2 типа тесно связаны между собой. Процент больных диабетом среди кардиологических пациентов достаточно высок и продолжает расти в связи с увеличением распространенности метаболических нарушений среди населения. Так, четверть больных, поступивших в стационар в связи с инфарктом миокарда, имели СД 2 типа [23]. Больные с сердечно-сосудистыми заболеваниями, у которых диагностирован СД 2 типа, имеют более пессимистичный прогноз по сравнению с больными без диабета. Совсем недавно были опубликованы американские рекомендации Рабочей группы по профилактике (U.S. Preventive Services Task Force), в которых отмечена необходимость исключения СД 2 типа у всех пациентов с артериальной гипертонией [24]. При этом, по мнению экспертов Рабочей группы по профилактике, скрининг следует ограничить только больными с артериальной гипертонией, игнорируя другие факторы риска, что нам представляется весьма спорным. Однако не вызывает сомнения утверждение, согласно которому больной при наличии артериальной гипертонии должен пройти тест для исключения СД 2 типа.
Женщины, у которых в анамнезе имелся гестационный диабет, также относятся к группе риска развития СД 2 типа. По данным метаанализа 205 публикаций за период с 1960 по 2009 г., риск заболеть СД 2 типа у женщин, перенесших гестационный диабет, повышается в 7,4 раза [25]. Результаты исследования «Риск атеросклероза в сообществах» (Atherosclerosis Risk in Communities, ARIC) продемонстрировали, что с риском СД 2 типа ассоциирован повышенный уровень лептина. Лептин продуцируется жировой тканью, его уровень в крови прямо пропорционален количеству жира в организме. Лептин влияет на рецепторы в гипоталамусе, уменьшая аппетит. Повышенный уровень лептина коррелирует с уровнем инсулина натощак. В то же время снижение веса приводит к уменьшению уровня лептина и уровня инсулина натощак. С повышенным риском развития СД 2 типа ассоциированы также определенные маркеры воспаления (интерлейкин-6, С-реактивный белок, фактор некроза опухоли, фибриноген).
Еще одним фактором риска развития СД является гемохроматоз, характеризующийся избыточным накоплением железа в органах и тканях [26]. В исследовании, проведенном в Финляндии, было показано, что повышенное содержание железа (ниже уровней при гемохроматозе) является фактором риска развития СД [27]. Важно, что взаимосвязь между уровнем ферритина сыворотки и развитием СД существует независимо от уровня факторов воспаления. Предположительно, повышенное отложение железа в печени способствует развитию инсулинорезистентности, либо повышение уровня ферритина является маркером метаболических нарушений, приводящих к СД 2 типа. Для выявления лиц группы риска развития СД используются опросники, которые заполняются участником исследования либо самостоятельно, либо с помощью специально подготовленных кадров (интервьюирование). Существует значительное количество специальных опросников (табл.), создание которых основано на оценке основных факторов риска развития СД 2 типа.
При выборе опросника нужно всегда учитывать особенности региона и контингента обследуемых для наибольшей адекватности и достоверности полученного материала. Широкое распространение получил опросник, разработанный Финской диабетической ассоциацией (FINDRISС). В Финляндии разработан и успешно реализуется государственный план по профилактике СД 2 типа FIN-D2D, включающий многоступенчатый скрининг с использованием на начальном этапе опросника FINDRISС. Опросник FINDRISС рекомендован к использованию рабочей группой Европейского общества кардиологов (European Society of Cardiology, ESC) и Европейской ассоциации по изучению сахарного диабета (European Association for the Study of Diabetes, EASD) в 2007 г. и используется во многих странах.
Опросники могут распространяться через врачей амбулаторной службы (терапевтов, врачей общей практики, эндокринологов), специалистов центров здоровья и центров профилактики. При выявлении высокого риска по результатам заполнения опросника человек должен обратиться в кабинет профилактики СД, который может быть организован на базе центра здоровья или центров профилактики в каждом муниципальном образовании. Медицинский работник оценивает риск развития СД и, если он действительно высокий, проводит тест для выявления СД.
Выявляемость нарушений углеводного обмена во многом зависит от используемых диагностических критериев нарушений углеводного обмена и метода исследования (определение только гликемии натощак или использование орального глюкозотолерантного теста (ОГТТ)). Критерии диагностики СД едины во всех современных классификациях, диагностические критерии ранних нарушений углеводного обмена отличаются у ВОЗ и ADA. По критериям ВОЗ, диагноз НГН устанавливается при уровне ГПН ≥ 6,1 и < 7 ммоль/л, по версии ADA – ≥ 5,6 и < 7 ммоль/л. Снижение верхней границы нормы для ГПН ведет к увеличению регистрируемой распространенности ранних нарушений углеводного обмена в популяции. По данным популяционного исследования NHANES (National Health and Nutrition Examination Survey), проведенного в США, частота НГН по критериям ADA составила 24%, а по критериям ВОЗ − 7%.
Выбор диагностического теста может оказать существенное влияние на результаты скрининга. По мнению экспертов ВОЗ, использование ОГТТ в качестве диагностического теста является лучшим выбором при проведении скрининга [33]. В рекомендациях ВОЗ 2006 г. отмечены следующие преимущества ОГТТ: 1) диагностика только по уровню ГПН не дает возможности выявить около 30% случаев СД 2 типа; 2) ОГТТ – единственный способ выявления НТГ. При этом ВОЗ допускает использование в качестве диагностического теста определение только гликемии натощак или через 2 часа после нагрузки 75 г глюкозы при ограниченных возможностях проведения скрининга. Нужно учитывать, что при определении глюкозы только в какой-либо одной точке (натощак или через 2 часа после нагрузки глюкозой) результаты оценки распространенности нарушений гликемии могут значительно отличаться. Так, эпидемиологическое исследование, проведенное в Московской области, показало, что при скрининге, основанном на диагностике нарушений углеводного обмена только по уровню гликемии натощак (по критериям ВОЗ 2006 г.), почти у каждого пятого пациента СД 2 типа остается невыявленным.
В рекомендациях ВОЗ 2006 г., составленных при участии экспертов IDF, ОГТТ в обязательном порядке рекомендуется проводить лицам с ГПН от 6,1 до 6,9 ммоль/л, то есть при выявлении НГН по критериям ВОЗ. Рекомендации ВОЗ 2006 г. приняты и в России. Однако эпидемиологическое исследование, проведенное в Московской области, показало, что риск выявления СД 2 типа (по второй точке в ОГТТ) и НТГ возрастает при ГПН более 5 ммоль/л, поэтому при скрининге целесообразно проводить ОГТТ лицам, имеющим ГПН более 5,0 ммоль/л [34].
В январе 2010 г. ADA опубликовала стандарты помощи больным СД 2 типа, в которых HbA1c был впервые предложен в качестве диагностического критерия СД 2 типа и ранних нарушений углеводного обмена наряду с ГПН и уровнем глюкозы плазмы через 2 часа в ОГТТ. При этом диагноз СД 2 типа устанавливался при HbA1c ≥ 6,5%, а ранние нарушения углеводного обмена – при HbA1c от 5,7% до 6,4%. В 2011 г. ВОЗ официально признала HbA1c одним из диагностических критериев СД, однако пока воздержалась от рекомендаций по использованию HbA1c в качестве критерия диагностики ранних нарушений углеводного обмена.
Для проведения эффективного скрининга принципиальное значение имеет выбор диагностического оборудования. Определение гликемии в диагностических целях должно проводиться только на сертифицированных биохимических анализаторах. Портативные глюкометры для этих целей не используются из-за достаточно большой погрешности определения. Именно поэтому результаты исследования распространенности СД, в которых использовались портативные глюкометры, нельзя в полной мере назвать достоверными. При этом использование стационарных анализаторов, расположенных в лаборатории, также может затруднять проведение скрининга и даже искажать его результаты.
Во-первых, принципиальное значение имеет проведение анализа непосредственно сразу же после забора образца крови, так как известно, что концентрация глюкозы в образце крови, взятом для анализа, не стабильна. Эритроциты, тромбоциты и особенно лейкоциты продолжают потреблять глюкозу, в результате чего концентрация глюкозы в крови снижается. Единственный путь избежать снижения гликемии в результате гликолиза – это провести анализ непосредственно после забора крови или центрифугирование образца крови. Во-вторых, проведение анализа крови в лаборатории не дает возможности принять быстрое решение о необходимости ОГТТ исходя из уровня ГПН. В этом случае необходим повторный визит обследуемого после получения результатов из лаборатории.
Автоматический анализатор HemoCue Glucose 201+ (Швеция) является портативным, но, тем не менее, обладает лабораторными точностью и качеством определения уровня глюкозы, поэтому сертифицирован не только для контроля гликемии при уже установленном диагнозе, но и для диагностики СД и ранних нарушений углеводного обмена. Оборудование “point-of-care”, то есть диагностика в месте наблюдения пациента, дает врачу возможность в режиме реального времени проводить исследования и принимать решения. В настоящее время компания HemoCue (Швеция) выпустила на рынок автоматический портативный анализатор гликозилированного гемоглобина HbA1c 501.
Резюмируя вышесказанное, отметим: распространенность СД 2 типа значительно превосходит регистрируемую и действительно достигла в ряде районов России масштабов эпидемии; имеется достаточно большое число лиц со скрыто протекающими ранними нарушениями углеводного обмена, у которых многократно повышен риск СД; частота и тяжесть сердечно-сосудистых осложнений значительно больше у больных СД 2 типа по сравнению с популяционным риском, что делает наличие СД 2 типа угрозой для здоровья населения. В этой связи представляется необходимым внедрение современных эффективных программ скрининга для выявления нарушений углеводного обмена, что поможет выявить СД 2 типа на ранних стадиях и будет способствовать снижению распространенности его поздних осложнений.
1. International Diabetes Federation. Diabetes Atlas. 5th ed. Brussels: International Diabetes Federation, 2011. 137 p. // www.idf.org/diabetesatlas.
2. Древаль А.В., Мисникова И.В., Барсуков И.А. и др. Распространенность сахарного диабета 2 типа и других нарушений углеводного обмена в зависимости от используемых критериев их диагностики // Сахарный диабет. 2010. № 1. С.116–121.
3. Ford E.S., Zhao G., Li C. Pre-diabetes and the risk for cardiovascular disease: a systematic review of the evidence // J. Am. Coll. Cardiol. 2010. Vol. 55. № 13. P. 1310–1317.
4. Selvin E., Steffes M.W., Zhu H. et al. Glycated hemoglobin, diabetes, and cardiovascular risk in nondiabetic adults // N. Engl. J. Med. 2010. Vol. 362. № 9. P. 800–811.
5. Cheng Y.J., Gregg E.W., Geiss L.S. et al. Association of A1C and fasting plasma glucose levels with diabetic retinopathy prevalence in the U.S. population: Implications for diabetes diagnostic thresholds // Diabetes Care. 2009. Vol. 32. № 11. P. 2027–2032.
6. Wilson J., Jungner G. Principles and practice of screening of disease. Geneva: World Health Organization, 1968. P. 9–149.
7. Wild S., Roglic G., Green A. et al. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030 // Diabetes Care. 2004. Vol. 27. № 5. P. 1047–1053.
8. Geiss L.S., Pan L., Cadwell B. et al. Changes in incidence of diabetes in U.S. adults, 1997–2003 // Am. J. Prev. Med. 2006. Vol. 30. № 5. P. 371–377.
9. Writing Group for the SEARCH for Diabetes in Youth Study Group, Dabelea D., Bell R.A., D’Agostino R.B. Jr. et al. Incidence of diabetes in youth in the United States // JAMA. 2007. Vol. 297. № 24. P. 2716–2724.
10. Basu R., Breda E., Oberg A.L. et al. Mechanisms of the age-associated deterioration in glucose tolerance: contribution of alterations in insulin secretion, action, and clearance // Diabetes. 2003. Vol. 52. № 7. P. 1738–1748.
11. Kutty V.R., Soman C.R., Joseph A. et al. Random capillary blood sugar and coronary risk factors in a south Kerala population // J. Cardiovasc. Risk. 2002. Vol. 9. № 6. P. 361–367.
12. Древаль А.В., Мисникова И.В., Барсуков И.А. Влияние возраста и массы тела на глюкозу плазмы в ходе орального глюкозотолерантного теста у лиц без нарушений углеводного обмена // Терапевтический архив. 2009. № 10. С. 34–37.
13. Harrison T.A., Hindorff L.A., Kim H. et al. Family history of diabetes as a potential public health tool // Am. J. Prev. Med. 2003. Vol. 24. № 2. P. 152–159.
14. Valdez R. Detecting undiagnosed type 2 diabetes: family history as a risk factor and screening tool // J. Diabetes Sci. Technol. 2009. Vol. 3. № 4. P. 722–726.
15. Nishigaki M., Kobayashi K., Hitomi T. et al. Perception of offspring risk for type 2 diabetes among patients with type 2 diabetes and their adult offspring // Diabetes Care. 2007. Vol. 30. № 12. P. 3033–3034.
16. Gregg E.W., Cadwell B.L., Cheng Y.J. et al. Trends in the prevalence and ratio of diagnosed to undiagnosed diabetes according to obesity levels in the U.S. // Diabetes Care. 2004. Vol. 27. № 12. P. 2806–2812.
17. Koh-Banerjee P., Wang Y., Hu F.B. et al. Changes in body weight and body fat distribution as risk factors for clinical diabetes in US men // Am. J. Epidemiol. 2004. Vol. 159. № 12. P. 1150–1159.
18. Hu G., Lindström J., Valle T.T. et al. Physical activity, body mass index, and risk of type 2 diabetes in patients with normal or impaired glucose regulation // Arch. Intern. Med. 2004. Vol. 164. № 8. P. 892–896.
19. Janssen I., Katzmarzyk P.T., Ross R. Waist circumference and not body mass index explains obesity-related health risk // Am. J. Clin. Nutr. 2004. Vol. 79. № 3. P. 379–384.
20. Hu F.B., Manson J.E., Stampfer M.J. et al. Diet, lifestyle, and the risk of type 2 diabetes mellitus in women // N. Engl. J. Med. 2001. Vol. 345. № 11. P. 790–797.
21. De Munter J.S., Hu F.B., Spiegelman D. et al. Whole grain, bran, and germ intake and risk of type 2 diabetes: a prospective cohort study and systematic review // PLoS Med. 2007. Vol. 4. № 8. P. e261.
22. Hu F.B., Willett W.C. Optimal diets for prevention of coronary heart disease // JAMA. 2002. Vol. 288. № 20. P. 2569–2578.
23. Tenerz A., Lönnberg I., Berne C. et al. Myocardial infarction and prevalence of diabetes mellitus. Is increased casual blood glucose at admission a reliable criterion for the diagnosis of diabetes? // Eur. Heart J. 2001. Vol. 22. № 13. P. 1102–1110.
24. U.S. Preventive Services Task Force. Screening for type 2 diabetes mellitus in adults: U.S. Preventive Services Task Force recommendation statement // Ann. Intern. Med. 2008. Vol. 148. № 11. P. 846–854.
25. Bellamy L., Casas J.P., Hingorani A.D. et al. Type 2 diabetes mellitus after gestational diabetes: a systematic review and meta-analysis // Lancet. 2009. Vol. 373. № 9677. P. 1773–1779.
26. Yaouanq J.M. Diabetes and haemochromatosis: current concepts, management and prevention // Diabete Metab. 1995. Vol. 21. № 5. P. 319–329.
27. Salonen J.T., Tuomainen T.P., Nyyssönen K. et al. Relation between iron stores and non-insulin dependent diabetes in men: case-control study // BMJ. 1998. Vol. 317. № 7160. P. 727.
28. Baan C.A., Ruige J.B., Stolk R.P. et al. Performance of a predictive model to identify undiagnosed diabetes in a health care setting // Diabetes Care. 1999. Vol. 22. № 2. P. 213–219.
29. Heldgaard P.E., Griffin S.J. Routinely collected general practice data aids identification of people with hyperglycaemia and metabolic syndrome // Diabet. Med. 2006. Vol. 23. № 9. P. 996–1002.
30. Glümer C., Carstensen B., Sandbaek A. et al. A Danish diabetes risk score for targeted screening: the Inter99 study // Diabetes Care. 2004. Vol. 27. № 3. P. 727–733.
31. Implementation of Type 2 Diabetes Prevention Plan in Pirkanmaa, South Ostrobothnia, North Ostrobothnia, Northern Savo and Central Finland Hospital districts. Tampere: Finnish Diabetes Association, 2006. 62 p.
32. Herman W.H., Smith P.J., Thompson T.J. et al. A new and simple questionnaire to identify people at increased risk for undiagnosed diabetes // Diabetes Care. 1995. Vol. 18. № 3. P. 382–387.
33. DECODE Study Group on behalf of the European Diabetes Epidemiology Study Group. Will new diagnostic criteria for diabetes mellitus change phenotype of patients with diabetes? Reanalysis of European epidemiological data // BMJ. 1998. Vol. 317. № 7155. P. 371–375.
34. Мисникова И.В., Древаль А.В., Барсуков И.А. Новый подход к проведению скрининга для выявления ранних нарушений углеводного обмена // Проблемы эндокринологии. 2011. № 1. С. 80–85.
Новости на тему
02.02.2024
21.09.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
В статье поднимается проблема раннего выявления сахарного диабета (СД) 2 типа, обосновывается необходимость внедрения в повседневную практику современных эффективных скрининговых программ.
Детально рассматриваются факторы риска развития СД, обсуждаются диагностические критерии и выбор диагностического оборудования для выявления ранних нарушений углеводного обмена и СД 2 типа.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
