Опыт применения российского препарата семаглутида в реальной клинической практике
- Аннотация
- Статья
- Ссылки
- English
Отсутствие препарата в арсенале эндокринологов может затруднить оказание своевременной и качественной медицинской помощи пациентам и таким образом препятствовать ожидаемому увеличению продолжительности и качества их жизни. С учетом жизненной необходимости обеспечения лиц с СД 2 типа семаглутидом в России был воспроизведен, а в конце 2023 г. зарегистрирован препарат Семавик® (GP40221) (ООО «Герофарм»). Продемонстрирована высокая степень сопоставимости биоэквивалента препарату сравнения Оземпик® (компания «Ново Нордиск А/С») в отношении характеристик действующего вещества, примесей и состава вспомогательных веществ.
Кроме того, российские исследователи установили нейропротективный потенциал препарата Семавик®, а также оценили возможность его применения при ожирении.
В статье рассмотрен опыт использования препарата Семавик® у ко- и полиморбидных пациентов с СД 2 типа. Инициация данной терапии проводилась на базе эндокринологического отделения Нижегородской областной клинической больницы им. Н.А. Семашко.
Отсутствие препарата в арсенале эндокринологов может затруднить оказание своевременной и качественной медицинской помощи пациентам и таким образом препятствовать ожидаемому увеличению продолжительности и качества их жизни. С учетом жизненной необходимости обеспечения лиц с СД 2 типа семаглутидом в России был воспроизведен, а в конце 2023 г. зарегистрирован препарат Семавик® (GP40221) (ООО «Герофарм»). Продемонстрирована высокая степень сопоставимости биоэквивалента препарату сравнения Оземпик® (компания «Ново Нордиск А/С») в отношении характеристик действующего вещества, примесей и состава вспомогательных веществ.
Кроме того, российские исследователи установили нейропротективный потенциал препарата Семавик®, а также оценили возможность его применения при ожирении.
В статье рассмотрен опыт использования препарата Семавик® у ко- и полиморбидных пациентов с СД 2 типа. Инициация данной терапии проводилась на базе эндокринологического отделения Нижегородской областной клинической больницы им. Н.А. Семашко.
Сахарный диабет (СД) – одна из самых актуальных проблем современности с учетом стремительных темпов его распространенности, ранней инвалидизации больных и повышенного риска сердечно-сосудистой смерти [1]. У пациентов с СД ведущую позицию среди болезней системы кровообращения занимает хроническая сердечная недостаточность, далее по значимости следуют атеросклеротические сердечно-сосудистые заболевания, в том числе ишемическая болезнь сердца, инфаркт миокарда, нарушения мозгового кровообращения и острые сердечно-сосудистые события (нарушение ритма сердца, тромбоэмболия легочной артерии, тромбозы, внезапная сердечно-сосудистая смерть, кардиогенный шок, отек мозга). Кумулятивно они становятся причиной смерти 38,6% пациентов с СД 1 типа и 50,9% пациентов с СД 2 типа [1]. Установлено, что инициатором и катализатором полифункциональных нарушений служит именно ожирение.
Как следствие, не так давно глюкозоцентричная стратегия терапии СД сменилась на органопротективную и расширились терапевтические горизонты. Речь, в частности, идет о смещении фокуса в сторону управления рисками сердечно-сосудистых cобытий и смерти и особой роли в этом процессе, согласно результатам многочисленных клинических исследований, агонистов рецепторов глюкагоноподобного пептида 1 (ГПП-1) [2]. Данные препараты признаны приоритетными у лиц с СД и атеросклеротическими сердечно-сосудистыми заболеваниями [3].
Одним из препаратов данного класса является семаглутид. Он относится к аналогам нативного человеческого ГПП-1 и обладает высокой (94%) степенью структурной гомологии с ним. Пролонгированное воздействие позволяет вводить препарат один раз в неделю.
Эффективность и безопасность семаглутида для подкожного применения последовательно оценивались в серии клинических исследований SUSTAIN (десять клинических исследований фазы III с участием более чем 10 тыс. пациентов с СД 2 типа) [2]. Главным результатом исследований стало значимое, максимальное по сравнению с другими современными сахароснижающими препаратами снижение частоты больших сердечно-сосудистых событий (MACE). Так, риск наступления MACE у применявших семаглутид уменьшился на 26% (отношение шансов 0,74 при 95%-ном доверительном интервале (ДИ) 0,58–0,95; p < 0,001) по сравнению с получавшими плацебо, прежде всего вследствие снижения риска развития нефатального инсульта на 39% и нефатального инфаркта миокарда на 26%. Предполагается, что кардио- и вазопротекция была достигнута за счет улучшения контроля углеводного обмена, выраженного снижения уровня гликированного гемоглобина (HbA1c), уменьшения массы тела и систолического артериального давления (на 2,4–5,1 и 2,7–7,3 мм рт. ст. для доз 0,5 и 1,0 мг/нед соответственно) [2], а также за счет снижения на 49% относительного риска наступления событий, связанных с окклюзией малых сосудов в головном мозге, и на 33% относительной частоты процедур, связанных с реваскуляризацией миокарда [4].
Семаглутид и снижение веса
Эффективность и безопасность применения агонистов рецепторов ГПП-1, в частности семаглутида, у лиц с избыточной массой тела или ожирением с и без СД 2 типа были доказаны в серии рандомизированных клинических исследований STEP, в рамках которых еженедельно вводили инъекции препарата в максимальной дозе 2,4 мг [5]. Во всех исследованиях STEP подкожное введение семаглутида в дозе 2,4 мг/нед неизменно приводило к снижению веса в среднем на 14,9–17,4% у пациентов без СД и улучшению кардиометаболических факторов риска, физических функций и качества жизни [6]. В частности, применение семаглутида в течение 68 недель в исследовании STEP 8 у лиц без СД 2 типа способствовало снижению массы тела в среднем на 15,8% [7], а в исследовании STEP 2 у лиц с СД 2 типа – на 9,6% [8].
При сравнении эффективности семаглутида с эффективностью других агонистов рецепторов ГПП-1 установлено явное его преимущество. Так, согласно результатам метаанализа, включавшего девять исследований с участием 5445 пациентов, средний возраст которых составлял 60,01 (55,5–70,0) года, со средней продолжительностью наблюдения 32,5 (4,0–58,7) недели, семаглутид, лираглутид, дулаглутид, тирзепатид и эксенатид ассоциировались со снижением веса в среднем на 4,81, 2,81, 4,03, 9,7 и 1,9 кг соответственно [9]. В ходе проведения другого метаанализа, включавшего пять рандомизированных клинических исследований с общим количеством участников 4421, потеря веса в среднем составила 11,4% от исходного [10].
Результаты рандомизированных исследований подтверждают превосходство семаглутида в отношении снижения веса при СД 2 типа перед другими агонистами рецепторов ГПП-1, но не перед тирзепатидом [11].
Семаглутид и неалкогольная жировая болезнь печени
В одном из исследований было продемонстрировано, что лечение семаглутидом заметно улучшало показатели ферментов печени, а также метаболические параметры у пациентов с неалкогольной жировой болезнью печени (НАЖБП) или неалкогольным стеатогепатитом [12].
Согласно результатам другого исследования, в котором 1164 пациента с НАЖБП применяли семаглутид в течение 68 недель, препарат значимо снижал уровни аланинаминотрансферазы (АЛТ) и С-реактивного белка у лиц с СД 2 типа и/или ожирением [8]. Аналогичные данные были получены в ходе наблюдения за 50 пациентами в течение шести месяцев [13]. При этом начальная доза препарата составляла 0,25 мг/нед, через четыре недели его дозу увеличили до 0,5 мг/нед, а затем также через четыре недели – до 1,0 мг/нед (при необходимости). Улучшение лабораторных параметров под влиянием семаглутида при титрации дозы отмечено и в других исследованиях [14, 15]. Высказано предположение, что под воздействием семаглутида возможно обратное развитие метаболически ассоциированной жировой болезни печени [16].
Первый российский семаглутид
Разработка воспроизведенного препарата, содержащего семаглутид, является актуальной задачей, решение которой позволит увеличить доступность такого лечения в Российской Федерации. Данную задачу взяла на себя российская компания «Герофарм». И в конце 2023 г. в России был зарегистрирован препарат Семавик® (GP40221).
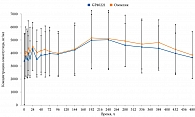
На сегодняшний день показана высокая степень сопоставимости биоэквивалента препарату сравнения в отношении характеристик действующего вещества, примесей и состава вспомогательных веществ [4]. В исследование включали здоровых добровольцев – мужчин европеоидной расы в возрасте от 18 до 45 лет с индексом массы тела (ИМТ) от 18,5 до 29,9 кг/м2. Тестируемый препарат – Семавик® (GP40221), раствор для подкожного введения, 1,34 мг/мл (ООО «Герофарм», Россия). В качестве препарата сравнения выбран Оземпик®, раствор для подкожного введения, 1,34 мг/мл (компания «Ново Нордиск А/С», Дания). В зависимости от группы было назначено однократное введение тестируемого препарата или препарата сравнения в одинаковой дозе 0,50 мг в область подкожной жировой клетчатки передней брюшной стенки [17]. Установлено, что значения 90% ДИ для отношений геометрических средних основных фармакокинетических параметров семаглутида укладываются в допустимые границы 80,00–125,00%. Был сделан вывод, что препараты Семавик® (GP40221) (ООО «Герофарм», Россия) и Оземпик® (компания «Ново Нордиск А/С», Дания) могут быть признаны биоэквивалентными и одинаково безопасными (рисунок) [17].
В настоящее время также проведено сравнительное исследование фармакокинетики, биоэквивалентности, безопасности и переносимости содержащих семаглутид препаратов GP40331 (ООО «Герофарм», Россия) и Вегови® (компания «Ново Нордиск», Дания) в концентрациях 0,68 и 3,2 мг/мл (дозы 0,25 и 0,50 мг соответственно) у здоровых добровольцев при однократном введении натощак. Необходимо отметить, что препарат Вегови® одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США именно для борьбы с ожирением. Концентрацию семаглутида в биообразцах сыворотки крови человека определяли с помощью высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием. Значения 90% ДИ для отношений геометрических средних основных параметров фармакокинетики сравниваемых препаратов и их безопасность оказались сопоставимыми [18].
Нейропротективный потенциал препарата Семавик® был доказан Т.Л. Кароновой и соавт. (2024 г.). В эксперименте сравнивались защитные свойства препаратов Семавик® и Оземпик® при их применении до воспроизведения ишемического инсульта у крыс. При использовании препарата Семавик® отмечалось уменьшение тяжести инсульта, что проявлялось как в виде снижения объема некроза, так и в виде улучшения неврологического статуса. Авторами работы был сделан вывод, что нейропротективный потенциал Семавик® сопоставим с таковым препарата Оземпик® и превосходит таковой метформина. При этом данный защитный эффект не связан с влиянием лекарственных средств на гликемический профиль [19].
Препарат Семавик® также был взят на вооружение гинекологами и репродуктологами [20].
В марте 2024 г. начато активное внедрение препарата Семавик® в гБУЗ НО «Нижегородская областная клиническая больница им. Н.А. Семашко» (НОКБ им. Н.А. Семашко). Данное учреждение одним из первых стало использовать Семавик® в Нижегородской области.
В настоящее время в Нижегородской области препарат Семавик® применяют 184 пациента.
Клиническое наблюдение
Ниже приводится несколько клинических случаев применения препарата Семавик®.
Клинический случай 1. Пациентка С. 63 лет, неработающая пенсионерка.
Диагноз: СД 2 типа, осложненный дистальной диабетической сенсорной полиневропатией нижних конечностей, НАЖБП, дислипидемия, гиперурикемия, целевой уровень HbA1c – менее 7%, морбидное ожирение, синдром Пиквика, бронхиальная астма, смешанная форма, тяжелое течение, гормонозависимая, неконтролируемая, хроническая обструктивная болезнь легких, дыхательная недостаточность второй степени, синдром обструктивного апноэ сна, гипертоническая болезнь второй степени, риск четвертый, целевое артериальное давление – 120–129/70–79 мм рт. ст., пупочная грыжа больших размеров (планируется оперативное лечение).
Больная страдает СД 2 типа около двух лет. Принимала метформин в дозе 2000 мг/сут. Гликемия – 6–7 ммоль/л, однако беспокоил жидкий стул, дискомфорт, лабораторно – лактат до 4 ммоль/л. В амбулаторном режиме дозу метформина уменьшили до 1000 мг/сут.
В течение двух последних лет вес значимо не изменялся и составлял 136 кг.
Общий анализ крови от 4 сентября 2024 г.: гемоглобин – 136 г/л, эритроциты – 4,37 × 1012/л, лейкоциты – 5,86 × 109/л, тромбоциты – 216 × 109/л, моноциты – 10,5%, эозинофилы – 4,8%, нейтрофилы – 60,2%, гематокрит – 0,436 Ед.
Общий анализ мочи от 4 сентября 2024 г.: удельный вес – 1014, эритроциты, лейкоциты, белок, эпителий, кетоны – отрицательно, прозрачность полная. Суточная микроальбуминурия – 5,16 мг/сут.
Биохимия крови от 4 сентября 2024 г.: лактат – 2,08 ммоль/л, общий белок крови – 60,6 г/л, альбумин –
42,6 г/л, α-амилаза – 52,0 Ед/л, общий билирубин – 9,1 мкмоль/л, АЛТ – 62 Ед/л, аспартатаминотрансфераза (АСТ) – 33,8 Ед/л, γ-глутамилтранспептидаза – 52,3 Ед/л, креатинин – 62 мкмоль/л, скорость клубочковой фильтрации (СКФ) (по формуле CRD-EPI) –
92,64 мл/мин/1,73 м2, мочевина – 2,77 ммоль/л, общий холестерин – 5,58 ммоль/л, липопротеины низкой плотности (ЛПНП) – 3,268 ммоль/л, липопротеины высокой плотности (ЛПВП) – 1,53 ммоль/л, триглицериды – 1,72 ммоль/л, липопротеины очень низкой плотности – 0,79 ммоль/л, калий – 4,04 ммоль/л, натрий – 142 ммоль/л, натрийуретический пептид – 186,8 пг/мл.
Исследование углеводного обмена в сентябре 2024 г.: HbA1c – 5,83%, гликемический профиль от 4 сентября – 6,9–6,8–7,2–5,2 ммоль/л, от 11 сентября – 6,1–6,8–6,5–6,4 ммоль/л.
Электрокардиография от 4 сентября 2024 г.: синусовая аритмия с частотой сердечных сокращений 50–56–62 в минуту. Диффузное нарушение реполяризации миокарда желудочков. Поворот левым желудочком вперед.
Ультразвуковое исследование органов брюшной полости от 11 сентября 2024 г.: гепатомегалия, диффузные изменения печени по типу жирового гепатоза, признаки хронического бескаменного холецистита, диффузные изменения поджелудочной железы, умеренные диффузные изменения паренхимы обеих почек.
Назначена терапия: инициация применения препарата Семавик® в условиях эндокринологического отделения НОКБ им. Н.А. Семашко. Начальная доза семаглутида (препарата Семавик®) – 0,25 мг/нед (в стационаре введена дважды), далее – по 0,5 мг/нед, метформин по 500 мг два раза в день плюс гипотензивные препараты (амлодипин, сартаны), аторвастатин, аллопуринол.
Повторно пациентка обратилась к эндокринологу в НОКБ им. Н.А. Семашко 20 ноября 2024 г. с просьбой обеспечить данным препаратом за счет средств бюджета (в амбулаторном режиме покупала препарат самостоятельно).
Таким образом, женщина принимала данный препарат в течение двух месяцев, при этом в дозе 0,25 мг – две недели, в дозе 0,5 мг – шесть недель. На фоне лечения значительно уменьшились тяга к сладкому и масса тела (на 10 кг), что важно в связи с предстоящей операцией (ушивание пупочной грыжи), а также снизилась доза гипотензивных препаратов.
Терапия препаратом Семавик® переносилась хорошо. Побочных реакций отмечено не было.
Согласно данным дневника самоконтроля, гликемия колебалась от 5,8 до 6,8 ммоль/л, гипогликемии отсутствовали.
Однако больная была настроена на более быструю потерю веса, в связи с чем было принято решение увеличить дозу препарата до 1,0 мг/нед.
Таким образом, препарат оказался высокоэффективным и безопасным у пациентки с морбидным ожирением, СД 2 типа, бронхиальной астмой и гигантской пупочной грыжей.
Клинический случай 2. Пациент В. 49 лет.
Диагноз: СД 2 типа, осложненный дистальной диабетической сенсорной полиневропатией нижних конечностей, НАЖБП, целевой уровень HbA1c – менее 7%, морбидное ожирение (ИМТ – 55,56 кг/м2), гипертоническая болезнь второй степени, риск четвертый, целевое артериальное давление – 120–129/70–79 мм рт. ст.
Сахарным диабетом 2 типа страдает около семи лет. Принимает метформин в дозе 1000 мг/сут (одна таблетка после ужина).
Исследование углеводного обмена от 2 августа 2024 г.: HbA1c – 6,7%.
Гликемический профиль: натощак – 6,7–5,9 ммоль/л, через два часа после еды – до 6–7 ммоль/л, гипогликемий нет.
В начале августа 2024 г. в условиях эндокринологического отделения НОКБ им. Н.А. Семашко начат прием препарата Семавик® в дозе 0,25 мг/нед.
После выписки из стационара в амбулаторном режиме пациент применял Семавик® в дозе 0,5 мг/нед в течение четырех недель, с сентября 2024 г. – по 1,0 мг/нед в течение шести недель.
За три месяца терапии вес больного снизился с 180 кг до 164 кг. Пациент также отмечал снижение тяги к сладкому. Он стал более активным, его качество жизни улучшилось.
На контрольном визите вес – 164 кг, рост – 180 см, ИМТ – 50,6 кг/м2.
Лабораторные показатели: снижение уровня АЛТ с 175 до 74,6 Ед/л, АСТ с 139 до 51,4 Ед/л, креатинин – 69,9 мкмоль/л, СКФ – 120 мл/мин/1,73 м2.
Побочных явлений терапии пациент не отмечал, гипогликемий не было.
Применение препарата Семавик® оказалось эффективным и безопасным. Данный препарат стал альтернативой хирургическому лечению.
Клинический случай 3. Пациент А. 53 лет.
Диагноз: СД 2 типа, осложненный дистальной диабетической сенсорной полиневропатией нижних конечностей, хроническая болезнь почек стадии 3аА1, диабетическая ретинопатия первой стадии, НАЖБП, дислипидемия, целевой уровень HbA1c – менее 7%, ожирение третьей степени, гипертоническая болезнь второй степени, риска четвертый, целевое артериальное давление – 120–129/70–79 мм рт. ст.
Ранее получал ингибитор дипептидилпептидазы 4 и метформин в дозе 2000 мг/сут.
Терапия препаратом Семавик® в дозе 0,25 мг/нед подкожно начата в эндокринологическом отделении НОКБ им. Н.А. Семашко в марте 2024 г., при этом ингибитор дипептидилпептидазы 4 был отменен.
После выписки из стационара больной принимал метформин в дозе 2000 мг/сут плюс Семавик® в дозе 1,0 мг/нед подкожно.
Динамика клинико-лабораторных показателей за шесть месяцев лечения препаратом Семавик® в дозе 1,0 мг/нед в комбинации с метформином в дозе 2000 мг/сут: снижение массы тела с 124 до 104 кг, уровня общего билирубина с 33,4 до 18,0 мкмоль/л, непрямого билирубина с 24,5 до 12,6 мкмоль/л, АЛТ с 49,9 до 27,4 Ед/л, общего холестерина с 3,99 до 3,59 ммоль/л, триглицеридов с 1,41 до 1,26 ммоль/л, ЛПНП с 2,26 до 1,89 мкмоль/л, ЛПВП с 1,09 до 1,13 мкмоль/л, мочевой кислоты с 389 до 296 мкмоль/л, HbA1c – с 7,5 до 6,2%.
На фоне лечения качество жизни пациента значительно улучшилось.
Отмечена безопасность препарата Семавик® при длительном применении. Побочных нежелательных явлений не зафиксировано.
Терапия была продолжена в том же объеме. Доза гипотензивных препаратов и статинов не изменена.
Заключение
Появление на российском фармацевтическом рынке первого отечественного препарата семаглутида (Семавик®, ООО «Герофарм») позволит проводить современную патогенетическую терапию пациентам с СД 2 типа и ожирением, а также управлять течением грозных хронических заболеваний.
O.V. Zanozina, MD, PhD, Prof., Yu.A. Sorokina, PhD, Ye.V. Kalugina, S.D. Zhuk, N.N. Plastova, N.Yu. Taradayko, A.А. Mosina, S.A. Sukhanov, N.A. Dubova
Privolzhsky Research Medical University
Nizhny Novgorod Regional Clinical Hospital named after N.A. Semashko
Contact person: Olga V. Zanozina, zwx2@mail.ru
A breakthrough in the treatment of patients with type 2 diabetes mellitus (T2DM) was the emergence of revolutionary drugs, such us glucagon-like peptide 1 receptor agonists, one of which is the semaglutide. The efficacy and safety of subcutaneous semaglutide were consistently assessed in the multicenter, multinational, randomized controlled trials. They are SUSTAIN (ten phase III clinical trials involving more than 10.000 patients with type 2 diabetes) and STEP (five clinical trials involving more than 4.988 patients without and with T2DM). The effectiveness and safety of this drug has been proven. In addition, numerous positive pleiotropic effects of semaglutide have been identified, which makes it possible to better manage T2DM.
At the same time, the absence of the drug in the arsenal of endocrinologists will make it difficult to provide timely and high-quality medical care to patients and expect an increase in the duration and quality of life. Considering the vital need to provide patients with T2DM with semaglutide, at the end of 2023 the drug Semavic® (GP40221) was registered in Russia (‘Geropharm’ LLC, Russia). A high degree of comparability of the bioequivalent to the reference drug (Ozempic®, ‘Novo Nordisk’) has been shown in terms of the characteristics of the active substance, impurities and composition of excipients. Russian researchers have shown the neuroprotective potential of the drug Semavic®, and studies are being conducted on the possibility of using it in obese patients without diabetes mellitus.
Russian researchers have shown the neuroprotective potential of the drug Semavic®, and studies are being conducted on the possibility of using it in obese patients without diabetes mellitus.
The article shows the experience of using this drug in co- and multimorbid patients with T2DM. The initiation of this therapy was carried out on the basis of the endocrinology department of the Nizhny Novgorod Regional Clinical Hospital named after N.A. Semashko.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.