Заключение
Актуальные вопросы интерферонотерапии вирусных инфекций у детей. ХVIII Конгресс педиатров России с международным участием «Актуальные проблемы педиатрии»
- Аннотация
- Статья
- Ссылки
Современные подходы к лечению острых инфекционных заболеваний у детей
Заведующий кафедрой поликлинической и неотложной педиатрии Российского национального исследовательского медицинского университета (РНИМУ) им. Н.И. Пирогова, руководитель научно-образовательного инновационного центра «Неотложные состояния в педиатрии», д.м.н., профессор, заслуженный врач Российской Федерации Борис Моисеевич БЛОХИН посвятил свой доклад актуальной проблеме здравоохранения – лечению инфекционных заболеваний у детей.
Одной из наиболее распространенных проблем педиатрии остаются острые респираторные заболевания (ОРЗ). В структуре общей заболеваемости населения они стабильно занимают первое место. На их долю приходится 90% всех инфекционных заболеваний.
Подсчитано, что из 60 прожитых лет около шести лет человек болеет ОРЗ. Взрослый переносит около трех эпизодов ОРЗ в год, ребенок первого года жизни – от двух до 12. Школьник за эпидемический сезон болеет от двух до пяти раз, дошкольник – до шести раз в год.
Профессор Б.М. Блохин подчеркнул, что не следует недооценивать опасность заболевания гриппом. Грипп – неизменное заболевание, вызываемое изменчивым вирусом. 50% случаев гриппа и острых респираторных вирусных инфекций (ОРВИ) приходится на долю детей до 14 лет. Взрослые болеют гриппом или ОРВИ в среднем от двух до четырех раз в год. Во время эпидемий поражается 10–20% всего населения, причем заболеваемость у детей в четыре раза выше, чем у взрослых.
По словам докладчика, на сегодняшний день остается недооцененной роль гриппа в смертности населения. Так, из 2360 летальных исходов за год в Нидерландах в 26% случаев причиной стал грипп, в 17% – болезни легких, в 34% – болезни сердца. Другие причины имели место в 23% случаев [1].
ОРВИ – этиологически гетерогенная группа заболеваний, протекающих на фоне интоксикационного синдрома различной степени тяжести и характеризующихся преимущественным поражением органов дыхания. Респираторные вирусы циркулируют в популяции круглогодично, поэтому заболеть ОРВИ рискует каждый человек в любое время года. В этиологической структуре циркулирующих респираторных вирусов лидируют риновирусы – 30–50%.
Течение респираторной патологии у детей обусловлено анатомо-физиологическими особенностями органов дыхания. К моменту рождения ребенка морфологическое строение органов дыхания несовершенно. Интенсивный рост и дифференцировка дыхательных органов продолжаются в течение первых месяцев и лет жизни. Процесс формирования органов дыхания завершается в среднем к семи годам. Впоследствии органы дыхания только увеличиваются в размерах. Дыхательные пути у ребенка значительно меньше, а просветы уже, чем у взрослого. Ввиду морфологических особенностей (тонкая сухая слизистая оболочка, мягкость хрящевого каркаса нижних дыхательных путей и др.) у детей первых лет жизни снижена барьерная функция слизистой оболочки, что способствует более легкому проникновению инфекционного агента в кровеносное русло и создает предпосылки для сужения дыхательных путей.
Повышенная чувствительность новорожденных и детей младшего возраста к инфекции обусловлена также физиологическим дисбалансом Th1/Th2-системы, физиологическим дефицитом иммуноглобулинов и незрелостью адаптивного иммунитета. При становлении иммунной системы ребенка выделяют пять критических периодов.
Период новорожденности характеризуется снижением числа естественных киллеров, слабой устойчивостью к инфекционно-воспалительным заболеваниям, особенно вызванным кишечной палочкой, пневмококком и стафилококком.
В возрасте от трех до шести месяцев у детей снижается пассивный гуморальный иммунитет, повышается чувствительность к вирусным агентам, распадаются материнские антитела, отмечается недостаток секреторного иммуноглобулина (Ig) А. Транзиторный дефицит иммуноглобулинов, характерный для данного периода онтогенеза, обусловливает склонность ребенка к ОРВИ и пневмониям.
У ребенка в возрасте двух-трех лет сохраняется супрессивная направленность, повышенная чувствительность В-лимфоцитов к интерлейкинам. Недостаточный местный иммунитет сопровождается относительно низким уровнем иммуноглобулинов. Совокупность таких факторов становится причиной более легкого развития аутоиммунных, вирусно-бактериальных, вирусных и аллергических заболеваний.
В возрасте от четырех до шести лет происходящий перекрест клеточных элементов крови сопровождается снижением количества лимфоцитов. Этот процесс протекает на фоне недостаточной по сравнению со «взрослой» концентрации иммуноглобулинов, особенно IgA, в сыворотке крови, что и приводит к снижению иммунореактивности.
Последним критическим периодом считается возраст 12–15 лет. Физиологическое повышение уровня половых гормонов в организме способствует подавлению клеточного звена иммунитета. В этом возрасте отмечается более тяжелое течение инфекционно-аллергических и аутоиммунных заболеваний.
На фоне снижения защитных сил организма в период заболевания гриппом у детей могут развиваться серьезные осложнения – как респираторные (вирусная, бактериальная пневмония, ларинготрахеобронхит (круп), отит), так и нереспираторные (миозит, миокардит, энцефалит, синдром Рея, фебрильные судороги). У детей в возрасте до пяти лет, особенно младше двух лет, нередки осложнения в виде заболеваний нижних дыхательных путей и среднего острого отита. Последний диагностируют ежегодно у 3–5% детей, перенесших грипп [2].
Сложность терапии острых инфекционных заболеваний связана с ограниченным возрастным диапазоном препаратов, незрелостью иммунной защиты, невозможностью своевременной этиологической диагностики, изменчивостью и резистентностью вирусов и возбудителей. При ОРВИ у детей применяют неспецифическую противовирусную иммунотерапию. Препаратом с широким противовирусным спектром, обусловленным неспецифическим механизмом действия, является интерферон (ИФН). ИФН-альфа оказывает противовирусное действие за счет подавления репликации вируса, препятствует заражению интактных клеток, усиливает фагоцитарные реакции, повышает киллерный потенциал эффекторных клеток, тем самым оказывая иммунологическое действие. ИФН-альфа стимулирует секреторный IgА и опосредованный антибактериальный эффект за счет иммуномодуляции.
Докладчик привел данные метаанализа рандомизированных контролируемых клинических исследований эффективности и безопасности препарата Генферон® лайт, содержащего в качестве активных веществ ИФН-альфа 125 000 МЕ и антиоксидант таурин, и другого препарата с ИФН-альфа в дозе 150 000 МЕ с участием 562 детей в возрасте от нуля до семи лет. В ходе наблюдения не отмечалось серьезных нежелательных явлений, равно как и досрочного завершения участия в исследованиях. В сравнительном открытом рандомизированном исследовании эффективности лечения ОРВИ препаратом Генферон® лайт 50 детей первой группы в возрасте от двух до семи лет получали ректально Генферон® лайт 125 000 МЕ в сутки в течение пяти дней со стандартной терапией. 50 детей того же возраста второй группы принимали другой препарат ИФН-альфа в дозе 150 000 МЕ без таурина ректально два раза в сутки в течение пяти дней со стандартной терапией. Как показали результаты иммунофлуоресцентного исследования, элиминация возбудителей ОРВИ на фоне лечения препаратом Генферон® лайт составила 85%, а препаратом ИФН-альфа 150 000 МЕ – 64%.
В другом открытом сравнительном рандомизированном ретроспективном исследовании изучали эффективность и безопасность интерферонотерапии в лечении ОРВИ у детей раннего возраста (от шести до 36 месяцев). Пациенты первой группы (n = 58) получали Генферон® лайт 125 000 МЕ, пациенты второй (n = 42) – ИФН-альфа 150 000 МЕ. При динамическом наблюдении за частотой купирования заложенности носа выявлено, что после 3-го дня терапии симптом имел тенденцию к более быстрому купированию в группе пациентов, получавших Генферон® лайт, и к моменту окончания терапии исследуемыми препаратами (6-й день) заложенность носа регистрировалась в два раза реже, чем в группе сравнения. При анализе динамики купирования остальных симптомов ОРВИ не обнаружено статистически значимых различий между группами детей, получавших Генферон® лайт 125 000 МЕ и препарат ИФН-альфа в более высокой дозе 150 000 МЕ.
В многоцентровом открытом сравнительном рандомизированном контролируемом клиническом исследовании эффективности и безопасности препаратов Генферон® лайт и Анаферон детский в составе комплексной терапии ветряной оспы участвовали дети в возрасте от двух до семи лет. Результаты продемонстрировали практически одинаковые показатели среднего времени до купирования лихорадки и кожного зуда, наступления реконвалесценции на фоне применения обоих препаратов.
В еще одном исследовании участвовало 199 детей с ОРВИ. Пациенты первой группы получали ректально Генферон® лайт 125 000 МЕ два раза в сутки в течение пяти дней, пациенты второй – ИФН-альфа 150 000 МЕ по той же схеме. Как показал анализ динамики клинической картины ОРВИ, статистически достоверной разницы в скорости купирования симптомов в исследуемых группах получено не было, однако в группе Генферона лайт отмечалась тенденция к более быстрому купированию гиперемии зева и болей в горле в период двух-трех дней терапии, а также заложенности носа.
В заключение профессор Б.М. Блохин подчеркнул, что использование меньшей дозы ИФН-альфа в составе препарата Генферон® лайт по сравнению с другими препаратами этой группы позволяет достигать одинакового терапевтического эффекта при снижении количества вводимого ИФН, что уменьшает лекарственную нагрузку на организм ребенка. Помимо ИФН-альфа Генферон® лайт содержит таурин, оказывающий антиоксидантное, репаративное и мембраностабилизирующее действие. В составе препарата Генферон® лайт нет компонентов донорской крови, поэтому отсутствует опасность заражения в процессе терапии нескринируемыми инфекциями. Препарат не содержит иммуноглобулиновых комплексов, его отличает идентичность эндогенному ИФН, гипоаллергенная основа суппозитория и высокая безопасность. Препарат Генферон® лайт (ЗАО «БИОКАД», Россия) эффективен в комплексном лечении инфекционных заболеваний у детей.
Ведение детей с рецидивирующими инфекциями респираторного тракта. Возможности коррекции
Врач-педиатр высшей категории, к.м.н., доцент кафедры госпитальной педиатрии РНИМУ им. Н.И. Пирогова, ЦНИИ эпидемиологии Роспотребнадзора Елена Валериевна МЕЛEХИНА рассказала о тактике ведения детей с рецидивирующими инфекциями органов респираторного тракта.
В 1986 г. было сформулировано определение часто болеющих детей (ЧБД) как группы диспансерного наблюдения, включающей детей, подверженных частым респираторным инфекциям из-за транзиторных корригируемых отклонений в защитных системах организма и не имеющих стойких органических нарушений в них. Однако с течением времени представление о группе ЧБД несколько изменилось. Сегодня российские специалисты считают, что часто болеющий ребенок – это ребенок с повторной или рецидивирующей респираторной вирусной, бактериальной или смешанной патологией ЛОР-органов (аденоидит, отит, тонзиллит), верхних (ларингит) или нижних (бронхит, трахеит, пневмония) дыхательных путей, развивающихся на фоне дисфункции иммунитета или неадекватного лечения, с повышением риска развития местных гнойных, системных воспалительных и функциональных легочных и сердечно-сосудистых осложнений [3].
Для лечения ЧБД необходим адекватный подбор терапии, с учетом особенностей иммунной системы и сопутствующих заболеваний.
Как известно, на состояние здоровья ребенка влияют как эндогенные (наследственность, особенности перинатального периода, хроническая соматическая патология), так и экзогенные факторы (экологическая обстановка, посещение ребенком детских дошкольных учреждений, нерациональное вскармливание, информационная и физическая перегрузка, длительный и частый прием антибиотиков, частые путешествия, стрессы).
Докладчик привела результаты собственного исследования, в ходе которого изучали факторы, влияющие на частую заболеваемость ОРЗ детей из благополучных семей. Показано, что на частоту ОРЗ не влияет продолжительность грудного вскармливания, время начала посещений детских учреждений, вакцинация. В семьях, где есть домашние животные, дети болеют достоверно реже. Это подтверждает теорию о том, что наличие антигенов стимулирует правильную дифференцировку Т-лимфоцитов. Дети, начинающие путешествовать в возрасте до трех лет, болеют достоверно чаще детей, которые начинают путешествовать после четырех лет [4].
Иммунная система детского организма имеет свои особенности. В отличие от взрослых у детей отмечается снижение активности интегральных ИФН-альфа, присутствует дефицит IgA, IgM, IgG, а также снижение гранулоцитарного и моноцитарно-макрофагального хемотаксиса. Результаты большинства исследований, демонстрирующие изменение различных систем иммунной защиты у ЧБД с рецидивирующими инфекциями органов респираторного тракта, свидетельствуют о том, что изменения этой системы сходны с таковыми у детей той же возрастной категории. Повышается уровень провоспалительных цитокинов на фоне дефицита ИФН и дисбаланса Th1/Th2-лимфоцитов. Опосредованная недостаточность иммунной системы приводит к частым ОРЗ, вызванным различными этиологическими агентами. Это не только респираторные вирусы (грипп, аденовирус, коронавирус, риновирус), внутри- и внеклеточные возбудители (Chlamydia pneumoniae, Ch. traсhomatis, Mycoplasma hominis и др.), бактериальные инфекции, но и группа герпесвирусов. Герпесвирусы (Herpesviridae) – это большое семейство ДНК-содержащих вирусов, вызывающих различные болезни у человека и других млекопитающих. Вирусы герпеса являются классическим оппортунистом и внутриклеточным паразитом. На сегодняшний день доказана роль восьми типов герпетической инфекции в развитии патологий у человека – вирус простого герпеса (ВПГ) 1-го и 2-го типов, Herpes zoster (3-й тип), вирус Эпштейна – Барр (4-й тип), цитомегаловирус (5-й тип), вирус герпеса человека (ВГЧ) 6–8-го типов. Вирусы герпеса известны не только цитопатическим действием. Они также имеют склонность к длительной персистенции в лимфоидных клетках, что приводит к нарушению функций этих клеток. Это способствует развитию пролиферативного синдрома и формированию вторичного иммунодефицитного состояния. Как следствие – тяжелое течение ОРВИ и формирование соматической патологии.
Е.В. Мелехина продемонстрировала результаты собственных исследований частоты выявления активных форм герпесвирусных инфекций у ЧБД [5]. Из 795 ЧБД с рецидивирующими инфекциями органов респираторного тракта 58% имели те или иные формы герпесвирусной инфекции.
Особенностями течения ОРЗ у ЧБД являются плохой ответ на традиционную терапию, увеличение длительности заболевания, субфебрилитет, сохраняющийся долгое время после болезни, обострение хронических очагов инфекции. Поэтому в педиатрической практике для коррекции выявленных иммунных нарушений применяют иммуномодулирующие препараты разнонаправленного действия, обладающие иммунотропностью, в терапевтических дозах восстанавливающие функции иммунной системы. ИФН относятся к важнейшим компонентам неспецифической защиты организма от инфекций. Они способны активировать внутриклеточные процессы, обеспечивающие устойчивость к инфекциям, усиливать врожденный и приобретенный иммунитет.
Докладчик продемонстрировала результаты сравнительного рандомизированного проспективного исследования эффективности и безопасности препаратов Генферон® лайт и Арбидол в лечении эпизодов ОРВИ в группе ЧБД. Генферон® лайт – препарат с преимущественным иммуномодулирующим и опосредованным противовирусным действием, Арбидол – препарат прямого противовирусного действия. Исследование проводили в течение двух лет, в нем принимали участие четыре исследовательских центра – РНИМУ им. Н.И. Пирогова, Первый Московский государственный медицинский университет им. И.М. Сеченова, Саратовский государственный медицинский университет им. В.И. Разумовского и Детская городская поликлиника № 35 г. Санкт-Петербурга. В исследование было включено 64 ребенка из группы ЧБД в возрасте от трех до шести лет с диагнозом ОРВИ. Все участники исследования получали терапию и наблюдались в амбулаторных условиях. Длительность ОРВИ на момент включения в исследование не превышала 48 часов с момента появления основных симптомов. Дети не получали цитокины, индукторы цитокинов и глюкокортикостероиды. В исследование не включали детей с аутоиммунными заболеваниями и иммунодефицитными состояниями, а также с гиперчувствительностью к препаратам ИФН. Детей наблюдали в течение 180 дней. Контроль проводили во время пяти визитов, а также в форме телефонных опросов. В первый день исследования выполняли физикальный осмотр, забор крови для клинического анализа, общий анализ мочи, комплексное обследование на оппортунистические инфекции, исследовали иммунный статус. Через пять дней оценивали клиническое состояние детей. В ходе третьего визита, на десятый день исследования, детям проводили физикальный осмотр, стандартные обследования, изучали результаты анализов крови и мочи, оценивали эффективность проводимой терапии. Терапевтический курс приема препаратов завершался, и начинался профилактический. Через 40 дней после начала терапии проводили повторную оценку иммунного статуса. На 180-й день исследования определяли профилактическую эффективность терапии.
64 пациента были разделены на две равные группы. Пациенты основной группы получали препарат Генферон® лайт в дозе 125 000 МЕ ректально два раза в сутки в течение десяти дней одновременно со стандартной терапией, далее по профилактической схеме – по одному суппозиторию в сутки на ночь через день в течение трех недель. Пациенты контрольной группы получали Арбидол в дозе 50 мг внутрь четыре раза в сутки в течение пяти дней одновременно со стандартной терапией, далее – по 50 мг два раза в неделю в течение трех недель. Дети обеих групп посещали в основном дошкольные учреждения, более трети из них имели отягощенный аллергоанамнез, сопутствующие заболевания (хронические ЛОР-патологии, инфекции органов мочевой системы, патологии желудочно-кишечного тракта). Среди клинических проявлений ОРВИ у всех пациентов на момент исследования превалировали повышение температуры тела, патологии верхних дыхательных путей, кашель. При определении маркеров оппортунистических инфекций наибольшее их количество (10–12,9%) выявлено по микоплазменной инфекции. Причем у ряда пациентов это были маркеры острой инфекции. Более половины детей имели антитела класса IgG к возбудителям цитомегаловирусной инфекции, вирусу Эпштейна – Барр и ВГЧ 6-го типа. В обеих группах отмечалось снижение иммунного статуса – более чем у 60% детей регистрировалось снижение концентрации ИФН-альфа и/или ИФН-гамма.
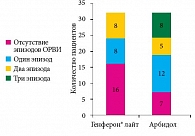
Показано, что терапевтическая эффективность препаратов Генферон® лайт и Арбидол в купировании эпизода ОРВИ была приблизительно одинаковой. Оценка эффективности профилактического курса приема препаратов через 180 дней наблюдения продемонстрировала достоверные различия между группами. В группе Арбидола повторных эпизодов ОРВИ было гораздо больше, чем в группе Генферона лайт. Повторные эпизоды ОРВИ в группе Генферона лайт отмечались у 16 детей, в группе Арбидола – у 25 (р = 0,004). В большинстве случаев в обеих группах имели место повторные эпизоды в виде ОРВИ легкой степени тяжести.
Антибактериальная терапия в течение 180 дней наблюдения в общей сложности потребовалась 13 детям, получавшим Генферон® лайт, и 12 детям, принимавшим Арбидол. Показаниями к назначению антибиотиков, как правило, были инфекции ЛОР-органов и острые кишечные инфекции.
Таким образом, проведенное исследование показало, что большинство детей с рецидивирующими инфекциями органов респираторного тракта (93–98%) имели сопутствующую соматическую патологию и более половины из них – патологию нескольких систем органов. В группе ЧБД треть детей имели антитела класса G к вирусам ВПГ 1-го и 2-го типов, более половины – к другим вирусам герпетической группы (цитомегаловирус, вирус Эпштейна – Барр, ВГЧ 6-го типа). У 37,5% детей группы ЧБД был повышен уровень реагиновых антител IgE, у 60–73,8% детей обнаружен дефицит ИФН-альфа и -гамма. Полученные данные продемонстрировали, что применение препарата Генферон® лайт в острый период ОРВИ не менее эффективно, чем использование препарата прямого противовирусного действия Арбидол. При длительном наблюдении Генферон® лайт оказался более эффективным в плане предотвращения повторных эпизодов ОРВИ. В группе Генферона лайт ни один ребенок не имел более двух повторных эпизодов ОРВИ, тогда как в группе Арбидола восемь детей имели по три повторных эпизода ОРВИ (см. рисунок).
Рекомендуемый режим применения препарата Генферон® лайт у детей с рецидивирующими инфекциями органов респираторного тракта – два раза в сутки в течение десяти дней и далее в целях поддерживающей терапии через день однократно на ночь в течение трех недель.
Подводя итог сказанному, Е.В. Мелехина отметила, что Генферон® лайт помимо высокой безопасности характеризуется положительным клиническим эффектом и может быть назначен детям с тяжелым течением ОРВИ на фоне активных форм герпесвирусной инфекции в сочетании со стандартной терапией.
Комбинация рекомбинантного человеческого интерферона альфа-2b и аминокислоты таурина обеспечивает уникальный спектр действия препарата Генферон® лайт (ЗАО «БИОКАД», Россия). Препарат оказывает выраженный противовоспалительный эффект и целенаправленное этиотропное воздействие. Препарат может быть использован у детей разных возрастных групп, а также у пациентов с отягощенным анамнезом.
ОРЗ вирусной и смешанной этиологии являются наиболее распространенной патологией в педиатрической практике. Назначение детям с тяжелым течением ОРВИ, в том числе на фоне активных форм герпесвирусной инфекции, препарата Генферон® лайт способствует более быстрому купированию основных симптомов ОРВИ, элиминации возбудителя заболевания и повышению иммунного статуса. Генферон® лайт позволяет сократить эпизоды респираторных заболеваний, снизить бактериально-вирусную нагрузку на организм ребенка.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.