Клинико-иммунологическая эффективность интеграционной программы реабилитации иммунной системы у пациентов с атипичной хронической активной герпесвирусной коинфекцией до и во время COVID-19, а также в постковидном периоде
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить клинико-иммунологическую эффективность интеграционной программы реабилитации иммунной системы (ИПРИС), включающей таргетную интерфероно- и иммуномодулирующую терапию (ТИИТ), у пациентов с АХА-ГВИ до и во время COVID-19, а также в постковидном периоде.
Материал и методы. Группа исследования включала 35 пациентов обоего пола в возрасте от 25 до 60 лет, страдавших АХА-ГВИ и получавших лечение с использованием ИПРИС. На фоне ИПРИС, включавшей только ИФН-терапию, пациенты перенесли COVID-19. Спустя две – четыре недели после отмены ИФН-терапии наблюдался рецидив АХА-ГВИ, в связи с чем ИПРИС была проведена повторно.
Результаты. У пациентов с АХА-ГВИ оценены клинические симптомы, ассоциированные с синдромом хронической усталости (СХУ) и когнитивными расстройствами, до, после проведения ИПРИС и в постковидном периоде с использованием разработанной нами шкалы. Выявлены нарушения в системе противовирусной иммунной защиты и системе ИФН: снижение индуцированной продукции ИФН-α, количества нейтрофильных гранулоцитов, CD3+CD56+ и естественных киллерных клеток.
Принимая во внимание преобладающие нарушения в иммунной системе, нами de novo была создана ИПРИС, которая наряду с другими лечебными мероприятиями включала ТИИТ, доказавшая высокую клинико-иммунологическую эффективность до, во время COVID-19, а также в постковидном периоде.
Заключение. Комплексный подход к лечению АХА-ГВИ с использованием ИПРИС, включающей ТИИТ, позволяет не только значительно улучшить состояние иммунокомпрометированных пациентов, обеспечить регресс СХУ, когнитивных расстройств, восстановить работоспособность пациентов, но и оказать положительное влияние на клиническое течение и исход COVID-19.
Цель – оценить клинико-иммунологическую эффективность интеграционной программы реабилитации иммунной системы (ИПРИС), включающей таргетную интерфероно- и иммуномодулирующую терапию (ТИИТ), у пациентов с АХА-ГВИ до и во время COVID-19, а также в постковидном периоде.
Материал и методы. Группа исследования включала 35 пациентов обоего пола в возрасте от 25 до 60 лет, страдавших АХА-ГВИ и получавших лечение с использованием ИПРИС. На фоне ИПРИС, включавшей только ИФН-терапию, пациенты перенесли COVID-19. Спустя две – четыре недели после отмены ИФН-терапии наблюдался рецидив АХА-ГВИ, в связи с чем ИПРИС была проведена повторно.
Результаты. У пациентов с АХА-ГВИ оценены клинические симптомы, ассоциированные с синдромом хронической усталости (СХУ) и когнитивными расстройствами, до, после проведения ИПРИС и в постковидном периоде с использованием разработанной нами шкалы. Выявлены нарушения в системе противовирусной иммунной защиты и системе ИФН: снижение индуцированной продукции ИФН-α, количества нейтрофильных гранулоцитов, CD3+CD56+ и естественных киллерных клеток.
Принимая во внимание преобладающие нарушения в иммунной системе, нами de novo была создана ИПРИС, которая наряду с другими лечебными мероприятиями включала ТИИТ, доказавшая высокую клинико-иммунологическую эффективность до, во время COVID-19, а также в постковидном периоде.
Заключение. Комплексный подход к лечению АХА-ГВИ с использованием ИПРИС, включающей ТИИТ, позволяет не только значительно улучшить состояние иммунокомпрометированных пациентов, обеспечить регресс СХУ, когнитивных расстройств, восстановить работоспособность пациентов, но и оказать положительное влияние на клиническое течение и исход COVID-19.





Введение
Данные научной литературы свидетельствуют о том, что до 95–98% населения мира в разные периоды своей жизни были инфицированы герпесвирусами (Herpesviridae). Однажды попав в организм человека, герпесвирусы остаются в нем в латентных или нецитолитических формах и могут реактивироваться в условиях стресса или иммуносупрессии [1, 2]. Эти и родственные им вирусы непосредственно модулируют экспрессию генов человека, иммунный ответ, метаболизм клеток и даже эпигенетическую среду хозяина, способствуя возникновению целого ряда патологических процессов [3].
Среди семейства Herpesviridae наиболее часто именно вирус Эпштейна – Барр (ВЭБ) является возбудителем атипичной хронической активной инфекции (АХА-ВЭБ), которая может протекать как в виде моно-, так и в виде микст-инфекции (атипичных хронических активных герпесвирусных коинфекций (АХА-ГВИ)) [4, 5].
В настоящее время проблема АХА-ГВИ является чрезвычайно актуальной для врачей терапевтического профиля в связи с наличием множества клинических масок, развитием коморбидных состояний, вовлечением в патологический процесс различных органов и систем, что затрудняет оценку жалоб и не позволяет своевременно поставить диагноз и назначить адекватную терапию [6–8].
Пациенты с АХА-ГВИ длительное время страдают от клинических проявлений миалгического энцефаломиелита/синдрома хронической усталости (СХУ). У них отмечаются выраженные нарушения когнитивных функций, снижение памяти, внимания, нарушения сна, мигрирующие артралгии, миалгии, многочисленные и разнообразные вегетативные нарушения, плохая переносимость адекватных физических нагрузок и быстрая истощаемость, в основе которых лежат процессы нейроиммуновоспаления как в центральных, так и периферических отделах центральной и вегетативной нервной системы [9]. Нередко имеют место вирус-ассоциированные рекуррентные ОРВИ, хронические рецидивирующие герпесвирусные инфекции, вызванные вирусами простого герпеса 1 и 2 (ВПГ-1 и ВПГ-2), хроническая цитомегаловирусная инфекция (ЦМВ) и ассоциированные с вирусом герпеса человека 6 (ВЧГ-6) инфекции, хронические бактериальные и грибковые инфекции [5]. Зачастую персистирующее течение этих инфекций приводит к развитию аутоиммунной патологии, индукции лимфопролиферативных заболеваний, ведущих к значительному снижению качества жизни пациентов, их социальной дезадаптации и даже стойкой инвалидизации [10].
Большинство современных подходов к лечению герпесвирусных инфекций основаны на назначении локальных и системных противовирусных препаратов синтетического происхождения. Однако у иммунокомпрометированных пациентов с упорно рецидивирующими инфекциями или АХА-ГВИ синтетические противовирусные препараты, даже с использованием пролонгированных схем с включением индукторов интерферонов (ИФН), не дают длительного, стойкого клинического эффекта. По завершении курса терапии или даже на фоне проводимой противовирусной терапии отмечаются тенденция к рецидивированию или неполная клиническая ремиссия [11–13].
Появление вируса SARS-CoV-2 и разнообразие его генотипических вариантов представляют значительные сложности при АХА-ГВИ вследствие уже имеющихся у этих пациентов дефектов функционирования противовирусной иммунной защиты организма и системы ИФН. Дефицит выработки ИФН [14], дисрегуляторные процессы в иммунной системе, возникающие под влиянием SARS-CoV-2, могут способствовать активации персистирующих латентных ВЭБ, ЦМВ, ВЧГ-6, что описано при тяжелой или критично тяжелой острой инфекции COVID-19 [15–18].
Установлено, что многие переболевшие COVID-19 испытывают стойкие физические, когнитивные и психологические расстройства, которые в настоящее время трактуются в рамках симптомокомплекса, обобщенного в понятие «постковидный синдром» [19–23].
Предполагается, что у некоторых пациентов причиной развития стойких симптомов постковидного синдрома даже при условии, что SARS-CoV-2 полностью элиминирован из крови, различных тканей, в том числе нервной, может быть дефицит ИФН-α, вызванный вирусом и повлиявший на возникновение дисрегуляторных процессов в иммунной системе во время острого COVID-19, что привело к нарушению функционирования противовирусных механизмов иммунной защиты. Именно эти нарушения способствуют реактивации латентных патогенов, в частности герпесвирусов, которые начинают активно реплицировать и поражают различные ткани, органы и системы, вызывая нейроиммуновоспаление, в том числе энцефаломиелит, ассоциированный с СХУ, различные аутоиммунные расстройства, обострение АХА-ГВИ.
В этой связи требуется создание новой интеграционной программы реабилитации иммунной системы (ИПРИС) для лечения АХА-ГВИ до и во время COVID-19, а также в постковидном периоде.
Цель исследования
Целью исследования стала оценка клинико-иммунологической эффективности созданной de novo интеграционной программы реабилитации иммунной системы, включающей таргетную интерфероно- и иммуномодулирующую терапию (ТИИТ), для пациентов, страдающих АХА-ГВИ, до и во время COVID-19, а также в постковидном периоде.
Материал и методы
В группу исследования (ГИ) были включены 35 пациентов обоего пола в возрасте от 25 до 60 лет, страдавших АХА-ГВИ и получавших на первом этапе дифференцированную ИПРИС, включая ТИИТ. В дальнейшем на фоне проводимой терапии эти пациенты перенесли COVID-19. Через две – четыре недели после отмены ИФН-терапии отмечена манифестация АХА-ГВИ, в связи с чем программа дифференцированной интеграционной реабилитации иммунной системы с ТИИТ была проведена повторно. Контрольную группу составляли 30 условно здоровых лиц, сопоставимых по полу и возрасту с пациентами ГИ.
Исследование было проведено на базе клинико-диагностического центра «МЕДСИ на Белорусской» (Москва) и одобрено комиссией по вопросам этики.
У всех пациентов получено информированное согласие на участие в исследовании согласно Хельсинкской декларации Всемирной медицинской ассоциации 2013 г. и на обработку персональных данных.
Дизайн исследования
Проведено когортное, проспективное двухэтапное исследование.
Первый этап исследования
На основании выявленных клинических симптомов/критериев и иммунологических критериев иммунокомпрометированности у пациентов с АХА-ГВИ нами была разработана и проведена ИПРИС, включающая ТИИТ, с последующей оценкой клинико-иммунологической эффективности.
Особенности обследования пациентов с АХА-ГВИ на первом этапе исследования заключались в том, что помимо традиционных (в частности, сбор анамнеза, физикальное обследование, общий анализ крови) для детекции герпесвирусных инфекций были использованы серодиагностические методы – иммуноферментный анализ (ИФА) для определения в сыворотке крови титров антител классов иммуноглобулина (Ig) – IgM М VCA EBV, IgG VCA EBV, IgG EBNA, IgG HHV6, IgM CMV, IgG CMV, IgM HSV1/2, IgG HSV1/2 и полимеразная цепная реакция (ПЦР) в режиме реального времени для обнаружения генома герпесвирусов в различных биоматериалах (кровь, слюна, моча, соскоб с миндалин и задней стенки глотки), что имеет принципиальное значение для оценки выраженности вирусной нагрузки и ее динамики на фоне проводимой терапии.
Для определения функционирования основных механизмов противовирусного иммунитета и системы ИФН, проводимой терапии до и по завершении ТИИТ, использовали методы проточной цитофлуориметрии (Beckman Coulter International S.A., Франция) и ИФА (ELISA). В частности, исследовали количество CD3+, CD3+CD4+, CD3+CD8+-T-лимфоцитов, естественных киллерных клеток (ЕКК) – CD3-CD16+CD56+, CD3+CD56+, нейтрофилов, индуцированную продукцию ИФН-α и ИФН-γ. В зависимости от состояния иммунной системы и интерферонов пациенты с АХА-ГВИ были разделены на две группы – ГИ 1 и ГИ 2. В ГИ 1 наряду с нарушением индуцированной продукции ИФН-α имели место дефицит ЕКК и нейтропения. В ГИ 2 преобладали нарушения индуцированной продукции ИФН-α и дефицит Т-цитотоксических лимфоцитов (CTL).
Через три – три с половиной месяца проведения ИПРИС, включавшей только ТИИТ, в комплексе с лечебными мероприятиями в соответствии с актуальными на тот период Временными методическими рекомендациями Минздрава России пациенты ГИ 1 и ГИ 2 перенесли COVID-19.
Второй этап исследования
Через две – четыре недели после перенесенного COVID-19 и отмены ИФН-терапии у пациентов ГИ 1 и ГИ 2 отмечена манифестация АХА-ГВИ с характерными выраженными клиническими проявлениями.
Для обнаружения генома герпесвирусов в различных биоматериалах (кровь, слюна, моча, соскоб с миндалин и задней стенки глотки) использована ПЦР в режиме реального времени. Определены также репликативная активность герпесвирусов и степень выраженности вирусной нагрузки.
С учетом выявленных на первом этапе исследования нарушений функционирования иммунной системы и дефектов индуцированной продукции ИФН-α и ИФН-γ пациентам ГИ 1 и ГИ 2 была повторно проведена ИПРИС с дифференцированной ТИИТ.
Для статистической обработки полученных данных использовали компьютерные программы Microsoft Excel. Результаты представляли в виде медианы (Me), а также верхних и нижних квартилей (Q1–Q3). Использовали критерии Манна – Уитни и Вилкоксона.
Достоверность различия определяли при p < 0,05.
Результаты
Первый этап исследования
На первом этапе исследования в ГИ была определена частота встречаемости моно-герпесвирусных инфекций (моно-ГВИ) и микст-герпесвирусных инфекций (микст-ГВИ).
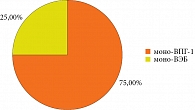
Согласно полученным данным, моно-ГВИ детектировались у 22,9% пациентов, микст-ГВИ – у 77,1%. При этом среди моно-ГВИ большая часть приходилась на моно-ВПГ-1-инфекции (рис. 1). В то же время в случае с микст-ГВИ отмечено доминирование ВЭБ-инфекций – 74,1%.
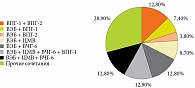
При анализе этиологической структуры микст-ГВИ выявлены лидирующие сочетания: ВПГ-1 + ВПГ-2, ВЭБ + ВЧГ-6, ВЭБ + ЦМВ + ВЧГ-6, а также ВЭБ + ЦМВ + ВЧГ-6 + ВПГ-1 – по 12,8%. Далее по частоте встречаемости сочетания микст-инфекций распределились следующим образом: ВЭБ + ЦМВ (8,7%), ВЭБ + ЦМВ + ВПГ-1 (7,4%), ВЭБ + ЦМВ + ВПГ-2 (3,8%) (рис. 2).
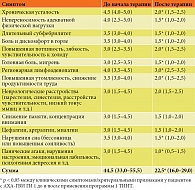
У всех пациентов с АХА-ГВИ имели место клинические симптомы иммунокомпрометированности. Для оценки степени выраженности характерных клинических симптомов/признаков АХА-ГВИ, ассоциированной с СХУ и когнитивными расстройствами, использовали разработанную нами ранее пятибалльную шкалу (0 баллов – отсутствие симптомов, 1 балл – минимальные симптомы, 2 балла – средняя выраженность симптомов, 3 балла – тяжелая степень выраженности симптомов, 4 балла – очень тяжелая степень, 5 баллов – крайне тяжелая степень выраженности симптомов) (табл. 1). Учитывалось наличие или отсутствие симптомов, а также их ранжирование [24, 25].
Доминирующим и наиболее патогномоничным признаком было длительное, тягостное для пациентов ощущение хронической усталости, обозначаемое в научной литературе как поствирусный синдром хронической усталости. СХУ является мультифакториальным состоянием, приводящим к развитию выраженной коморбидности, зачастую сопровождается вынужденным изменением привычного образа жизни. Пациентов сопровождают сильная слабость, потеря работоспособности, из-за чего многие бывают вынуждены отставить работу. У таких больных снижаются концентрация внимания, краткосрочная и долговременная память, когнитивные способности, появляется ощущение туманной головы. Больных беспокоят повышенная потливость, непостоянные боли в горле, мигрирующие боли и дискомфорт в мышцах и суставах (фибромиалгии), новые необычные головные боли, длительный выматывающий субфебрилитет, регионарная лимфоаденопатия, нарушение структуры сна, процесса засыпания, сонливость или бессонница. Реже возникают психогенная депрессия, нарушения вегетативного характера. Кроме того, у большей части пациентов отмечаются возвратные респираторные инфекции в виде частых повторных эпизодов ОРВИ, обострение хронических бактериальных и грибковых инфекций (хронические гаймориты, отиты, синуситы, фарингиты, циститы, уретриты, вульвовагиниты и др.), развитие коинфекций различной локализации [26].
Проведенная на первом этапе исследования оценка степени выраженности клинических симптомов/критериальных признаков у пациентов с АХА-ГВИ выявила различную степень выраженности клинической симптоматики (табл. 2).
Так, при проведении сравнительного анализа установлена более значимая выраженность таких клинических симптомов, как хроническая усталость (4,5 (4,0–5,0) балла) и непереносимость адекватной физической нагрузки (4,0 (2,5–5,0) балла). Общая сумма баллов по шкале оценки выраженности клинических симптомов/критериальных признаков составила 44,5 (33,0–55,5).
Анализ состояния лиц с АХА-ГВИ позволил установить характерные для этого инфекционного заболевания симптомы, а именно признаки инфекционно-воспалительного поражения ЛОР-органов, нейроиммуновоспаления, вызывающего энцефалопатию, сопровождающуюся когнитивными расстройствами, появление фибромиалгий и артралгий, что чаще ассоциировано не только с неврологическими расстройствами, но и с аутовоспалительными нарушениями.
В соответствии с выявленными дефектами и особенностями функционирования иммунной системы и системы ИФН, а также с преобладающими клиническими проявлениями иммунокомпрометированности пациенты с АХА-ГВИ были разделены на две группы.
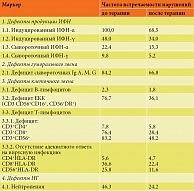
Для первой группы пациентов с АХА-ГВИ преобладающими в системе иммунной противовирусной защиты и системе ИФН были нарушения Т-лимфоцитов – дефицит CD3+CD8+ (76,4%), нарушения ЕКК (CD16+CD56+ и CD16+CD56-) – дефицит их количества и/или функциональной активности (76,7%), дефекты активации CD3+CD8+ – дефицит или неадекватный ответ на вирусную инфекцию CD3+CD8+HLA-DR+ (25,8%). Дефекты в системе интерферонов, проявляющиеся нарушением спонтанной и индуцированной продукции ИФН-α, выявлены в 100% случаев, ИФН-γ – в 48% (табл. 3).
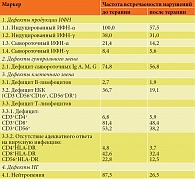
Распределение преобладающих нарушений в иммунной системе во второй группе пациентов с АХА-ГВИ было следующим. Ведущими признаками были выраженная нейтропения (87,3%), нарушения ЕКК (CD16+CD56+ и CD16+CD56-) – дефицит их количества и/или дефект функции (36,7%), дефицит CD3+CD8+-Т-лимфоцитов (76,4%), дефицит CD3+CD8+ цитотоксических Т-лимфоцитов и/или дефекты активации в виде неадекватного ответа CD3+CD8+CD25+ на вирусную инфекцию АХА-ГВИ (81,4%) и/или CD3+CD8+HLA-DR+ (42,6%).
При изучении интерферонового статуса выявлены интерферонопатии вторичного характера по типу интерферонодефицита: дефицит индуцированной продукции ИФН-α имел место у 100% пациентов, индуцированной продукции ИФН-γ – у 48% (табл. 4).
Исходя из анализа выявленных нарушений функционирования механизмов противовирусной защиты иммунной системы и особенностей дефектов системы интерферонов при АХА-ГВИ, нами разработана интеграционная программа реабилитации иммунной системы, включающая дифференцированную пролонгированную таргетную интерфероно- и иммунотерапию (рис. 3).
Принимая во внимание, что в ГИ 1 преобладали дефекты индуцированной продукции ИФН-α и ИФН-γ, нарушения со стороны Т-клеточного звена (преобладающий дефицит цитотоксических Т-лимфоцитов, естественных киллеров Т-лимфоцитов (EKT), неадекватный ответ CTL на вирусную инфекцию в стадии репликативной активности с доминированием ВЭБ), нами была оптимизирована разработанная ранее ИПРИС, включающая ТИИТ, направленную на восстановление доминирующих нарушений.
Программа 1 таргетной интерфероно- и иммунотерапии для пациентов ГИ 1 включала следующие мероприятия.
- Для восстановления мукозального иммунитета слизистых оболочек верхних дыхательных путей за счет повышения локального уровня ИФН-α и индукции феномена интерференции применяли длительную локальную, непрерывную и пролонгированную терапию рекомбинантным ИФН-α-2b (рИФН-α-2b) в комплексе с антиоксидантами, в частности препаратом Виферон® в виде геля. Локальная ИФН-терапия проводилась следующим образом: Виферон-гель наносили на слизистую оболочку задней стенки глотки, миндалин и носовых ходов четыре – шесть раз в день в виде аппликаций в течение всего курса проводимой терапии.
- Для восстановления нарушенной индуцированной продукции ИФН-α и ИФН-γ, количества и функциональной активности ЕКК применялась системная пролонгированная ИФН-терапия – рИФН-α-2b в комбинации с антиоксидантами, препаратом Виферон® в суппозиториях с градиентно снижающимися дозами по схеме: 3 млн МЕ/сут в течение одного месяца, далее 2 млн МЕ/сут – один месяц, далее 1 млн МЕ/сут – один месяц, далее 1 млн МЕ/сут – три раза в неделю в течение двух недель, далее 1 млн МЕ/сут – дважды в неделю в течение двух недель, общий курс – четыре месяца.
- Для восстановления количества и функциональной активности Т-лимфоцитов, обладающих цитотоксической киллерной активностью (CD3+CD8+-Т-лимфоцитов и ЕКТ), применялась таргетная иммуномодулирующая терапия: Имунофан®, основной субстанцией которого является иммунотропный гексапептид аргинил-α-аспартил-лизил-валил-тирозил-аргинин – синтетический аналог активного центра гормона тимуса тимопоэтина. Схема применения – 0,005%-ный раствор препарата Имунофан® один раз в день внутримышечно в течение десяти дней. Проведено три курса ежемесячно с перерывом 20 дней.
- Противовирусная терапия герпесвирусных инфекций, в частности ВЭБ, включала фамцикловир (Фамвир®) в дозе 1500 мг/сут в течение десяти дней один раз в месяц и инозин пранобекс (Изопринозин®) в дозе 1500 мг/сут в течение десяти дней с повторением трех курсов с интервалом 20 дней при общей длительности терапии три месяца.
- Курсы Имунофана и Изопринозина чередовали с перерывом пять дней между курсами.
По завершении интеграционной программы реабилитации иммунной системы, включающей программу 1 ТИИТ, была проведена оценка клинической эффективности проводимой терапии с использованием пятибалльной шкалы в соответствии с разработанными ранее критериальными клиническими признаками (табл. 5).
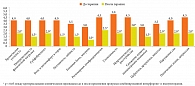
Выраженность клинических проявлений достоверно уменьшилась после проведения программы 1 ТИИТ – с 44,5 (33,0–55,5) до 22,5 (16,0–29,0) балла (р < 0,05).
Кроме того, после проведенной интерфероно- и иммуномодулирующей терапии значительно снизилась частота встречаемости дефицита субпопуляций CD3+CD8+ и CD3+CD56+ – с 76,4 до 28,4 и с 83,2 до 48,2% соответственно, дефектов нейтрофильных гранулоцитов (НГ) – с 46,3 до 24,2%, дефицита ЕКК – с 76,7 до 36,1%. Имевшийся до лечения неадекватный иммунный ответ на вирусную инфекцию регрессировал с учетом частоты встречаемости с 25,8 до 11,6% (табл. 3).
Принимая во внимание преобладающие у пациентов с АХА-ГВИ в ГИ 2 нарушения, а именно вторичные интерферонопатии – дефицит индуцированной продукции ИФН-α и ИФН-γ, вторичная нейтропения –дефицит НГ, дефицит ЕКК, нами была разработана программа 2 ТИИТ.
Программа 2 включала следующие мероприятия.
- Для восстановления мукозального иммунитета слизистых оболочек верхних дыхательных путей за счет повышения локального уровня ИФН-α и индукции феномена интерференции применяли длительную локальную, непрерывную и пролонгированную терапию рИФН-α-2b в комплексе с антиоксидантами – препаратом Виферон® в виде геля. Локальная ИФН-терапия проводилась следующим образом: Виферон-гель наносили на слизистую оболочку задней стенки глотки, миндалин и носовых ходов четыре – шесть раз в день в виде аппликаций в течение всего курса проводимой терапии.
- Для восстановления нарушенной индуцированной продукции ИФН-α и ИФН-γ, количества и функциональной активности ЕКК применялась системная пролонгированная ИФН-терапия рИФН-α-2b в комбинации с антиоксидантами – препаратом Виферон® в суппозиториях с градиентно снижающимися дозами по схеме: 3 млн МЕ/сут в течение одного месяца, далее 2 млн МЕ/сут – один месяц, далее 1 млн МЕ/сут – один месяц, далее 1 млн МЕ/сут – три раза в неделю в течение двух недель, далее 1 млн МЕ/сут – два раза в неделю в течение двух недель. Общая продолжительность курса составила четыре месяца.
- С целью восстановления количества и эффекторных функций НГ проводили таргетную иммуномодулирующую терапию с применением глюкозаминилмурамилдипептида (препарата Ликопид®) в дозе 3 мг/сут (сублингвально) в три приема. Режим применения – три десятидневных курса ежемесячно в течение трех месяцев с перерывами между курсами 20 дней.
- Противовирусная терапия герпесвирусных инфекций, в частности ВЭБ, включала применение фамцикловира (препарата Фамвир®) в дозе 1500 мг/сут в течение десяти дней один раз в месяц и инозина пранобекса (препарата Изопринозин®) в дозе 1500 мг/сут ежедневно в течение десяти дней с повторением трех курсов с интервалом 20 дней при общей длительности терапии три месяца.
- Курсы Ликопида и Изопринозина чередовали с перерывом пять дней между курсами.
После завершения программы 2 ТИИТ была проведена оценка клинической эффективности терапии с использованием пятибалльной шкалы в соответствии с разработанными ранее критериальными клиническими признаками (табл. 6).
Показано достоверное снижение степени выраженности критериальных клинических признаков у пациентов ГИ 2 после проведенной программы 2 ТИИТ – с 44,5 (33,0–55,5) до 20,0 (14,0–27,0) балла (р < 0,05).
Кроме того, выявлены выраженные улучшения основных параметров, контролирующих эффективность противовирусной иммунной защиты организма и системы ИФН. Так, после проведенной терапии значительно снизилась частота встречаемости дефектов НГ – с 87,3 до 26,5%, дефицита ЕКК – с 36,7 до 19,1%, дефицита субпопуляции CD3+CD8+ – с 81,4 до 48,4%, дефицита субпопуляции CD3+CD56+ – с 53,2 до 38,2%. Имевшаяся до лечения неадекватность иммунного ответа на наличие вирусной инфекции регрессировала с 22,8 до 12,5% (табл. 4).
При оценке динамики спонтанной и индуцированной продукции ИФН обнаружено снижение частоты встречаемости нарушений как спонтанной, так и индуцированной продукции ИФН обоих типов. Однако наиболее выраженная динамика наблюдалась в репарации синтеза ИФН-α.
Через два – три с половиной месяца от начала терапии первого этапа пациенты ГИ 1 и ГИ 2 перенесли инфекцию COVID-19, которая была диагностирована у всех страдавших АХА-ГВИ. Лечение COVID-19 проводилось на фоне продолжающейся таргетной интерферонотерапии в комплексе с лечебными мероприятиями в соответствии с актуальными на тот период Временными методическими рекомендациями Минздрава России.
Поскольку у всех пациентов ГИ 1 и ГИ 2 были детектированы нарушения индуцированной продукции ИФН-α, дополнительно к стандартной схеме терапии COVID-19 они получали системную и локальную терапию рИФН-α-2b в комбинации с антиоксидантами – препаратом Виферон® в суппозиториях в дозе 6–9 млн МЕ/сут в течение десяти дней. Кроме того, с целью повышения уровня ИФН-α на слизистой оболочке дыхательных путей, обеспечивающего противовирусную защиту, проводилась локальная ИФН-терапия с использованием Виферон-геля, который применялся в виде аппликаций на слизистую оболочку носовых ходов, заднюю стенку глотки и дужки миндалин с частотой до пяти раз в день на протяжении всего срока системного лечения.
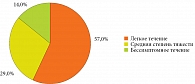
На фоне проводимой комбинированной терапии у 57% пациентов инфекция COVID-19 протекала в легкой форме, у 29% – была средней степени тяжести. Бессимптомное течение инфекции имело место у 14,0% больных. Инфицирование SARS-CoV-2 было подтверждено с помощью ПЦР, пациенты были в контакте с больными CОVID-19. Тяжелых форм течения заболевания не зафиксировано (рис. 4).
Второй этап исследования
Через две – четыре недели после перенесенного COVID-19 на фоне отмены ИФН-терапии у пациентов ГИ 1 и ГИ 2 манифестировала АХА-ГВИ с характерными выраженными проявлениями и жалобами на ухудшение общего состояния, возвращение симптомов СХУ и когнитивных расстройств.
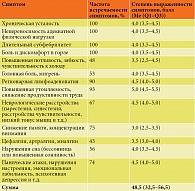
Выраженность клинических симптомов была оценена с помощью соответствующей шкалы. Выявлена высокая частота встречаемости характерных проявлений обострения АХА-ГВИ. Выраженность симптомов составила 48,5 (32,5–56,5) балла. Полученные данные свидетельствовали о тяжелом обострении инфекционно-воспалительного процесса и соответствовали клинической картине постковидного синдрома на фоне манифестации репликативной активности герпесвирусных инфекций, что было подтверждено при проведении ПЦР (табл. 7).
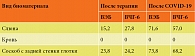
У всех пациентов ГИ 1 и ГИ 2 была проведена количественная детекция генома возбудителей герпесвирусных инфекций с помощью ПЦР в условиях реального времени в слюне, соскобе с миндалин и задней стенки глотки, а также в крови. В биоматериалах обнаружено значительное количество копий генома этих вирусов, что свидетельствовало об их активации (табл. 8).
В соответствии с выявленными ранее нарушениями в иммунологическом профиле для каждой группы пациентов, как ГИ 1, так и ГИ 2, был проведен повторный курс противовирусной терапии в сочетании с ТИИТ, способствовавшей регрессу основных симптомов АХА-ГВИ, а именно СХУ, выраженных когнитивных расстройств, фибромиалгий и артралгий, когнитивных нарушений (табл. 9 и рис. 5), что было определено с использованием пятибалльной шкалы.
Обсуждение результатов
Нами были получены данные о наличии различных дисрегуляторных нарушений в системе противовирусной иммунной защиты и системе ИФН у пациентов с АХА-ГВИ, которые наряду с клиническими симптомами/признаками, ассоциированными с СХУ и когнитивными расстройствами, формируют состояние иммунокомпрометированности. Так, доминирующим нарушением в иммунной системе было снижение индуцированной продукции ИФН-α, детектируемое в 100,0% случаев.
Данная особенность дефектного функционирования основного звена врожденной противовирусной иммунной защиты организма ассоциирована с высоким риском инфицирования и реинфицирования/коинфицирования различными вирусными патогенами, тропными преимущественно к эпителию слизистых оболочек дыхательных путей, в частности возбудителям ОРВИ, вирусу гриппа и SARS-CoV-2.
Дефекты продукции ИФН-α имеют как локальные, так и системные проявления, что клинически выражается снижением активности мукозального иммунитета и, как следствие, рекуррентными инфекциями ЛОР-органов, инфекциями урогенитального тракта, желудочно-кишечного тракта (преимущественно смешанной этиологии – вирусно-бактериально-грибковыми), частым рецидивированием ВПГ-1/ВПГ-2-инфекций (до 10–12 раз в год), развитием дисбиотических нарушений различных биотопов, высоким риском возникновения аутоиммунных/аутовоспалительных нарушений и аллергических реакций вследствие нарушения барьерных функций кожи и слизистых оболочек. Кроме того, наблюдаются сочетанные нарушения функционирования эффекторов врожденного и адаптивного иммунитета: снижение количества НГ (стойкие нейтропении) – 46,3 и 87,3% пациентов ГИ 1 и ГИ 2 соответственно, дефицит CD3+CD56+ – у 83,2 и 53,2%, дефицит ЕКК – у 76,7 и 36,7%. В обеих группах выявлена неадекватность иммунного ответа на наличие вирусной инфекции.
Разработанная нами ИПРИС, включающая ТИИТ, основанную на применении пролонгированной локальной и системной ИФН-терапии (прерывистыми курсами) с использованием геля и суппозиториев рИФН-α-2b в комплексе с антиоксидантами, в частности Вифероном, с целью восстановления локальной и системной продукции ИФН обоих типов и иммуномодулирующей терапии синтетическим аналогом активного центра гормона тимопоэтина гексапептидом (препаратом Имунофан®) с целью коррекции регулярного дисбаланса в иммунной системе (в частности, дефицита CD3+CD8+ цитотоксических Т-лимфоцитов) и глюкозаминилмурамилдипептидом (препаратом Ликопид®), направленную на коррекцию нейтропении и функции ЕКК, продемонстрировала положительные клинические эффекты.
Так, согласно оценке выраженности клинических симптомов/признаков по разработанной нами шкале, у пациентов, страдающих АХА-ГВИ, ассоциированной с СХУ и когнитивными расстройствами, отмечалось уменьшение выраженности клинических проявлений более чем в два раза.
Наблюдалась выраженная позитивная динамика и коррекция дисрегуляторных нарушений в системе противовирусной иммунной защиты и системе ИФН: снижение частоты встречаемости нарушений индуцированной продукции ИФН обоих типов. Однако наиболее выраженная динамика зафиксирована в отношении репарации синтеза ИФН-α. У пациентов ГИ 1 и ГИ 2 значительно снизилась частота встречаемости дефектов НГ – с 46,3 до 24,2 и с 87,3 до 26,5% соответственно, дефицита ЕКК – с 76,7 до 36,1 и с 36,7 до 19,1%, дефицита субпопуляций CD3+CD56+ – с 83,2 до 48,2 и 53,2 до 38,2%. Неадекватность иммунного ответа на наличие вирусной инфекции до лечения имела тенденцию к регрессу в обеих группах.
Кроме того, выявлено положительное и протективное влияние проводимой ИПРИС с использованием программ таргетной ИФН-терапии на течение COVID-19 у пациентов с АХА-ГВИ. Так, в ГИ не было зафиксировано тяжелых случаев инфекции, а в структуре степени тяжести инфекции преобладали легкие формы (57,0%).
Однако течение постковидного периода у этих пациентов было ассоциировано с активацией ГВИ, что имело соответствующие клинические проявления и было подтверждено выявлением репликативной активности герпесвирусов при проведении ПЦР. Полученные нами данные об активации ГВИ в постковидном периоде находят подтверждение в работах зарубежных и российских авторов [17, 18, 27, 28].
Для каждой группы пациентов был проведен повторный курс противовирусной – противогерпетической терапии в сочетании с ТИИТ. По ее окончании выявлен регресс основных симптомов АХА-ГВИ: СХУ, выраженных когнитивных расстройств, фибромиалгий и артралгий, когнитивных нарушений и др.
Указанная особенность течения постковидного периода, связанная с активацией ГВИ, обусловлена способностью SARS-CoV-2 подавлять систему ИФН и обеспечивать персистирующим латентным герпесвирусам возможность перехода из состояния латенции в состояние литической инфекции с последующим возникновением клинических проявлений активации вируса, формирующих симптомокомплекс постковидного синдрома, что также находит отражение в работах зарубежных авторов [29]. Выявленные в этот период маркеры репликативной активности ВЭБ и ВЧГ-6 у пациентов с АХА-ГВИ, перенесших COVID-19, ассоциированные с клиническими проявлениями СХУ, могут быть трактованы как этиопатогенетический фактор индукции постковидного синдрома.
Заключение
Наличие у герпесвирусов механизмов, позволяющих образовывать стойкие ассоциации (микст-инфекции), вызывать нарушения в системе противовирусной защиты организма и системы ИФН, ускользать от иммунного ответа, представляет серьезную проблему для иммунокомпрометированных лиц с АХА-ГВИ. Решение этой проблемы требует разработки персонифицированных программ ТИИТ с учетом имеющихся особенностей дисрегуляции в иммунной системе.
Полагаем, что только комплексный подход к лечению АХА-ГВИ с использованием разработанной нами ИПРИС, органично включающей в числе других лечебных мероприятий комбинированную пролонгированную дифференцированную ТИИТ, прерывистую пролонгированную противовирусную терапию, позволит не только значительно улучшить состояние пациентов, способствовать регрессу СХУ, когнитивных расстройств, фибромиалгии, артралгии, восстановлению работоспособности, но и повлиять на клиническое течение и исход COVID-19.
I.V. Nesterova, MD, PhD, Prof., E.O. Khalturina, PhD, V.V. Malinovskaya, MD, PhD, Prof.
Peoples' Friendship University of Russia
Clinical and Diagnostic Center 'MEDSI on Belorusskaya', Moscow
I.M. Sechenov First Moscow State Medical University
N.F. Gamaleya National Research Center for Epidemiology and Microbiology
Contact person: Evgeniya O. Khalturina, jane_k@inbox.ru
The problem of AHA-HVI is associated with the complexity of their diagnosis and treatment, the presence of many clinical masks based on the processes of neuroimmunoinflammation. Supposed that the development of postcovid syndrome in these patients is due to the reactivation of herpesviruses on a base of dysregulatory processes in the immune system (IS) and the IFN system caused by SARS-CoV-2.
Aim – to evaluate the clinical and immunological effectiveness of the Integration Program of the Immune System Rehabilitation (IPISR), which included targeted interferon and immunomodulatory therapy (TIIT), for patients with ACA-HVI before and during COVID-19, as well as in the post-covid.
Materials and methods. The study group included 35 patients of both sexes aged 25–60 years with AHA-HVI treated with IPRIS. This patients were suffered COVID-19 on the base of the ongoing IRPIS, which included only IFN-therapy. The recurrence of AHA-HVI was observed in 2–4 weeks after discontinuation of IFN-therapy and therefore IPRIS was repeated.
Results. Patients with ACA-HVI were assessed for clinical symptoms associated with CFS and cognitive disorders before, after IPRIS and in the post-covid using the developed scale. Disorders in the antiviral immune defense system and the IFN system were detected: a decrease in induced IFN-α production – 100%; a reduction in the number of NGs; deficiency of CD3+CD56+ and NKC. According the prevailing disorders in IS, we created de novo IPRIS, which, along with other medical measures, was included TIIT and showed high clinical and immunological effectiveness before, during COVID-19, in the post-covid.
Conclusion. An integrated approach to the ACA-HVI treatment with using developed IPRIS will make it possible to improve the condition of immunocompromised patients, contributes to the regression of CFS, cognitive disorders, restore the patient's performance and has a positive influence on the clinical features and outcome of COVID-19.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.