Течение инфекции мочевой системы у детей раннего возраста на фоне острой респираторной вирусной инфекции
- Аннотация
- Статья
- Ссылки
- English
Введение
В структуре заболеваемости пациентов детского возраста инфекция мочевой системы (ИМС) занимает второе место после острой респираторной вирусной инфекции (ОРВИ). У детей первых трех лет жизни ИМС встречается чаще, чем острая респираторная инфекция [1–4]. Актуальность проблемы развития ИМС на фоне ОРВИ обусловлена высокой распространенностью и риском тяжелых осложнений органов мочевой системы (ОМС) – вплоть до хронической почечной недостаточности (ХПН), а также сложностью разработки специфической противовирусной терапии у детей, что связано с этиологической гетерогенностью, высокой контагиозностью возбудителей и изменчивостью антигенных свойств вирусов [5–8].
ОРВИ у детей раннего возраста способствует напряженности иммунного ответа и провоцирует наслоение бактериальной инфекции, в том числе с развитием пиелонефрита и инфекции дистальных отделов мочевой системы.
Особенности иммунного ответа у детей до трех лет
Сниженные показатели иммунного ответа у детей грудного возраста считаются приспособительным защитным механизмом от слишком бурных цитокиновых реакций. Часть пассивной защиты обеспечивается посредством иммуноглобулинов, содержащихся в грудном молоке. Однако этого бывает недостаточно для защиты от инфекций.
В процессе становления иммунитета у детей грудного возраста выделяют два критических периода. Первый – период новорожденности – до 29 дней жизни, когда организм ребенка защищен только материнскими антителами, полученными через плаценту и с грудным молоком [9, 10]. Чувствительность новорожденного к бактериальным и вирусным инфекциям в этот период очень высока. Особую группу риска среди новорожденных составляют недоношенные [11]. Второй период – четыре – шесть месяцев жизни. Он характеризуется утратой полученных от матери антител, слабым синтезом иммуноглобулина (Ig) M. Недостаточность местной защиты слизистых оболочек связана с более поздним накоплением секреторного IgA. Как следствие, чувствительность ко многим воздушно-капельным и кишечным инфекциям очень высокая.
В период новорожденности присутствует как врожденный, так и адаптивный иммунный ответ [12]. Первый характеризуется сниженной продукцией интерферона (ИФН), выработкой несостоятельного, раннего ИФН-альфа, склонностью к незавершенному фагоцитозу, слабой реакцией на бактериальные антигены, второй – избыточным уровнем супрессорных Т-клеток, низкой цитотоксической активностью CD8+-лимфоцитов и натуральных киллеров (NK-клеток), сниженным количеством плазматических клеток при нормальном содержании В-лимфоцитов (клеточное звено), отсроченным синтезом антител, циркуляцией материнских IgG – до шести месяцев, недостаточностью IgA-синтезирующих плазматических клеток (гуморальное звено).
Особенностями иммунитета у детей грудного возраста считаются восстановление уровня IgM, синтез собственного IgG только к шести месяцам, повышенное соотношение CD4+- и CD8+-лимфоцитов, относительная незрелость Т-клеток, низкая способность к формированию клеток памяти, относительный дефицит IgA.
Третий критический период становления иммунитета у детей приходится на второй год жизни, когда значительно расширяются контакты ребенка с внешним миром. Иммунная система функционирует полноценно, активируется функция лимфоцитов, появляется значительное количество IgG, начинает формироваться собственный долговременный иммунитет. Однако по-прежнему сохраняется дефицит местных защитных факторов. Доказательством тому служит высокая восприимчивость к бактериальным и вирусным возбудителям [13].
Таким образом, у детей раннего возраста ослаблены все основные механизмы неспецифической защиты организма от патогенных бактерий и вирусов, чем объясняется высокая чувствительность к бактериальным и вирусным инфекциям с развитием тяжелого инфекционного заболевания, осложнений и генерализацией инфекции.
ИМС: определение, классификация
Под термином «инфекция мочевой системы» понимаются инфицированность и воспалительные изменения любых отделов мочевой системы без специального указания на ее уровень (мочевыделительный тракт или почечная паренхима) [14].
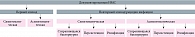
В настоящее время единой классификации ИМС не существует. Это объясняется различными подходами к систематизации: осложненная или неосложненная инфекция, персистенция инфекции или реинфекция, симптоматическая или асимптоматическая (рисунок) [6].
Сохраняющаяся бактериурия, как правило, результат неадекватно пролеченной инфекции. Наиболее частая причина этого – устойчивость микробов к применяемому препарату.
Персистенция бактерий или реинфекция – инфекции, выявленные после задокументированных отрицательных посевов мочи. Реинфекция в отличие от персистенции вызывается другим микроорганизмом. Персистенция обычно встречается у детей с анатомическими нарушениями мочевой системы.
За рубежом также распространена классификация J. Winberg (1987) [15, 16], согласно которой ИМС подразделяют в зависимости:
1) от уровня поражения:
- инфекция верхних мочевых путей (пиелонефрит);
- инфекция нижних мочевых путей (цистит, уретрит);
2) клинических проявлений:
- симптоматическая;
- бессимптомная (изолированная бактериурия);
3) наличия факторов, осложняющих течение и способствующих рецидивированию ИМС:
- осложненная;
- неосложненная;
4) течения:
- острая;
- хроническая:
а) редко рецидивирующая;
б) часто рецидивирующая;
в) непрерывно рецидивирующая.
Эпидемиология
Инфекция мочевой системы, объединяющая пиелонефрит, цистит, уретрит и асимптоматическую бактериурию, – наиболее частая из всех нефропатий в детском возрасте [12, 14, 17]. Ежегодные популяционные исследования свидетельствуют о неуклонном росте заболеваемости среди детей. По данным Росстата, в последние десять лет распространенность нефропатий среди детей до 14 лет увеличилась в 1,6 раза, подростков – в два раза [18].
ИМС занимают ведущее место в структуре заболеваний детского возраста и составляют 18 случаев на тысячу детского населения [14].
Малосимптомность и неспецифичность клинических проявлений заболеваний почек и мочевыводящих путей у детей первых трех лет жизни затрудняют раннюю диагностику. В результате адекватная терапевтическая коррекция запаздывает и процесс переходит в хронический [19–21].
Развитие патологии ОМС у детей раннего возраста обусловлено морфофункциональной незрелостью почек, особенно при наличии обструктивных уропатий, инфекции, гипоксических состояний, реанимационных мероприятий в анамнезе [14, 22].
Этиология и патогенез
Бактерии, грибы, вирусы и оппортунистическая флора могут быть этиологическими факторами развития ИМС. Наиболее частыми возбудителями считаются представители семейства Enterobacteriaceae, главным образом Escherichia coli – обнаруживается примерно в половине случаев (от 41,3 до 83,3% в зависимости от региона) [23]. Затяжное и рецидивирующее течение пиелонефрита может быть связано с воздействием микоплазм, хламидий, грибов рода Candida. У детей раннего возраста пиелонефрит развивается, как правило, при нарушении уродинамики или нестабильности цитомембран.
Особенности макроорганизма также предопределяют высокий риск инфекционно-воспалительных заболеваний мочевой системы. Прежде всего это наличие малых или больших врожденных аномалий органов мочевой системы и нарушение уродинамики. Установлено, что в 90,3% случаев в основе развития пиелонефрита лежат морфологические аномалии развития мочевого тракта [14, 24].
В развитии острого цистита и пиелонефрита также доказана роль вирусов. Они провоцируют обострение воспалительного процесса в органах мочевой системы с последующей бактериальной инвазией.
Сказанное позволяет выделить основные причины этиологической значимости вирусов в развитии ИМС у детей [25]:
- особенности созревания иммунной системы ребенка (достигает уровня развития взрослого человека к 10–12 годам);
- высокая контагиозность вирусных инфекций;
- нестойкий иммунитет к ряду возбудителей;
- разнообразие вирусных сероваров;
- подавляющее действие ряда вирусов на продукцию интерферонов посредством блокирования интерфероновых рецепторов.
Основной способ передачи вирусов – воздушно-капельный. В неменьшей степени они передаются контактно-бытовым путем, в частности через грязные руки.
Наиболее характерным для детского возраста является восходящий путь проникновения инфекции в мочевую систему. Гематогенное инфицирование свойственно новорожденным и детям первых месяцев жизни со сниженным иммунитетом. Убедительных данных о наличии лимфогенного пути передачи инфекции пока не получено.
Важным фактором, способствующим развитию ИМС, считается периуретральная колонизация. Микроорганизмы могут проникать в мочевой пузырь, минуя уретру, – транслокация из кишечника [6].
Однако решающее значение в развитии микробно-воспалительного процесса в почках имеют нарушения уродинамики [26–28].
Клиническая картина
Как уже отмечалось, наиболее часто пиелонефрит у детей раннего возраста протекает латентно, без явных клинических проявлений или малосимптомно, что приводит к поздней диагностике – вплоть до развития ХПН [14, 17, 29, 30].
У большинства новорожденных с ИМС доминируют неспецифические признаки: симптомы интоксикации, субфебрилитет, слабое сосание, недостаточная прибавка массы тела, дисфункция кишечника. У детей до пяти лет с ИМС отмечаются отсутствие аппетита, рвота, диспепсические расстройства, боли в животе без определенной локализации и т.д. [6, 14].
Латентное течение пиелонефрита во многом объясняется снижением иммунных сил. В раннем детском возрасте часто наблюдается генерализация инфекции. Быстрая и значительная деструкция ткани у новорожденных является следствием даже острого воспалительного пиелонефритического процесса.
Диагностика
К основным лабораторным анализам, подтверждающим течение пиелонефрита, относятся:
- общий анализ мочи. Обычно выявляются лейкоциты от 15–20 (что более характерно для патологии дистальных отделов мочевой системы) до сплошь все поля зрения (чаще встречается при пиелонефрите), бактерии, отмечается нейтральная или щелочная реакция мочи, ее мутность, наличие солей, умеренное количество белка – от следового до 0,06 г/л (однако при пороках развития почек, наличии пузырно-мочеточникового рефлюкса протеинурия может быть более выраженной);
- клинический анализ крови, результатами которого подтверждается воспалительный характер патологического процесса: лейкоцитоз и увеличение СОЭ;
- посев мочи. Наиболее часто высеваемый возбудитель – кишечная палочка, реже клебсиелла, синегнойная палочка, протей.
Для ИМС прежде всего характерна бактериурия. Рост более 105 КОЕ/мл в свежевыпущенной моче – главное отличие бактериурии от контаминации.
Что касается оценки результатов посева мочи у детей, необходимо отметить следующее. За рубежом у детей первого года жизни распространено исследование мочи, полученной путем надлобковой пункции мочевого пузыря. Любой рост бактерий, выявляемый при данном методе забора мочи, считается значимым в плане развития ИМС. В России данный метод не нашел широкого применения. Диагностически значимо выделение 103 КОЕ/мл в моче, полученной при катетеризации мочевого пузыря. При выделении микроорганизма в монокультуре из свежевыпущенной мочи (собранной в стерильную емкость при свободном мочеиспускании) в титре > 105 КОЕ/мл он может считаться этиологически значимым даже в отсутствие характерной клинической картины ИМС. Если образец взят у ребенка с симптомами инфекции органов мочевой системы или в период приема антибактериальных препаратов, выделение возбудителя даже в титре > 102 КОЕ/мл может считаться этиологически значимым. У новорожденных этот уровень не достигается в связи с более коротким периодом присутствия бактерий в моче, поэтому повторный высев одного и того же возбудителя (независимо от количества) у детей первых трех месяцев жизни должен рассматриваться как бактериурия, особенно при наличии других симптомов инфекции ОМС [31–33].
К дополнительным методам обследования детей относят выявление более редких возбудителей инфекции (хламидий, микоплазм, уреаплазм, грибов, микобактерий туберкулеза), исследование гуморального и клеточного иммунитета. Установить наличие пиелонефритического процесса позволяют биохимическое исследование мочи, выявляющее нарушения канальцевой функции почек (снижение ацидоаммониогенеза, оксалурия, уратурия, фосфатурия и кальциурия); биохимический анализ крови, показывающий степень активности воспалительного процесса и функцию почек (белок, фракции, мочевина, С-реактивный белок); ультразвуковое исследование (УЗИ) почек, выявляющее аномалии развития почек. По результатам УЗИ также можно установить увеличение размера почек, снижение (в острую фазу) или повышение эхогенности их паренхимы, оценить интраренальную гемодинамику (дуплексное допплеровское сканирование и допплерография почечных сосудов). Высокая чувствительность метода позволяет обнаружить инфильтративно-склеротические процессы в почечной паренхиме на ранних этапах и обеспечивает возможность длительного динамического наблюдения за пациентами с пиелонефритом [6, 34, 35]. При проведении цистографии устанавливается наличие пузырно-мочеточникового рефлюкса и клапана задней уретры, урографии и реносцинтиграфии почек – нарушение их функции [5, 31–33, 36]. Результаты исследования A. Hoberman и соавт. [37] подтвердили высокую распространенность уродинамических нарушений у детей раннего возраста. Так, у 39% детей с инфекцией ОМС диагностирован пузырно-мочеточниковый рефлюкс. Динамическая нефросцинтиграфия проводится для визуализации и оценки функционального состояния почек (степени перфузии органа, скорости клубочковой фильтрации, выделительной функции). Статическую сцинтиграфию рекомендуют для определения количества функционирующей паренхимы, наличия очаговых образований (рубцов) в почке, позволяющих диагностировать рефлюкс-нефропатию [37, 38].
Результаты исследований последних лет свидетельствуют о значительном повышении уровня прокальцитонина в плазме крови у детей с ИМС [39]. При этом специфичность определения прокальцитонина для инфекций мочевой системы составляла 89,7%, для С-реактивного белка – 18,5%. Кроме того, прокальцитонин может рассматриваться как высокочувствительный маркер развития нефросклероза.
Лечение и профилактика рецидивов
Принципы терапии ИМС у детей можно разделить на общие и специальные. К общим относятся соблюдение режима, диеты, лечебная физкультура, массаж, гигиенические мероприятия. Питьевой режим рекомендуется расширить на 50% (вода, бледный зеленый чай, клюквенный морс).
К специальным:
- безотлагательное назначение антибактериальных препаратов, к которым чувствительны основные возбудители и которые выводятся почками в неизмененном виде;
- длительная антимикробная профилактика при обнаружении пузырно-мочеточникового рефлюкса и рецидивировании инфекции органов мочевой системы (данный принцип обсуждается, в том числе на страницах журнала Pediatric Nephrology);
- своевременная коррекция нарушений уродинамики (устранение органических и функциональных нарушений) и моторики кишечника;
- противогрибковая и противовирусная терапия;
- десенсибилизирующая и мембраностабилизирующая терапия;
- иммунокорригирующая и антисклеротическая терапия.
От выбора стартовой антимикробной терапии ИМС зависят эффективность лечения и общий прогноз.
В настоящее время в качестве этиотропной терапии предпочтение отдается цефалоспоринам второго и третьего поколения и защищенным пенициллинам, то есть антибактериальным препаратам широкого спектра действия, способным подавлять как грамотрицательную, так и грамположительную флору [7, 23, 31–33, 40]. Пероральные цефалоспорины можно применять в амбулаторных и стационарных условиях, парентеральные – преимущественно в условиях стационара [23]. При наличии положительных посевов мочи используются антибактериальные препараты, к которым чувствительна высеваемая флора. При необходимости проводится смена антибактериального препарата.
При пиелонефрите курс лечения составляет 10–14 дней, при цистите – семь дней [5, 32, 36]. При цистите целесообразно использовать пероральные антимикробные препараты, которые выводятся преимущественно почками и создают максимальную концентрацию в мочевом пузыре.
Нормализации уродинамики способствуют такие рутинные мероприятия, как повышенный водный режим, принудительное мочеиспускание, регулярное опорожнение мочевого пузыря, в том числе двойное на ночь (в зависимости от возраста).
По окончании антибактериальной терапии и санации мочи рекомендуется назначение уроантисептиков.
Профилактика рецидивов ИМС у детей раннего возраста предполагает:
- потребление адекватного количества жидкости;
- контроль за анализами мочи;
- устранение расстройств мочеиспускания и запоров;
- режим принудительных мочеиспусканий.
Длительное или рецидивирующее течение пиелонефрита у детей раннего возраста требует проведения полного нефроурологического обследования для выявления признаков функциональной или органической обструкции.
При внутриутробной инфекции, часто болеющим детям, а также в случае смешанной этиологии инфекции мочевой системы или протекающей на фоне ОРВИ рекомендована противовирусная терапия.
Диспансерное наблюдение детей с ИМС предполагает проведение осмотров педиатром один раз в один-два месяца, нефрологом один раз в три месяца, клинического анализа мочи один раз в месяц (в том числе при интеркуррентных заболеваниях), лечение вульвита, уретрита и др. Длительность наблюдения – один год.
Учитывая несостоятельность иммунной системы, разнообразие и изменчивость возбудителей, высокую восприимчивость к инфекционным заболеваниям, в том числе ограниченное количество применяемых лекарственных препаратов, необходимо тщательно подходить к выбору терапии у новорожденных и детей первого года жизни. Препараты, применяемые для лечения ОРВИ в этой популяции, должны характеризоваться доказанной эффективностью и хорошим профилем безопасности.
Интерфероны
Наиболее изученной группой иммуномодулирующих препаратов, разрешенных к применению у детей с рождения, являются интерфероны. Данная группа препаратов обладает выраженным противовирусным действием [41–43].
В период новорожденности в сыворотке крови циркулирует значительное количество ранних ИФН. Ранние ИФН отличаются по физико-химическим и, что особенно важно, биологическим свойствам от ИФН, синтезируемых клетками взрослого организма. Они более гидрофобны, характеризуются сниженными противовирусными, антипролиферативными и иммуномодулирующими свойствами. Однако именно быстрые ИФН-альфа вносят основной вклад в противовирусную защиту организма. Поздние ИФН-гамма, начинающие работать через несколько часов от начала инфицирования, оказывают менее выраженный противовирусный эффект. Они выполняют роль связующего звена между компонентами врожденного и адаптивного иммунного ответа. У новорожденных в становлении противоинфекционной защиты организма принимает участие только гамма-звено интерфероновой защиты, активность которого в ряде случаев значительно снижена, особенно у недоношенных [44]. Во многом это определяет целесообразность использования интерферонов при ОРВИ у детей раннего возраста.
В 1967 г. именно в России был разработан и внедрен в клиническую практику человеческий лейкоцитарный интерферон. Результаты проведенных японскими учеными исследований подтвердили эффективность препаратов интерферона, вводимых как ректально, так и перорально [45, 46].
Современные препараты рекомбинантного интерферона, созданные с помощью генной инженерии, в отличие от препаратов лейкоцитарного ИФН позволяют получить большее содержание чистого действующего вещества в лекарственной форме, исключают возможность передачи гемотрансфузионных нескринируемых инфекций, обеспечивают точность дозирования для нивелирования дозозависимых нежелательных реакций.
Механизм действия интерферонов [47]:
- индуцируют синтез фермента, останавливающего транскрипцию и трансляцию, а следовательно, репликацию вируса (непосредственный противовирусный эффект);
- усиливают фагоцитоз, повышают киллерный потенциал эффекторных клеток;
- стимулируют продукцию секреторного IgA;
- способствуют восстановлению цитокинового баланса;
- препятствуют заражению здоровых клеток;
- способствуют иммуномодуляции (опосредованный антибактериальный эффект).
Интерфероны являются гуморальными факторами врожденного звена иммунитета. Быстрые интерфероны 1-го типа, такие как ИФН-альфа-2, оказывают противовирусный эффект уже в первые часы после заражения. Их основная роль состоит в индукции синтеза белков, оказывающих прямое противовирусное действие на трех этапах: прикрепление вируса к мембранам клеток, синтез вирусных частиц и выход готовых вирионов из клетки [48].
Кроме того, ИФН-альфа-2 стимулирует активность эффекторных клеток и таким образом участвует в запуске каскада адаптивного иммунитета и формировании долгосрочной иммунной защиты от герпесвирусной инфекции [49].
Российской фармацевтической компанией БИОКАД разработана новая суппозиторная форма со сниженным содержанием рекомбинантного человеческого ИФН-альфа-2b – Генферон Лайт. В отличие от других детских суппозиторных форм в состав Генферона Лайт вместо аскорбиновой кислоты, способствующей развитию оксалурии, включен таурин, а широко используемое в качестве основы свечи масло какао заменено тугоплавким жиром, не вызывающим местных аллергических реакций.
Таурин – незаменимая аминокислота, образующаяся в организме в ходе метаболизма цистеина [50]. Вещество играет существенную роль в иммунном ответе при инфекционном процессе: обладает иммунотропным действием, противовоспалительной, антиоксидантной активностью, повышает устойчивость клеток к неблагоприятным условиям очага воспаления, предотвращает их гибель [51]. Таурин способен потенцировать специфическое действие ИФН, что в целом обеспечивает повышение эффективности комбинированного лекарственного препарата.
Многие годы таурин как самостоятельный препарат используется в офтальмологии, эндокринологии и неонатологии в качестве антиоксиданта [52, 53]. Таурин также оказывает регулирующее воздействие на центральную нервную систему, что позволяет применять его в неврологической практике в комплексной терапии судорожного синдрома и минимальной мозговой дисфункции [54, 55].
В состав одного суппозитория препарата Генферон Лайт, применяемого у детей от ноля до семи лет, входят ИФН-альфа-2b 125 000 МЕ и таурин 5 мг.
В состав одного суппозитория препарата Генферон Лайт, применяемого у детей старше семи лет, – ИФН-альфа-2b 250 000 МЕ и таурин 5 мг.
Генферон Лайт применяется у детей с первых дней жизни, разрешен во время беременности (с 13-й недели), не содержит масла какао и витамина С.
Схема применения в острый период инфекции у детей – по одной свече ректально два раза в сутки с интервалом 12 часов ежедневно в течение пяти дней [56].
Применение препарата рекомбинантного ИФН-альфа-2b Генферон Лайт патогенетически обосновано на различных стадиях течения ОРВИ у детей, а также рекомендуется для включения в схему терапии ИМС, протекающей у новорожденных и детей раннего возраста с внутриутробной инфекцией, в случае инфекции мочевой системы смешанной этиологии или протекающей на фоне ОРВИ. Использование препарата Генферон Лайт позволяет подобрать оптимальную дозу интерферона в зависимости от возраста и веса ребенка и избежать избыточной лекарственной нагрузки.
Заключение
Дети раннего возраста с инфекцией ОМС должны находиться под наблюдением педиатров и нефрологов в связи с недостаточными клиническими проявлениями заболевания, кроме лихорадки, и более высоким риском развития повреждения почечной ткани, чем у детей старшего возраста [31]. При лечении инфекционно-воспалительных заболеваний как верхних отделов мочевой системы (пиелонефрит), так и дистальных правильный подбор антибактериальных препаратов, применение противогрибковых, противовирусных и антисклеротических препаратов способствуют более быстрому выздоровлению и снижению риска хронизации воспалительного процесса.
O.L. Chugunova
N.I. Pirogov Russian National Research Medical University
Contact person: Olga Leonidovna Chugunova, ol_chugunova@mail.ru
Urinary tract infections in children within the first three years of life associated with acute respiratory viral infection is one of the topical issues in pediatrics. Here, features of etiology, pathogenesis, and clinical picture are discussed depending on age, type of immune response as well as ways for early diagnostics and treatment strategy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.