Псориаз и ожирение. Долгосрочная эффективность ингибитора ИЛ-23 гуселькумаба: данные реальной клинической практики
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить долгосрочную эффективность терапии ингибитором ИЛ-23 гуселькумабом у пациентов со среднетяжелым и тяжелым псориазом и коморбидным ожирением с удержанием ответа на проводимую терапию.
Материал и методы. Проведено ретроспективное исследование 36 пациентов с диагнозом «распространенный вульгарный псориаз». Исходные показатели оценивали по значениям индекса PASI (Psoriasis Area and Severity Index), дерматологического индекса качества жизни (ДИКЖ), индекса массы тела (ИМТ); помимо этого, оценивали антропометрические показатели. Все пациенты получали лечение ингибитором ИЛ-23 гуселькумабом по стандартной схеме. Оценку эффективности терапии осуществляли по динамике показателей PASI, ДИКЖ, ИМТ на исходном уровне и через 12, 24, 52 и 468 недель терапии, а также по частоте достижения пациентами ответа в виде PASI 90 и PASI 100.
Результаты. Биологическая терапия гуселькумабом привела к статистически значимому улучшению всех показателей через 12 недель, ответ у каждого пациента сохранялся на 24, 52 и 468-й неделях (р < 0,001). Продемонстрирована высокая статистическая значимость разницы между исходным уровнем и после терапии гуселькумабом по индексу PASI (p < 0,001). Все пациенты с «суперответом» достигли полного очищения кожи с индексом PASI 100 к 24-й неделе терапии. Изменение показателей индекса PASI привело к статистически значимому улучшению показателей качества жизни по шкале ДИКЖ (p < 0,001). Все пациенты достигли «суперответа» независимо от значений ИМТ.
Заключение. Биологическая терапия ингибитором ИЛ-23 гуселькумабом высокоэффективна для снижения тяжести заболевания независимо от индекса массы тела. Ингибитор ИЛ-23 может быть лучшей терапевтической альтернативой для пациентов со среднетяжелым и тяжелым псориазом и коморбидным ожирением.
Цель исследования – оценить долгосрочную эффективность терапии ингибитором ИЛ-23 гуселькумабом у пациентов со среднетяжелым и тяжелым псориазом и коморбидным ожирением с удержанием ответа на проводимую терапию.
Материал и методы. Проведено ретроспективное исследование 36 пациентов с диагнозом «распространенный вульгарный псориаз». Исходные показатели оценивали по значениям индекса PASI (Psoriasis Area and Severity Index), дерматологического индекса качества жизни (ДИКЖ), индекса массы тела (ИМТ); помимо этого, оценивали антропометрические показатели. Все пациенты получали лечение ингибитором ИЛ-23 гуселькумабом по стандартной схеме. Оценку эффективности терапии осуществляли по динамике показателей PASI, ДИКЖ, ИМТ на исходном уровне и через 12, 24, 52 и 468 недель терапии, а также по частоте достижения пациентами ответа в виде PASI 90 и PASI 100.
Результаты. Биологическая терапия гуселькумабом привела к статистически значимому улучшению всех показателей через 12 недель, ответ у каждого пациента сохранялся на 24, 52 и 468-й неделях (р < 0,001). Продемонстрирована высокая статистическая значимость разницы между исходным уровнем и после терапии гуселькумабом по индексу PASI (p < 0,001). Все пациенты с «суперответом» достигли полного очищения кожи с индексом PASI 100 к 24-й неделе терапии. Изменение показателей индекса PASI привело к статистически значимому улучшению показателей качества жизни по шкале ДИКЖ (p < 0,001). Все пациенты достигли «суперответа» независимо от значений ИМТ.
Заключение. Биологическая терапия ингибитором ИЛ-23 гуселькумабом высокоэффективна для снижения тяжести заболевания независимо от индекса массы тела. Ингибитор ИЛ-23 может быть лучшей терапевтической альтернативой для пациентов со среднетяжелым и тяжелым псориазом и коморбидным ожирением.


Псориаз и ожирение – распространенные хронические заболевания, которые во всем мире поражают людей независимо от пола и возраста [1, 2]. По данным Всемирной организации здравоохранения, с 1975 г. распространенность ожирения во всем мире утроилась, и в настоящее время около 40% взрослых в мире имеют избыточный вес и 13% страдают ожирением (определяется индексом массы тела – ИМТ ≥ 25 кг/м2 или ИМТ ≥ 30 кг/м2 соответственно), а каждый пятый ребенок и подросток во всем мире имеет избыточный вес [3, 4].
Стоит отметить, что на сегодняшний день ожирение является глобальной эпидемией во всем мире и считается независимым фактором риска развития псориаза [5–7]. В свою очередь, пациенты с псориазом более склонны к развитию ожирения из-за генетической предрасположенности, пищевых привычек и нездорового питания, снижения физической активности и психологического стресса, вызванного косметически значимыми, видимыми поражениями кожи [8–10]. Исследования подтверждают, что увеличение веса и ожирение удваивают риск возникновения псориаза [11]. Snekvik и соавт. провели исследование, в котором в течение 10 лет оценивали влияние ИМТ, окружности талии, соотношения талии и бедер и изменения веса на развитие псориаза. Оказалось, что у людей, набравших 10 кг и более, риск развития псориаза выше в 1,72 раза, а у людей с ожирением риск развития псориаза выше в 1,87 раза по сравнению с теми, кто поддерживал постоянный вес [12]. В проспективном исследовании с участием 121 700 женщин-медсестер аналогично была показана связь ожирения с увеличением риска возникновения псориаза в 1,63 раза [13]. С учетом эпидемиологических данных предполагается существование потенциальной общей генетической составляющей между ожирением и псориазом [14–17]. Однако патофизиологическая связь между псориазом и ожирением не совсем ясна, возможно, несбалансированное производство про/противовоспалительных адипокинов жировой тканью способствует развитию вялотекущего хронического воспаления, которое может спровоцировать или усугубить псориаз. Тем не менее иммунологические цитокиновые реакции в воспаленной коже могут изменять метаболизм липидов и глюкозы, способствуя ожирению или усугубляя его [18].
В целом ожирение является отрицательным предиктором эффективности как традиционных, так и биологических препаратов, особенно используемых в фиксированной дозировке. Большинство биологических препаратов для лечения псориаза назначают в фиксированных дозах, включая инфликсимаб, этанерцепт, адалимумаб, секукинумаб и иксекизумаб, за исключением устекинумаба, доза которого должна быть удвоена для пациентов с массой тела более 100 кг. Гуселькумаб, полностью человеческое моноклональное антитело IgG1λ, нацеленное на субъединицу p19 интерлейкина (ИЛ) 23, продемонстрировал многообещающие результаты в клинических исследованиях (VOYAGE 1 и 2), в которых его сравнивали с адалимумабом и плацебо и результаты которых показали устойчивую и более высокую эффективность во всех весовых категориях по сравнению с адалимумабом и плацебо [19, 20]. Более того, нет доказательств, что гуселькумаб увеличивает массу тела или изменяет метаболизм липидов или глюкозы [21].
Цель исследования – оценить долгосрочную эффективность и безопасность терапии ингибитором ИЛ-23 гуселькумабом у пациентов со среднетяжелым и тяжелым псориазом и коморбидным ожирением в реальной клинической практике.
Материал и методы
Проведено одноцентровое экспериментальное неконтролируемое исследование пациентов с распространенным бляшечным псориазом. Пациенты были включены в исследование в период с апреля 2015 г. по июнь 2024 г. и получали гуселькумаб 100 мг на 0-й, 4-й неделях и далее каждые восемь недель.
Критерии включения в исследование:
- возраст от 18 лет;
- средняя степень тяжести псороиаза (Psoriasis Area and Severity Index (PASI) от 10 до 20 баллов);
- тяжелая степень тяжести псориаза (PASI выше 20 баллов);
- поражение псориазом более 10% поверхности тела (Body Surfase Area, BSA);
- оценка изменений кожи врачом (static Physician Global Assessment, sPGA) более 3 баллов;
- часть пациентов были бионаивными и не получали лечения генно-инженерными биологическими препаратами (ГИБП) до начала терапии;
- часть пациентов были неответчиками на терапию ингибиторами фактора некроза опухоли альфа (ФНО-α) (адалимумаб), ингибитором ИЛ-17 (иксекизумаб);
- прохождение тестирования по шкалам PASI, BSA, sPGA, DLQI и оценка интенсивности зуда (ВАШ) до начала и через 12, 24, 52 и 468 недель после лечения;
- добровольное желание принимать участие в исследовании, подписанное информированное согласие с общим планом обследования и лечения.
Критерии невключения в исследование:
- наличие сопутствующих соматических, а также инфекционных заболеваний в стадии декомпенсации, онкологические заболевания, наркомания, алкоголизм, гипертиреоз;
- нарушения со стороны системы кроветворения в анамнезе (клинически значимая анемия, тромбоцитопения, лейкопения, гипоплазия костного мозга);
- беременность, период лактации.
Критерии исключения из исследования:
- добровольное желание пациента завершить участие в исследовании;
- несоблюдение пациентом режима, а также назначенной схемы диагностики и терапии.
Для установления диагноза проводили клинико-анамнестическое обследование (сбор жалоб, анализ анамнеза жизни и заболевания, полное физикальное обследование, оценка показателей жизненно важных функций, антропометрических данных – массы тела и роста, индекса массы тела (ИМТ), наличие сопутствующих заболеваний, определение времени с момента постановки диагноза, анализ предшествующей терапии, оценка клинических проявлений и определение их степени тяжести) c учетом индекса PASI.
Для диагностики ожирения рассчитывали ИМТ (от 25 до 29 – избыточная масса тела, от 30 до 34 – ожирение первой, от 35 до 39 – второй, 40 и более – третьей степени) [22].
Оценку степени тяжести псориаза, эффективности терапии, нежелательных явлений осуществляли по динамике показателей PASI, ДИКЖ и ИМТ на 0, 12, 24, 52 и 468-й неделях лечения. Также были сделаны цифровые фотографии больных до начала и после окончания терапии.
До назначения инъекций гуселькумаба у всех пациентов получены образцы крови и мочи для лабораторных исследований: клинический и биохимический анализ крови, липидный спектр, серологическое исследование на ВИЧ, антикардиолипиновый тест/исследование суммарных антител IgG, IgM к антигенам Treponema pallidum, качественный тест на HbsAg, определение суммарных антител к антигенам вируса гепатита С (Anti-HCV-total), общий анализ мочи. Всем пациентам была выполнена цифровая рентгенография грудной клетки в двух проекциях с описанием, проведена внутрикожная проба с туберкулезным аллергеном (диаскинтест)/квантифероновый тест для исключения туберкулезной инфекции – до назначения терапии, на 24-й, 52-й неделях терапии и далее в период последующего наблюдения один раз в 12 месяцев.
При каждом посещении на 0, 12, 24, 52, 468-й неделях оценивали рутинные анализы крови (общий клинический анализ крови с лейкоцитарной формулой и скоростью оседания эритроцитов, биохимический анализ крови: трансаминазы, гамма-глутамилтрансфераза, общий белок, щелочная фосфатаза, глюкоза, С-реактивный белок, липидограмма), общий анализ мочи для подтверждения безопасности ингибитора ИЛ-23 гуселькумаба.
Сбор данных, их последующую коррекцию, систематизацию исходной информации и визуализацию полученных результатов осуществляли в электронных таблицах Microsoft Office Excel (2016). Статистическую обработку результатов проводили средствами языка программирования Python (v. 3.12, Python Software Foundation, https://www.python.org/). Количественные показатели оценивали на предмет соответствия нормальному распределению с использованием критерия Шапиро – Уилка. Проверка на нормальность распределения показала, что данные в исследовании не имеют нормального распределения. Поэтому в дальнейшем расчеты производили методами непараметрической статистики. В случае описания количественных показателей, имеющих распределение, отличное от нормального, в качестве центра распределения была определена медиана, а в качестве показателей вариации – квартили (Me [Q1; Q3]). Для сравнения двух несвязанных выборок использовали U-критерий Манна – Уитни. Для проверки различий между двумя сравниваемыми парными выборками применяли W-критерий Уилкоксона. При сравнении более двух зависимых совокупностей использовали непараметрический критерий Фридмана. В случае описания количественных показателей, имеющих нормальное распределение, проводили расчет средних арифметических величин (M) и стандартных отклонений (SD). При сравнении средних величин двух несвязанных выборок рассчитывали t-критерий Стьюдента. При сравнении средних показателей между двумя сравниваемыми парными выборками (например, значений показателя до лечения и после лечения) использовали парный t-критерий Стьюдента. Для сравнения трех и более связанных групп пациентов применяли однофакторный дисперсионный анализ с повторениями. Для проверки гипотезы о том, что среднее значение выборки отличается от заданного значения (например, от нуля) использовали t-тест для одной выборки. Результаты качественных признаков выражены в абсолютных числах с указанием долей (%). Сравнение номинальных данных в группах проводили при помощи критерия χ2 Пирсона. В тех случаях, когда число ожидаемых наблюдений в любой из ячеек четырехпольной таблицы было менее 10, для оценки уровня значимости различий использовали точный критерий Фишера. С целью изучения взаимосвязи между явлениями, представленными количественными данными, использовали непараметрический метод – расчет коэффициента ранговой корреляции Спирмена (Rs), для дихотомических переменных – коэффициент корреляции Мэтьюса (Rm). Интерпретацию полученных значений корреляции проводили по шкале Чеддока: слабая – от 0,1 до 0,3; умеренная – от 0,3 до 0,5; заметная – от 0,5 до 0,7; высокая – от 0,7 до 0,9; весьма высокая (сильная) – от 0,9 до 1,0 [23]. Различия считали статистически значимыми при p ≤ 0,05, использовали двусторонний р-уровень значимости.
Результаты
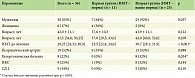
Под нашим наблюдением находились 36 пациентов, из них было 30 (83%) мужчин и 6 (17%) женщин трудоспособного возраста от 18 до 60 лет, в среднем 41,5 [34,0; 50,25] года, возраст дебюта псориаза – от двух до 45 лет, в среднем 27 [20,75; 37,25] лет, то есть манифестация псориаза преобладала у лиц молодого возраста, длительность заболевания варьировала от 1 года до 44 лет, в среднем – 14 [8,0; 20,0] лет. Ожирение было диагностировано у 25 (69,0%) пациентов, ИМТ у пациентов с ожирением был в диапазоне от 30,3 до 35,7.
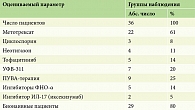
Все пациенты до назначения гуселькумаба получали стандартную базисную противовоспалительную терапию, наиболее часто был назначен метотрексат – 22 (61%) пациента, циклоспорин – 3 (8%) пациента, неотигазон (ацитретин) – 4 (11%) пациента, тофацитиниб (ингибитор янус-киназ) – 5 (14%) пациентов, узкополосная средневолновая терапия с длиной волны 311 нм (УФB-311) – 7 (20%) пациентов, ПУВА-терапия – 9 (25%) пациентов. Предшествующая терапия ГИБП была у 7 (20%) пациентов: лечение ингибиторами ФНО-α получали 5 (14%) пациентов, 2 (5%) пациента прекратили лечение из-за отсутствия ответа на проводимую терапию, 3 (8%) пациента прекратили лечение из-за ускользания ответа через 6 месяцев терапии. Предшествующая терапия ингибитором ИЛ-17 (иксекизумабом) не дала клинического ответа у 2 (5,0%) пациентов. Бионаивными были 29 (80,0%) пациентов, у которых терапия гуселькумабом была первой линией генно-инженерной биологической терапии (табл. 1).
Пациенты были разделены на две группы наблюдения: первую составили 11 (31%) пациентов с псориазом без ожирения, из них 7 (64%) мужчин и 4 (36%) женщины, вторую – 25 (69%) пациентов с ожирением, из них 23 (92%) мужчины и 2 (8%) женщины, в обеих группах преобладали мужчины. Пациенты обеих групп статистически значимо (p > 0,05) не различались по полу (p = 0,057) и возрасту (p = 0,109). Диагноз псориатического артрита был установлен врачом-ревматологом у 19 (52%) пациентов: в первой группе у 6 (32%) пациентов, во второй группе – у 13 (68%) пациентов, то есть чаще псориатический артрит был диагностирован у пациентов с ожирением (р = 0,888). В структуре коморбидной патологии у пациентов второй группы выявлены: гипертоническая болезнь – у 8 (32%) против 0 (0%) (р=0,034) и сахарный диабет второго типа (СД 2) – у 5 (20%), ишемическая болезнь сердца (ИБС) – у 8 (32%) пациентов второй группы и у 1 (9%) пациента первой группы (табл. 2).
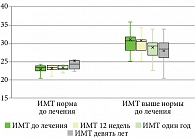
Клиническая оценка степени тяжести псориаза по индексу PASI на исходном уровне в среднем составила 24,9 [19,6; 32,4], n = 36, что соответствует тяжелому псориазу. Выделенные группы статистически значимо (p > 0,05) не различались по индексу PASI на исходном уровне и на протяжении всего периода наблюдения (табл. 3).
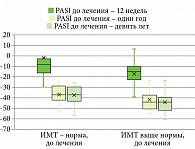
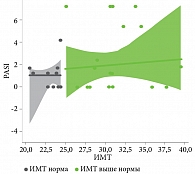
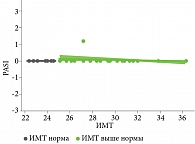
У всех пациентов мы наблюдали значимое улучшение после первой инъекции гуселькумаба, 17 (47%) пациентов к 12-й неделе терапии достигли PASI 90, 19 (53%) пациентов к 12-й неделе лечения гуселькумабом достигли PASI 100. Обе исследуемые группы статистически значимо (p > 0,05) не различались по скорости достижения клинического ответа по индексу PASI, пациенты независимо от индекса массы тела получили почти полное и полное очищение кожи к 12-й неделе терапии, стойкий клинический ответ сохранялся на протяжении всего периода наблюдения (табл. 3, рис. 1–3).
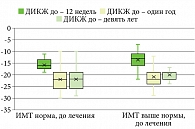
По показателям ДИКЖ не было выявлено статистически значимых различий между группами наблюдения, показатели качества жизни были значительно нарушены в обеих группах независимо от индекса массы тела на начальном этапе наблюдения до назначения терапии гуселькумабом. На фоне терапии гуселькумабом при достижении индекса PASI 90 и 100 показатели индекса качества жизни достигали нормы и сохранялись высокими на протяжении всего периода наблюдения, статистически значимых различий между группами наблюдения выявлено не было (p > 0,05) (табл. 4, рис. 4–6).
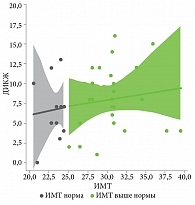
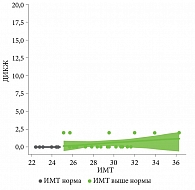
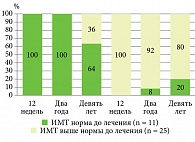
Показатели ИМТ не менялись до 12-й недели терапии гуселькумабом в обеих группах наблюдения. На 52-й неделе терапии гуселькумабом (1 год наблюдения) у 2 (8,0%) пациентов второй группы вес снизился и достиг нормальных значений по индексу массы тела, у 5 (20,0%) пациентов из второй группы через девять лет наблюдения вес снизился до нормальных показателей по ИМТ. У 3 (36,0%) пациентов первой группы вес увеличился через девять лет наблюдения (рис. 7–8).
Для всех вышеперечисленных параметров исследования у больных псориазом было выявлено высокое статистически значимое различие между исходным уровнем и уровнем после терапии гуселькумабом по индексу PASI (p < 0,001). Получено статистически значимое снижение баллов по индексу PASI на фоне терапии гуселькумабом у всех пациентов независимо от наличия коморбидного ожирения, а также от пола, возраста, длительности псориаза, наличия псориатического артрита, сердечно-сосудистых заболеваний. Изменение показателей индекса PASI привело к статистически значимому улучшению показателей качества жизни по шкале ДИКЖ (p < 0,001) в обеих группах наблюдения. Статистически значимых различий между двумя группами по индексу PASI и ДИКЖ до и в процессе наблюдения выявлено не было (p > 0,05).
Обсуждение
Потенциальная связь между псориазом и ожирением на сегодняшний день не вызывает сомнений. Ожирение считается независимым фактором риска развития псориаза, которое может провоцировать раннее начало, усугубить течение заболевания, значительно снизить качество жизни пациентов, изменить ответ на проводимую терапию и модифицировать заболеваемость из-за сокращения продолжительности жизни вследствие сердечно-сосудистых рисков [24–26].
В настоящее время жировая ткань рассматривается как эндокринный орган, адипоциты которого активно синтезируют провоспалительные адипокины (такие как лептин, резистин, висфатин), гормоны, провоспалительные цитокины (в первую очередь ИЛ-6 и ФНО-α) и ингибируют экспрессию противовоспалительного адипокина (адипонектина) и противомикробного пептида. Благодаря ассоциации с различными молекулярными путями жировая ткань признана частью врожденной иммунной системы [27]. Предположительно жировая ткань, особенно висцеральный жир, усиливает хроническое вялотекущее системное воспаление, усугубляющее псориаз [28]. Жировая ткань, кроме адипоцитов, содержит эндотелиальные клетки, фибробласты, макрофаги, миелоидные клетки и Т-клетки. При ожирении доминирующими популяциями иммунных клеток являются провоспалительные клетки, включая Т-хелперы – Th1 и Th17, выраженная инфильтрация которых стимулирует экспрессию воспалительных цитокинов ИЛ-17, ИЛ-22 и интерферона гамма [29]. При псориазе в ответ на повреждение или инфекцию врожденная иммунная активация кератиноцитов способствует рекрутированию нейтрофилов, ангиогенезу и активации дендритных клеток, секретирующих ИЛ-23, который дифференцирует наивные T-клетки в Th 17, продуцирующие ИЛ-17 и ИЛ-22, под воздействием которых возникает гиперпролиферация и аберрантная дифференцировка кератиноцитов с образованием псориатических бляшек, следовательно, в патогенезе псориаза основной фокус направлен на ключевой регулятор ИЛ-23 в иммунной оси ИЛ-23/ИЛ-17A/ИЛ-17F [30, 31]. Таким образом, иммунная дисрегуляция и хроническое воспаление лежат в основе взаимосвязи между псориазом и ожирением.
Среди пациентов с псориазом частота ожирения достигает 20–25% и превышает таковую в общей популяции, а риск ожирения при псориазе, по данным A.W. Armstrong и соавт., возрастает на 50% по сравнению с населением в целом [32]. Среди пациентов, находившихся под нашим наблюдением, ожирение диагностировалось в подавляющем большинстве случаев – у 25 (69,0%) пациентов, ИМТ был в диапазоне от 30,3 до 35,7. Стоит отметить, что ожирение чаще сопровождает пациентов с псориатическим артритом [33]. В нашем исследовании псориатический артрит диагностирован у 68% пациентов с ожирением.
Как правило, ожирение является отрицательным предиктором эффективности как традиционных, так и биологических препаратов, особенно тех, которые используются в фиксированных дозах из-за изменения фармакокинетики и клиренса препаратов, и в то же время ожирение может увеличивать вероятность развития побочных эффектов [34, 35]. Так, ожирение признано фактором риска развития стеатоза, неалкогольной дистрофии и фиброза печени, поэтому при выборе терапии необходимо учитывать риск развития гепатотоксичности при назначении метотрексата [36]. Ацитретин следует применять с осторожностью из-за повышенного риска гиперхолестеринемии и гипертриглицеридемии у пациентов с псориазом и ожирением, особенно с сопутствующим сахарным диабетом или злоупотребляющих алкоголем. Циклоспорин назначается в зависимости от массы тела перорально, однако ожирение, артериальная гипертензия и пожилой возраст могут повышать риск нефротоксичности. Фотохимиотерапию псораленом можно корректировать в зависимости от массы тела, однако пациенты с абдоминальным ожирением более чувствительны к кожным реакциям и ожогам из-за более близкого расположения к лампам и требуют осторожности при выборе дозы УФ-терапии [37].
В нескольких исследованиях была выявлена вероятность отсутствия ответа на проводимую биологическую терапию препаратами с фиксированными дозами (адалимумаб, этанерцепт, устекинумаб в дозе 45 мг) у пациентов с ожирением [38, 39]. При оценке фармакокинетики было показано, что биодоступность ингибиторов ФНО-α может быть снижена у пациентов c избыточной массой тела и ожирением и может наблюдаться значительное увеличение веса после шести месяцев терапии ингибиторами ФНО-α в диапазоне от 4 до 10 кг [40, 41]. T. Torres и соавт. показали, что высокий индекс массы тела отрицательно влияет на выживаемость и эффективность секукинумаба [42]. В исследовании N. Rompoti и соавт. показано, что ожирение было отрицательным предиктором «суперответа» в течение 104 недель терапии бродалумабом (ингибитором ИЛ-17А) [43]. Однако вокруг этих результатов существуют разногласия: в разных исследованиях выявлено увеличение веса, потеря веса или отсутствие значительных изменений в весе.
Ингибитор ИЛ-23 гуселькумаб продемонстрировал многообещающие результаты в клинических исследованиях VOYAGE 1, 2 [44]. В нашей работе была показана высокая эффективность гуселькумаба независимо от индекса массы тела. Все пациенты достигли высокой эффективности с почти полным и полным очищением кожного покрова независимо от индекса массы тела к 12-й неделе терапии, со значительным улучшением показателей качества жизни (ДИКЖ 0/1). Стоит отметить, что при терапии гуселькумабом не требуется увеличение дозы и сокращение кратности введения препарата. Все пациенты независимо от ИМТ получают лечение в стандартной дозе 100 мг подкожно на 0-й, 4-й неделях и далее один раз в восемь недель. За весь период наблюдения побочных или нежелательных явлений зарегистрировано не было. Отмечено снижение веса у пациентов группы с коморбидным ожирением, у 8% пациентов вес достиг нормы к 12-й неделе терапии гуселькумабом и у 20% пациентов вес достиг нормы на 468-й неделе (через девять лет) терапии гуселькумабом, что связано со значительным улучшением качества жизни и изменением образа жизни пациентов (посещение фитнес-клубов, бассейна и т.д.). Стоит отметить, что появляются данные об увеличении периода кратности введения гуселькумаба до 16 недель с сохранением эффективности, вплоть до более длительной отмены препарата с последующим периодом наблюдения [45].
В настоящее время мы получаем все больше данных по применению ингибитора ИЛ-23 гуселькумаба, однако проведенных исследований о влиянии ингибитора ИЛ-23 гуселькумаба на индекс массы тела недостаточно. Необходимо продолжить дальнейшие исследования в данном направлении.
Ограничением исследования являлся его одноцентровой характер.
Заключение
Несмотря на активные разработки новых молекул биологической терапии, лечение псориаза по-прежнему остается одной из самых сложных задач в дерматологии, особенно у пациентов с коморбиными заболеваниями. Гуселькумаб демонстрирует высокую эффективность с достижением полного очищения кожного покрова и удержанием ответа у пациентов со среднетяжелым и тяжелым псориазом и коморбидным ожирением.
Авторы заявляют об отсутствии конфликта интересов.
I.S. Vladimirova, PhD, L.S. Kruglova, PhD, Prof.
Dermatovenerologic Dispensary No 10 – Dermatology and Venereology Clinic, St. Petersburg
S.M. Kirov Military Medical Academy, St. Petersburg
Central State Medical Academy of Department of Presidential Affairs, Moscow
Contact person: Irina S. Vladimirova, ivladimirva@rambler
Psoriasis is a chronic systemic inflammatory disease characterized by the production of multiple proinflammatory cytokines produced by immune cells and interacting with various tissues, which leads to typical clinical manifestations of the disease, extending far beyond skin lesions. Obesity is considered an independent risk factor and accompanies a more severe course of psoriasis, being a negative predictor of therapy effectiveness. The intersection of pathogenesis mechanisms in psoriasis and obesity can exacerbate systemic inflammation and metabolic dysfunction. Due to the enormous progress in understanding the pathophysiology of psoriasis, a key regulator IL-23 in the IL-17/IL-23 immune axis plays a key role in immune dysregulation, which allows for the effective use of these therapeutic targets in psoriasis and comorbid obesity.
Purpose of the study. To evaluate the long-term efficacy of IL-23 inhibitor therapy (guselkumab) in patients with moderate to severe psoriasis and comorbid obesity with maintenance of response to therapy.
Material and methods. A retrospective study of 36 patients diagnosed with widespread psoriasis vulgaris was conducted. Baseline parameters were assessed using PASI, DIQI, and BMI indices. Anthropometric parameters were assessed. All patients received treatment with an interleukin-23 inhibitor (guselkumab) according to the standard regimen. Therapy efficacy was assessed based on the dynamics of PASI, DIQI, and BMI indices at baseline and after 12, 24, 52, and 468 weeks of therapy, as well as the frequency of patients achieving PASI 90 and PASI 100 responses.
Results. Biological therapy with guselkumab resulted in statistically significant improvement in all parameters after 12 weeks and the response was maintained at 24, 52 and 468 weeks for each patient (p < 0.001). High statistical significance of the difference between the baseline and after guselkumab therapy was demonstrated for the PASI index (p < 0.001). All patients with a “superresponse” achieved complete skin clearance PASI 100 by the 24th week of therapy. Changes in PASI index values resulted in statistically significant improvement in quality of life indices according to the DLQOL scale (p<0.001). All patients achieved a “superresponse” regardless of their body mass index.
Conclusion. Biological therapy with the interleukin-23 inhibitor guselkumab is highly effective in reducing the severity of the disease regardless of the body mass index. IL-23 inhibitor may be a better therapeutic alternative for patients with moderate to severe psoriasis and comorbid obesity.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.