количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Алгоритм ведения больных с рецидивирующим простым герпесом
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Дерматовенерология и дерматокосметология" № 2
- Аннотация
- Статья
- Ссылки
В результате обобщения собственного опыта авторов и анализа литературы предлагается патогенетически обоснованный алгоритм выбора тактики и стратегии ведения больных рецидивирующим простым герпесом. Алгоритм базируется на выявленных клинико-иммунологических особенностях разных типов течения вирусного процесса, вариабельности иммунопатогенеза обострений инфекции, а также на корреляционной оценке эффективности различных методов лечения и вторичной профилактики инфекции в зависимости от характера и степени выраженности иммунных нарушений, лежащих в основе реактивации возбудителя.

Таблица 1. Типы иммунопатогенеза обострений простого герпеса

Таблица 2. Соответствие типов иммунопатогенеза обострений простого герпеса и терапевтических подходов
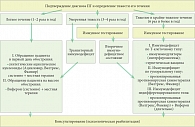
Рис. Графологическая структура алгоритма ведения больных с простым герпесом
Одним из основных практических вопросов, связанных с проблемой простого герпеса (ПГ), в дерматологии продолжает оставаться отсутствие единого подхода к лечению и вторичной профилактике рецидивов инфекции. Несмотря на достаточно большой выбор противогерпетических препаратов, направленных как на купирование обострений, так и на восстановление иммунного контроля над латентным состоянием вируса простого герпеса (ВПГ), их назначение в большинстве случаев остается импирическим. Это, безусловно, отражается на степени эффективности терапии и нередко приводит к дискредитации лекарственных средств. Более того, отсутствие общепризнанных критериев выбора тактики лечения, патогенетически обоснованных подходов к назначению этиотропных или иммунных препаратов не позволяет сегодня реально оценить степень клинической эффективности предлагаемых фармацевтическим рынком лекарственных средств, особенно иммунной направленности.
Мы не раз подчеркивали, что разработка подходов к ведению больных ПГ должна базироваться не только на оценке частоты манифестаций и локализации высыпаний, но и на степени и характере иммунных нарушений, лежащих в основе обострений заболевания, которые достаточно четко коррелируют с тяжестью течения герпесвирусного процесса [3, 4, 6, 7]. Основанием для данного заключения являются выявленные нами особенности иммунных нарушений, в зависимости от частоты рецидивов вирусного процесса, которые легли в основу предложенной в 2000-м г. классификации типов иммунопатогенеза обострений ПГ (табл. 1). Понимание неоднородности нарушений механизмов иммунорезистентности, в результате которых происходит потеря контроля над латентным состоянием ВПГ, позволяет по-новому посмотреть на тактику и стратегию лечения и вторичной профилактики ПГ и предложить патогенетически обоснованный алгоритм ведения больных (табл. 2). Необходимо отметить, что при разработке алгоритма мы учитывали как личный опыт, так и опыт наших коллег, в том числе зарубежных, что позволило аккумулировать два разных подхода (этиотропный и иммунный) в единую концепцию.
Более того, наше отношение к вопросу не как к чисто дерматологической проблеме, а как к системной герпетической болезни, а также многочисленные совместные исследования с психоневрологами, гинекологами, урологами, эндокринологами и другими специалистами дали возможность унифицировать не только терапевтическую тактику, но также объем и направленность обследования пациентов [5, 10, 12].
Основополагающими моментами, лежащими в основе алгоритма, являются клинико-иммунологические критерии выбора стратегии и тактики ведения пациента; клинико-анамнестические признаки, дающие основания для его дополнительного обследования; подход к консультированию и психореабилитации больных ПГ.
Первым этапом работы с пациентом является верификация диагноза. Несмотря на кажущуюся банальность, это далеко не всегда простая задача, так как наряду с типичными формами мы сегодня все чаще сталкиваемся с клиническим патоморфозом ПГ, особенно при его генитальной локализации [6, 8].
К сожалению, лабораторная диагностика ВПГ в настоящее время далека от совершенства. Поэтому в случаях необычных клинических проявлений заболевания лучше отталкиваться от оценки жалоб и анамнеза заболевания. Наиболее важными диагностическими критериями являются наличие предвестников обострения, периодичность возникновения высыпаний и ее приуроченность к одному и тому же локусу кожи или видимых слизистых. Нельзя ориентироваться на кем-то и когда-то выставленный диагноз, врач должен всегда сам убедиться в его правомочности.
В наиболее сложных случаях следует проводить вирусологические тесты. Существенную помощь может оказать и diagnosis ex juvantibus (диагноз на основании оценки результатов примененных лекарств или методов лечения).
Несколько слов следует сказать о так называемом бессимптомном течении ПГ. Диагноз в данном случае базируется исключительно на положительных результатах полимеразной цепной реакции (ПЦР), которая в данном случае малоинформативна, так как может позитивироваться не на сам ВПГ, а на его структурные компоненты, сохраняющиеся неопределенно долго после гибели возбудителя. Более того, незрелые вирионы постоянно присутствуют в организме инфицированного человека, что также может обуславливать положительность ПЦР. По-видимому, такие пациенты требуют динамического наблюдения. Наши зарубежные коллеги в этих случаях рекомендуют лечение противовирусными препаратами, считая, что инфицированные люди являются потенциальными источниками заражения своих половых партнеров. Этот подход представляется дискутабельным, так как пока нет ни одного доказательного исследования в его пользу.
После подтверждения диагноза ПГ, собственно, и начинается индивидуальный выбор тактики и стратегии ведения пациента на основании оценки спектра жалоб, анамнеза заболевания и жизни, а также, при необходимости, лабораторного или иного обследования больного.
Пожалуй, главным в дальнейшей работе становится выяснение тяжести течения вирусного процесса, т.е. частоты обострений в год. В основном мы сталкиваемся с тремя вариантами: легкого течения – 1–2 рецидива в год, умеренной тяжести – 3–4 манифестации вирусного процесса, и с тяжелым проявлением заболевания, когда у пациента наблюдается от 6 до 12 эпизодов инфекции. Таким образом, формируется три основных варианта тактики ведения больных. Варианты имеют свои особенности (см. рис.).
При первом варианте, когда герпетические высыпания возникают не чаще 2 раз в год, терапия больных должна быть направлена исключительно на купирование каждого конкретного обострения. Препаратами выбора в этом случае являются парентеральные формы синтетических ациклических нуклеозидов (Ацикловир, Валтрекс, Фамвир). Местные противовирусные препараты могут назначаться только как вспомогательные средства дополнительно к системной терапии. Необходимо остерегаться назначения необоснованно рекомендуемых иммуномодуляторов с целью купирования рецидивов, независимо от их частоты. Особенно это касается легкого течения вирусного процесса, так как иммунные сдвиги в этих случаях транзиторны и не требуют коррекции, но могут усугубиться при дополнительной нагрузке интерфероногенами. Из иммунных препаратов для ускорения регресса кожных высыпаний можно и целесообразно использовать только рекомбинантные альфа-2-интерфероны (Виферон), которые практически не оказывают иммуностимулирующего эффекта, а действуют вирусопатически на сам ВПГ. Более того, в ряде исследований было показано, что, в частности, Виферон способен усиливать клинический эффект ациклических нуклеозидов [11].
Однако при обращении пациента с легким течением ПГ врач может столкнуться с двумя ситуациями.
В одном случае больной обращается за помощью в самом начале рецидива, в другом – на высоте развития высыпаний. Если мы видим, что вирусный процесс находится в стадии предвестников или инициальных проявлений, то это является прямым показанием к назначению системных противовирусных средств. Когда же кожные высыпания существуют более двух дней, то их назначение будет малоэффективно, так как репликация ВПГ уже произошла. Здесь нужно рекомендовать применение свечей Виферон в сочетании с местной терапией (1% крем Фенистил Пенцивир, гели Веру-Мерц серол и Виферон, мазь Гевизош и др.), что значительно сокращает сроки регресса кожной и субъективной симптоматики. Однако очень важно помнить, что в процессе консультирования необходимо ориентировать пациента на своевременный прием ациклических нуклеозидов при следующем обострении, который необходимо начинать со стадии появления предвестников рецидива.
Второй вариант, когда течение герпесвирусной инфекции характеризуется как умеренное (3–4 раза в год), можно назвать пограничным.
В данных случаях необходим тщательный сбор анамнеза заболевания, который помогает сориентироваться в необходимости и направленности дальнейшего обследования. Здесь важно оценить динамику течения заболевания и его длительность. В том случае, если пациент страдает ПГ несколько лет и обострения изначально имели такую частоту, – это монотонный тип, свидетельствующий о транзиторности иммунных нарушений, и ведение больного должно быть аналогично таковому при легком варианте течения. Более сложными являются ситуации, когда у пациента наблюдается нарастание частоты рецидивов (нарастающий вариант ПГ) или же они появились недавно. В таких случаях необходимо обязательное иммунологическое тестирование (интерфероновый статус и цитокиновый профиль) для выявления степени и характера иммунодефицита. От результатов обследования и зависит выбор терапевтической тактики. Если нет тенденции к формированию вторичного иммунодефицита, то лечение пациента должно ограничиваться этиотропной терапией, если иммунные нарушения носят более выраженный характер, то необходима консультация клинического иммунолога для назначения иммуннотропной терапии, которая направлена не на купирование обострений, а на их профилактику за счет восстановления контроля над латентностью ВПГ.
Третий вариант – тяжелого и крайне тяжелого течения ПГ – наиболее сложный для определения терапевтического подхода. Более того, в данном случае нередко стоит вопрос не только о лечении самого вирусного заболевания, но и о психореабилитации пациента. Единственное, в чем не должен сомневаться в этих случаях врач, это в выборе стратегии – вторичной профилактике рецидивов заболевания. Однако тактические подходы здесь могут иметь два основных варианта: это иммунокоррекция или супрессивная противовирусная химиотерапия (длительная или эпизодическая). Выбор подхода целиком и полностью зависит от результатов иммунологического обследования, целью которого является установление варианта вторичного иммунодефицитного состояния.
Определение варианта иммунопатогенеза ПГ основано на оценке спонтанной и индуцированной выработки двух интерлейкинов (ИЛ) – ИЛ-4 и ИЛ-6 [1, 7]. Немаловажным аспектом являются сроки проведения иммунных тестов. Мы, основываясь на собственных наблюдениях, считаем, что их проведение наиболее целесообразно в межрецидивном периоде, не ранее чем через две недели после стихания очередного обострения. Обоснованием этого является то, что результаты иммунного реагирования на активацию ВПГ носят, безусловно, важный, но малоинформативный характер с позиции дальнейшего лечения. Они не позволяют прогнозировать способность адекватного ответа со стороны иммунокомпетентных клеток и иммунорегуляторных реакций при их следующей нагрузке (вирусом или лечением). Таким образом, только в состоянии относительного покоя, in vitro, мы можем более или менее достоверно оценить как степень иммунодефицита, так и возможную реакцию системы иммунитета на ее лекарственную стимуляцию.
Необходимо сказать и о ситуациях, когда вирусный процесс течет перманентно. Для того чтобы провести обследование, мы настоятельно рекомендуем назначение синтетических ациклических нуклеозидов (Валтрекс, Фамвир) в течение месяца. После того как через две недели на фоне противовирусных средств проводится исследование и получены его результаты, пациент либо остается на длительной супрессивной химиотерапии, либо ему проводится иммунокоррекция.
На основании многолетних кли-нико-иммунологических исследований с одновременной оценкой эффективности различных профилактических подходов мы сегодня можем предложить патогенетически обоснованный выбор терапевтической тактики. Он напрямую зависит от выявленного в результате иммунного тестирования типа иммунопатогенеза ПГ (табл. 2).
Наиболее благоприятным вариантом является вторичный иммунодефицит по Т-клеточному типу. В данном случае методом выбора вторичной профилактики является иммунокоррекция, которая может предусматривать назначение герпетической вакцины, интерфероногенов или кислородно-озоновой терапии. Важно знать и помнить сроки проведения данного профилактического метода лечения – только в межрецидивном периоде, не ранее чем через две недели после купирования обострения.
Другой вариант – вторичный иммунодефицит по гуморальному типу – значительно ограничивает терапевтические возможности. Он, по сути, парадоксален для хронически персистирующих инфекций, к которым, собственно, и относится ВПГ. Стимуляция иммунитета с позиции профилактики при этом типе патогенеза неэффективна, так как в основном активируются гуморальные факторы, которые мало значимы в восстановлении контроля над латентностью вируса. Таким образом, в этих случаях на первом этапе профилактики надежным и, пожалуй, наиболее патогенетически обоснованным методом, гарантирующим прекращение обострений ПГ, будет длительная супрессивная химиотерапия. Сроки ее индивидуальны, но, как показывает практика, через 6–12 месяцев непрерывного приема современных ациклических синтетических нуклеозидов у пациентов наблюдается «переключение» типов иммунного реагирования, что позволяет на втором этапе лечения проводить иммунную профилактику [9].
Самым неприятным вариантом можно считать недифференцированный тип вторичного иммунодефицита. Как правило, он встречается у пациентов с перманентным течением герпесвирусной инфекции и нередко на фоне тяжелых сопутствующих заболеваний. Методом выбора в данных случаях служит комбинация длительного приема противовирусных препаратов в комбинации с иммунозамещением, т.е. на фоне управляемого вирусного процесса восполнение в «истощенном» организме дефицита иммунных факторов (α- и γ-ИФН, ИЛ-1 и другие цитокины). Одним из наиболее физиологичных препаратов данной направленности, безусловно, является Виферон. Длительность же такой терапии непрогнозируема и в настоящее время может быть рекомендована пожизненно, особенно для профилактики рецидивов ПГ на фоне ВИЧ-инфекции, аутоиммунного тиреоидита герпетической природы, системных заболеваний, требующих постоянного приема глюкокортикоидов и/или цитостатиков [9, 12].
Пациентам, страдающим ПГ, особенно с часто рецидивирующими формами или с локализацией высыпаний в области гениталий наряду с фармакологической помощью нередко требуется психореабилитация. Существенную помощь в ней оказывает грамотное консультирование больных [2]. Для проведения консультирования врач должен не только знать суть вопроса, т.е. проблему ПГ, но и обладать навыками и владеть инструментами, которые используются с этой целью. Главная задача консультирования по вопросам ПГ – это помощь пациенту в адаптации к нормальной жизни после выставленного диагноза. Необходимо нивелировать эмоции и переживания, постараться убрать фобии, изменить ложные представления о заболевании и научить управлять самим вирусным процессом. Залогом успеха консультирования является установление конфиденциальных доверительных отношений между врачом и больным, базирующихся на высоком профессионализме консультанта.
В заключение следует сказать, что предложенный нами алгоритм ведения больных ПГ уже прошел испытание временем. Мы и ряд наших коллег с успехом применяем его в течение пяти лет, что позволяет рекомендовать его использование в клинической практике более широко, а при обсуждении на соответствующем уровне рекомендовать за основу при последующем составлении протокола лечения больных простым герпесом.
1. Бутов Ю.С., Малиновская В.В., Полеско И.В., Халдин А.А. Клинико-патогенетическое значение иммунологического реагирования при простом герпесе // Российский журнал кожных и венерических болезней. 2001. № 2. С. 31–36.
2. Зуев А.В., Халдин А.А., Братчикова Е.Б., Чернов А.С., Комратова О.Н. Консультирование в комплексном подходе к терапии и реабилитации при простом герпесе // Герпес. 2006. № 1. С. 47–50.
3. Иванов О.Л., Самгин М.А., Халдин А.А., Малиновская В.В., Сускова В.С. Современные подходы к дифференцированной терапии простого герпеса: методические рекомендации. М.: ММА им. И.М. Сеченова, 2000. С. 31.
4. Иванов О.Л., Халдин А.А., Самгин М.А., Малиновская В.В., Сускова В.С. Рациональный выбор терапии простого герпеса: учебно-методическое пособие. М.: Мед. Центр УД Президента РФ, 2002. С. 20.
5. Львов А.Н., Халдин А.А., Федякова Е.В. Рецидивирующий простой герпес: клинико-психоиммунные соотношения на фоне комплексной терапии // Герпес. 2006. № 1. С. 36–39.
6. Самгин М.А., Халдин А.А. Простой герпес (дерматологические аспекты). М.: МЕДпресс-информ, 2002. С. 160.
7. Самгин М.А., Халдин А.А. Простой герпес: современные достижения в изучении клиники и патогенеза заболевания и их практическое значение // Materia Medica. 2002. № 3–4. С. 27–35.
8. Самгин М.А., Халдин А.А. Клиника дерматологического синдрома герпетической болезни // Materia Medica. 2003. № 4. С. 24–34.
9. Халдин А.А. Клинико-иммунологическое обоснование пролонгированного назначения Фамвира при дерматологическом синдроме герпетической болезни // Иммунопатология, аллергология, инфектология. 2005. № 2. С. 68–72.
10. Халдин А.А., Львов А.Н., Федякова Е.В., Малиновская В.В. Клинико-иммунологические и психосоматические особенности у больных простым герпесом // Российский журнал кожных и венерических болезней. 2003. № 6. С. 22–26.
11. Халдин А.А., Полеско И.В. Алгоритм терапии обострений и вторичной профилактики простого герпеса Вифероном // Герпес. 2006. № 1. С. 58–59.
12. Щеголева В.И., Халдин А.А., Малиновская В.В., Пантелеев И.В., Кузнецова И.В., Галегов Г.А., Сускова В.С. Особенности патогенеза и терапии «менструальной» формы простого герпеса // Российский журнал кожных и венерических болезней. 2005. № 6. С. 25–30.
Новости на тему
15.02.2024
17.08.2022 01:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.