Антиангиогенные препараты в арсенале противоопухолевых средств
- Аннотация
- Статья
- Ссылки
- English
Патологический ангиогенез – одно из ключевых свойств опухолей, обеспечивающих их непрерывный рост, инвазию и метастазирование. Американский исследователь J. Folkman впервые обратил внимание на запуск ангиогенеза в опухолевых узелках, превышающих объем 1–2 мм3. До достижения этого размера зачатки опухолей получали необходимые для развития вещества путем диффузии.
Без вновь возникших капилляров первичная опухоль не может расти, прорастать в соседние ткани и реализовывать рост метастатических заносов в отдаленные органы. Кровь, доставляемая по сосудам, – источник кислорода и питания опухолевых клеток. Запуск ангиогенеза в норме является генетически контролируемым процессом, характеризующимся стабильностью, обусловленной балансом индукторов и ингибиторов развития сосудистой системы [1].
При эмбриональном органогенезе из гематопоэтических стволовых клеток дифференцируются гемангиобласты и ангиобласты, формирующие тубулярные структуры с образованием отростков в эмбрионе и желточном мешке, впоследствии соединенных сначала в примитивную сеть (спрутизация), затем в сплетения (васкулярогенез). После привлечения муральных клеток – перицитов образуется стройная и стабильная сосудистая система (ангиогенез). Контроль ее нормального развития на начальном этапе образования гемангиобластов осуществляется транскрипционным фактором RUNX1; на этапе васкулярогенеза из ангиобластов – сосудистым эндотелиальным фактором роста (VEGF) и его рецепторами 1 и 2 (VEGFR1 и VEGFR2); на этапе образования сплетений и капиллярных отростков – VEGF, VEGFR1 и VECFR2, фибробластным фактором роста (bFGF), ангиопоэтинами – Ang-1 и Ang-2, Tie-1 и Tie-2 тирозинкиназными рецепторами эндотелиальных клеток, лигандом Notch и его рецептором Delta-4; на завершающем этапе нормального ангиогенеза – тромбоцитарным фактором роста бета и его рецептором бета (PDGF-B и PDGFR-beta), трансформирующим фактором роста бета (TGF-beta) [2].
Физиологическое формирование новых сосудов возможно при заживлении ран, после ишемии (реваскуляризация), при беременности. Ангиогенез осуществляется за счет нормальных клеток эндотелия, их генетическая программа универсальна, нарушения в виде мутаций встречаются редко.
Таким образом, в норме образование новых сосудов характерно для периодов эмбриогенеза или репарации после повреждения. Иная ситуация при злокачественных опухолях, когда наблюдается неконтролируемый ангиогенез.
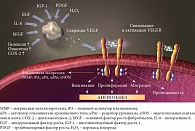
Кровеносные и лимфатические капилляры расположены беспорядочно, их больше, чем в нормальной ткани, они дефектны, их проницаемость повышена, в сосудистой стенке мало перицитов и гладкомышечных клеток. Проангиогенные факторы доминируют, антиангиогенные подавлены, баланс нарушен (рис. 1).
bFGF относится к проангиогенным агентам, поскольку стимулирует выработку VEGF и регулирует рост и выживаемость клеток эндотелия. Тромбоцитарные факторы роста PDGF-B и PDGF-C гиперэкспрессируются клетками эндотелия так же, как их рецепторы PDGFR-A и PDGFR-B, что ведет к мобилизации перицитов и сосудистой стабилизации. И наоборот, угнетение сигналов от PDGF заканчивается апоптозом эндотелиальных клеток [3].
Рецепторы VEGF главным образом секретируются эндотелиальными клетками.
К антиангиогенным факторам относят тромбоспондин, эндостатин, тумстатин (рис. 2).
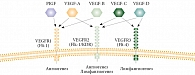
Лиганды VEGFR – гликопротeины (45КD) экспрессируются в четырех молекулярных формах: VEGF-A (молекулярный вес 121), VEGF-B (165), VEGF-C (189), VEGF-D (206). VEGF-А диффундирующий, остальные формы связываются с гепарином или протеогликанами (конъюгаты полисахаридов и белков в соединительной ткани на клеточной поверхности).
VEGF-A активирует рецепторы VEGFR1 и VEGFR2. VEGF-B и PIGF (факторы роста плаценты) соединяются с VEGFR2. VEGF-C и VEGF-D взаимодействуют с рецептором VEGFR3.
После связывания рецепторов с лигандами и их димеризации внутри клеток запускаются сигнальные каскады, достигающие клеточного ядра:
а) активация фосфолипазы С-гамма – NO (MARK) ведет к увеличению сосудистой проницаемости;
б) сигнальный путь фосфоинозитид-3-киназы (PI3K), киназы AKT (PI3K – AKT – mTOR) усиливает эндотелиальную активацию, стимуляцию пролиферации и миграции клеток вследствие реорганизации актина цитоскелета [4].
В руководстве по таргетной терапии, изданном в 2014 г., проанализирована активность десяти зарегистрированных антиангиогенных таргетных препаратов и семи находящихся на фазе III клинического исследования.
Рассмотрим мишени препаратов, их дозовые режимы при разных опухолевых показаниях и активность [5].
Бевацизумаб
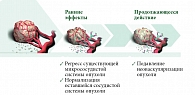
Бевацизумаб (Bv) (Авастин, компания Roche) – первый антиангиогенный противоопухолевый препарат, разрешенный для практического применения FDA (Food and Drug Administration – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) в 2004 г., а в европейских странах в 2005-м. Его молекулярная мишень – VEGF-A. На рисунке 3 проиллюстрирован механизм действия Bv – регрессия сосудов, нормализация кровотока, угнетение формирования новых сосудов [6].
Показания к назначению: совместно с химиотерапией при метастатическом раке толстой кишки (мРТК), немелкоклеточном раке легкого (НМКРЛ), почечноклеточном раке, раке молочной железы, раке яичника (РЯ) и в виде монотерапии при глиобластомах.
При колоректальном раке наибольший резонанс имели три рандомизированных исследования с применением Bv ± IFL (иринотекан + фторурацил + лейковорин), Bv ± FOLFOX4 (фторурацил + лейковорин + оксалиплатин), Bv ± XELOX (капецитабин + оксалиплатин) [7–9]. Во всех исследованиях отмечены статистически достоверные преимущества предложенной терапии по показателю безрецидивной выживаемости, а в исследовании H. Hurwitz и соавт. – статистически значимое улучшение общей выживаемости – 20,3 месяца, в контроле – 15,6 месяца.
Bv продемонстрировал эффективность и во второй линии терапии в комбинации с FOLFOX [8].
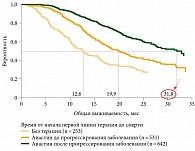
Важное наблюдение провели A. Grottey и соавт. (ASCO-2007). В исследовании было три группы больных мРТК, получавших химиотерапию без Авастина, химиотерапию с Авастином до прогрессирования и Авастин после прогрессирования без химиотерапии. Медиана выживаемости составила 12,6, 19,9 и 31,8 месяца соответственно (рис. 4).
При колоректальном раке препарат применялся в дозе от 5 до 10 мг/кг один раз в две-три недели. Таким образом, большинство химиотерапевтов продолжают применять Авастин и после констатации ухудшения.
Эффект Bv при НМКРЛ более выразителен при аденокарциномах. При этой форме рака Bv применяется в дозе 15 мг/кг один раз в три недели.
В исследование Е5499 было включено 878 пациентов с метастатическим НМКРЛ. Непосредственный эффект, медиана безрецидивной выживаемости и общей выживаемости были достоверно выше при присоединении Bv к химиотерапевтической комбинации «паклитаксел + карбоплатин». Медиана общей выживаемости составила 12,3 месяца, в химиотерапевтической группе – 10,3 месяца, р = 0,003 [10]. FDA зарегистрировало Bv для применения при этой форме рака.
В исследовании AVAIL Bv у части больных был применен в меньшей дозе (7,5 мг/кг). Кроме того, использовался другой состав химиотерапевтической комбинациии (гемцитабин + цисплатин). Увеличение общей выживаемости подтвердить не удалось [11].
Данные об активности Bv при метастатическом раке молочной железы (мРМЖ) противоречивы. В 2007 г. в исследовании ECOG-2100 с участием 680 ранее не леченных больных мРМЖ было показано, что при использовании паклитаксела
(90 мг/м2 внутривенно в 1-й, 8-й и 15-й дни) и Bv (по 10 мг/кг внутривенно в 1-й и 15-й дни) медиана безрецидивной выживаемости составила 11,4 месяца, в группе с одним паклитакселом – 6,1 месяца. На основании этих данных FDA разрешило применение Bv при РМЖ [12].
Аналогичные данные были получены при комбинации Bv и капецитабина, Bv и антрациклинов [13].
Тем не менее на ASCO-2010 был представлен метаанализ, в котором медиана выживаемости без рецидива в группе Bv составила 9,3 месяца, в группе химиотерапии – 6,4 месяца. Общий эффект зарегистрирован в группе с включением Bv в 49% случаев, без Bv – в 32%, но медиана общей выживаемости в группах не отличалась [14]. Отсутствие разницы в показателе общей выживаемости больных в двух группах послужило для FDA основанием для отзыва разрешения на применение Bv при РМЖ. В Европе и России продолжают назначать Bv при этом заболевании.
В спектр противоопухолевой активности бевацизумаба FDA включило метастатический рак почки.
В исследовании AVOREN участвовало 649 больных метастатическим почечно-клеточным раком. Пациенты получали интерферон-альфа-2a c Bv или без него. Время до прогрессирования в группе «Bv + интерферон-альфа-2а» составило 10,2 месяца, в группе с интерфероном – 5,4 месяца, p < 0,0003. Общий эффект – 31 и 13% соответственно, медиана общей выживаемости – 23,3 и 21,3 месяца [15].
В ходе исследования CALBG-90206 (n = 732) пациенты основной группы получали Bv вместе с интерфероном-альфа-2b, контрольной – только интерферон. Эффективность – 26 и 13% соответственно, медиана времени до прогрессирования – 8,5 и 5,2 месяца, медиана общей выживаемости – 18,3 и 17,4 месяца [16].
В обоих исследованиях интерферон вводили в дозе от 1 до 6 млн ЕД подкожно два раза в неделю, Bv – по 10 мг/кг внутривенно один раз в три недели.
Европейский Союз разрешил применение Авастина при метастатическом РЯ во второй линии терапии в комбинации с карбоплатином и паклитакселом или в комбинации с карбоплатином и гемцитабином. Основанием послужили несколько исследований. В исследовании J. Schmitt и D. Matei эффект от монотерапии Bv при рецидивном РЯ достигнут у 16% больных, стабилизация в течение 5,5 месяца – у 50% больных [17]. При комбинации Bv с карбоплатином время до прогрессирования достоверно увеличилось в группе Bv с 2,4 до 3,9 месяца при ранее леченном РЯ (р < 0,005) [18].
Во второй линии терапии при платиночувствительном РЯ режим «Bv + СBDCA (карбоплатин) + GEM (гемцитабин)» обеспечил медиану безрецидивной выживаемости 12,4 месяца. В группе контроля этот показатель составил 8,4 месяца, р < 0,0001 [19].
Cреди показаний к назначению Bv – рецидивирующие глиобластомы. Глиобластома – пока единственная форма опухоли, для которой доказан эффект Bv в режиме монотерапии.
В исследовании T.N. Kreisl и соавт. 85 больных с диагнозом «рецидивная глиобластома» (в анамнезе лучевая терапия и применение темозоломида) получали 10 мг/кг Bv один раз в три недели. Эффект выше, чем в историческом контроле. На основании этого исследования FDA разрешило применение Bv при данной патологии [20].
Вошла в практику и комбинация иринотекана с Bv. Шестимесячная выживаемость без прогрессирования составила 57%, уменьшение отека мозга – 50%, ослабление неврологических симптомов – 52% [21].
Положительные эффекты Bv известны при раке желудка, поджелудочной железы и предстательной железы в фазе II исследования.
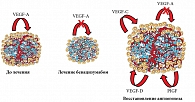
Резистентность к Bv связывают с активацией других лигандов ангиогенеза, слабо подавляемых моноклональными антителами (рис. 5).
Афлиберцепт
В 2012 г. в США и ряде европейских стран для терапии рака толстой кишки был разрешен афлиберцепт (Zaltrap, ziv-aflibercept, компания Sanofi).
Афлиберцепт – рекомбинантный белок, состоящий из сегментов внеклеточного домена человеческого рецептора 1 васкулярного эндотелиального фактора роста (VEGFR1) и рецептора 2 этого же фактора роста (VEGFR2), cоединенных со стабильным регионом (Fc) человеческого антитела (Igl1).
Aфлиберцепт действует как растворимый рецептор-ловушка, захватывающая в крови VEGF и препятствующая его связыванию с рецепторами VEGFR1 и VEGFR2.
В исследовании VELOUR 1226 пациентов были рандомизированы на две группы: в первой группе пациенты получали афлиберцепт (4 мг/кг внутривенно один раз в две недели) и режим FOLFIRI (фторурацил + лейковорин + иринотекан), во второй – только FOLFIRI + плацебо. И безрецидивная, и общая выживаемость в группе афлиберцепта была достоверно выше: медиана безрецидивной выживаемости – 6,9 и 4,7 месяца, р = 0,00007; медиана общей выживаемости – 13,5 и 12,6 месяца, отношение рисков 0,82, p = 0,0032 [22].
Афлиберцепт проходит оценку по фазе III вместе с доцетакселом и преднизоном при гормонорезистентном раке предстательной железы, по фазе II исследования вместе с режимом FOLFOX в первой линии терапии метастатического рака толстой кишки и в комбинации с доцетакселом в первой и второй линиях терапии мНМКРЛ [5].
Рамуцирумаб
Рамуцирумаб (компания Eli Lilly) представляет собой человеческие моноклональные антитела IgG1, связывающиеся с VEGFR2 и препятствующие взаимодействию с этим рецептором VEGF. Продемонстрирован эффект этого препарата при различных локализациях рака (желудок, молочная железа, печень, простата) в исследованиях фаз II и III [23].
Большинство антиангиогенных препаратов относятся к группе ингибиторов интрацеллюлярного домена VEGFR2 , при этом они угнетают рецепторы EGF, PDGFR, c-kit, FLT-3 [24].
Акситиниб
Акситиниб (Axinitib, Inlyta, компания PFIZER) одобрен FDA в 2012 г. по результатам сравнительного исследования с сорафенибом в режиме второй линии терапии (AXIS) при распространенном раке почки. Препарат является первым высокоселективным ингибитором тирозинкиназ (VEGFR1, 2, 3). Рекомендован для приема внутрь в стартовой дозе 5 мг два раза в сутки с возможностью дальнейшего индивидуального подбора дозы. В исследовании AXIS (n = 723) медиана времени до прогрессирования в группе акситиниба значимо (на 43%) превысила медиану выживаемости без прогрессирования в группе сорафениба и составила 6,7 и 4,7 месяца соответственно (p < 0,0001).
Частота объективного ответа для акситиниба составила 19%, для сорафениба – 9%.
В данном исследовании был продемонстрирован благоприятный профиль безопасности акситиниба. При применении сорафениба чаще наблюдалась кожная токсичность, а на фоне терапии акситинибом – артериальная гипертензия, которая оказалась также независимым предиктором увеличения общей выживаемости [25].
Вандетаниб
В число таргетных препаратов с антиангиогенным действием вошел тирозинкиназный ингибитор вандетаниб (Zactima, AtraZeneca), нейтрализующий рецепторы VEGFR2 и EGFR при медуллярном раке щитовидной железы. В исследовании ZETA с участием 321 больного сравнивали эффективность вандетаниба с таковой плацебо. Медиана времени до прогрессирования составила 22,6 и 16,4 месяца соответственно. Однако впоследствии оказалось, что эффект связан не столько с антиангиогенным действием, сколько с подавлением гена RET [26]. Препарат изучается в комбинации с химиотерапией при глиомах, раке предстательной железы, НМКРЛ. Вандетаниб применяется в дозе по 300 мг внутрь ежедневно. Среди побочных явлений отмечены кардиотоксичность, диарея, сыпь, гипертония, головная боль [5, 26].
Ниндетаниб
Возможно, перспективы имеет препарат ниндетаниб (Vargatef, компания Boerhinger Ingelheim), ингибирующий VEGFR1, 2, 3, PDGFR, FGFR, Src.
Как оказалось, препарат эффективен при идиопатическом легочном фиброзе.
В фазе II исследования при НМКРЛ после неудач терапии в первой линии общая выживаемость, достигнутая после применения ниндетаниба, составила 21,9 недели. Препарат изучается по фазе III при НМКРЛ и РЯ [27].
Пазопаниб
Пазопаниб (Pazopanib, Votriient, компания GlaxoSmithKline) – тирозинкиназный ингибитор всех рецепторов VEGFR, PDGF-a, c-kit. Избирательность действия этого препарата на указанные мишени выше таковой других уже разрешенных к использованию таргетных препаратов.
Препарат зарегистрирован FDA для лечения рака почки в 2010 г. и сарком мягких тканей в 2012 г.
При метастатическом раке почки (исследовано 435 пациентов, леченных цитокинами или не леченных) медиана времени до прогрессирования у не леченных ранее составила 11,2 и 2,8 месяца в сравнении с контролем, у леченных ранее интерферонами – 9,2 и 4,2 месяца [28].
Эффект и достоверное продление медианы времени до прогрессирования отмечены при синовиальных саркомах и лейомиосаркомах [29].
Продолжается изучение препарата при НМКРЛ и РЯ. Пазопаниб назначается в дозе по 800 мг внутрь длительно. Из побочных эффектов обращают на себя внимание повышение уровня трансаминаз крови, диарея, боли в костях и мышцах, гипопигментация кожи.
Регорафениб
Регорафениб (Regorafenib, Stivagra, компания BAYER) – малая молекула, ингибитор различных мембранных и клеточных киназ. Регорафениб и два его основных метаболита М-2 и М-5 подавляют Ret, VEGFR1–3,
с-kit, PDGFR-альфа/бета, FGFR1 и 2, Tie-2, Trk-2a, Eph-2a, Raf1, Abl, BRAF, BRAFv600E.
Основное показание для назначения – мРТК с исчерпанными возможностями первой и второй линий терапии (Fu, Cap, Oxa, Iri, Bv, ингибиторы EGFR).
Основанием для регистрации препарата FDA в 2012 г. послужила фаза III исследования CORRECT (n = 760), в котором показатели общей (р = 0,0052) и безрецидивной выживаемости (р < 0,0001) были
достоверно выше, чем в группе плацебо [30].
В 2103 г. FDA разрешило применение регорафениба у больных с неудалимой гастроинтестинальной опухолью (ГИСО), резистентной к иматинибу или сунитинибу [31].
Регорафениб изучается в комбинации с FOLFIRI при гепатоцеллюлярном раке. Препарат применяют в дозе по 160 мг ежедневно внутрь в течение трех недель, затем семь дней перерыв и цикл повторяют.
Сорафениб
Сорафениб (Sorafenib, Nexavar, компания Bayer) – тирозинкиназный ингибитор VEGFR2, PDGFR, c-kit, FLT3. Кроме того, препарат ингибирует серин-треониновые киназы CRAF и BRAF. Таким образом, препарат оказывает антиангиогенный эффект, действуя на эндотелиальные клетки, и антипролиферативный эффект на опухолевые клетки.
В 2005 г. FDA разрешило применение этого таргетного препарата при метастазах рака почки. В большом рандомизированном исследовании с участием 903 больных медиана безрецидивной выживаемости составила 24 недели, в группе контроля – 12 недель, р < 0,001, общая выживаемость – 19,3 месяца, в группе контроля – 15,9 месяца, р < 0,015 [32].
В 2007 г. сорафениб разрешен FDA для терапии гепатоцеллюлярного рака. В исследовании фазы III (SHARP) медианы и общей (10,7 месяца), и безрецидивной выживаемости (5,5 месяца) были достоверно выше, чем в группе контроля [33].
Препарат назначается внутрь по 400 мг два раза в день.
Сунитиниб
Сунитиниб (Sunitinib, Сутент, компания Pfizer) обладает антиангиогенными, проапоптическими и антипролиферативными свойствами, являясь ингибитором VEGFR1 и 2, PDGFR, FLT3, c-kit. Препарат назначается в дозе по 50 мг внутрь ежедневно в течение четырех недель с последующим перерывом в две недели.
Показания к назначению: почечно-клеточный рак, ГИСО, нейроэндокринные опухоли поджелудочной железы.
Сунитиниб разрешен FDA при метастатическом раке почки на основании фазы III рандомизированного сравнительного исследования с интерфероном-альфа (n = 750).
Частота объективного ответа выявлена у 47% больных, получавших сунитиниб, и у 12% пациентов из группы контроля. Медиана безрецидивной выживаемости составила 11 месяцев в группе, получавшей сунитиниб, и пять месяцев у получавших интерферон, медиана общей выживаемости – 26,4 и 21,8 месяца соответственно [34].
Сунитиниб был исследован во второй линии терапии гастроинтестинальных опухолей, резистентных к иматинибу. В рандомизированное плацебоконтролируемое исследование фазы III было включено 312 пациентов (2:1). Медиана безрецидивной выживаемости в группе сунитиниба составила 27,3 недели, в группе плацебо – 6,4 недели, общая выживаемость в группе пациентов, получавших сунитиниб, также превысила аналогичный показатель контрольной группы (отношение рисков 0,49, p = 0,007) [35].
Сунитиниб также исследовали в лечении нейроэндокринных опухолей поджелудочной железы. В рандомизированное двойное слепое плацебоконтролируемое исследование фазы III был включен
171 пациент (1:1) с высокодифференцированными нерезектабельными распространенными/метастатическими нейроэндокринными опухолями поджелудочной железы. Медиана выживаемости без прогрессирования составила 11,4 месяца в группе сунитиниба по сравнению с 5,5 месяца в группе плацебо (р < 0,001). Положительный эффект сунитиниба на выживаемость без прогрессирования был идентичным у всех участников исследования независимо от возраста, расы, пола, общего состояния по шкале ECOG, количества органов и систем, пораженных метастазами. Сунитиниб также демонстрировал превосходство над плацебо независимо от функциональной активности опухоли и от ранее полученного системного лечения.
Заключение
Терапия инновационными таргетными препаратами с целью подавления патологического ангиогенеза в опухолевых очагах является наиболее патогенетически обоснованной и эффективной. В современном арсенале врача-онколога имеется целый ряд противоопухолевых антиангиогенных препаратов для лечения распространенного рака почки, рака толстой кишки, гастроинтестинальных опухолей, нейроэндокринных опухолей, а также для таргетной терапии гепатоцеллюлярного рака, рака молочной железы, рака яичника, немелкоклеточного рака легкого, медуллярного рака щитовидной железы, саркомы мягких тканей, глиобластом.
Anti-Angiogenic Drugs in Arsenal of Anticancer Agents
A.M. Garin, I.S. Bazin
N.N. Blokhin Russian Cancer Research Center
Contact person: Avgust Mikhaylovich Garin, agarin@mail.ru
Molecular targets, dose regimens, and efficacy of innovative targeted drugs used to inhibit pathological angiogenesis inside tumor foci are elucidated. It is noted that antitumor anti-angiogenic drugs are available today for oncologist to treat cancer of different localizations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


