Спектр нежелательных явлений при терапии диссеминированных гастроинтестинальных стромальных опухолей сунитинибом
- Аннотация
- Статья
- Ссылки
- English


Введение
Гастроинтестинальные стромальные опухоли (ГИСО) являются разновидностью сарком и составляют от 0,1 до 3% всех злокачественных опухолей желудочно-кишечного тракта [1]. Средний возраст больных в момент выявления опухоли – 55–60 лет.
При диагностировании ГИСО у 15–50% больных обнаруживается диссеминация процесса [2]. Важной чертой ГИСО является то, что метастатический процесс обычно поражает только органы брюшной полости. Самой частой локализацией метастазов считается печень (65%), несколько реже ГИСО поражает брюшину (21%) [3].
Препарат для первой линии терапии диссеминированной ГИСО иматиниб относится к низкомолекулярным ингибиторам ряда рецепторных (с-KIT, PDGFR-альфа) и нерецепторных тирозинкиназ (Abl, Bcr-Abl). Этот таблетированный препарат высокоэффективен при диссеминированных формах ГИСО и обладает низкой токсичностью. Пациентам с ГИСО группы высокого риска после радикальной операции стандартно проводят адъювантную терапию иматинибом в течение трех лет [4, 5]. Длительная успешная малотоксичная амбулаторная терапия иматинибом приводит к тому, что в момент выявления резистентности к иматинибу и прогрессирования болезни врач не всегда подготавливает пациента к новому профилю токсичности, а пациент бессознательно ожидает малотоксичного лечения.
Препарат для терапии ГИСО второй линии сунитиниб – низкомолекулярный ингибитор тирозинкиназ, блокирующий одновременно несколько молекул: рецепторы фактора роста эндотелия сосудов (VEGFR), рецепторы тромбоцитарного фактора роста (PDGFR), а также рецепторы тирозинкиназы KIT и Flt3. Сунитиниб принимают перорально по 50 мг/сут независимо от приема пищи в течение четырех недель ежедневно с интервалом две недели [5, 6]. При развитии нежелательных явлений возможна редукция дозы препарата до 37,5 и 25 мг/сут.
В отличие от иматиниба сунитиниб характеризуется более выраженной токсичностью. Это связано с тем, что мишени таргетных препаратов неспецифичны, определяются и в нормальных тканях организма. Для ингибиторов тирозинкиназ свойственны такие нежелательные явления, как артериальная гипертензия, тромбозы, микроангиопатии, мукозиты, поражение кожи.
В клиническом исследовании сунитиниба (III фаза) частыми нежелательными явлениями (НЯ) были утомляемость (47%), диарея (43%), тошнота (36%), анорексия (28%) и извращение вкуса (25%). При этом особое внимание было уделено НЯ 3–4-й степени. Наиболее часто регистрировались усталость (10%), артериальная гипертензия (7%) и ладонно-подошвенный синдром (6%). Гематологическая токсичность была в основном 1–2-й степени: выявлялись анемия, нейтропения и тромбоцитопения. Токсичность сунитиниба потребовала у 36% пациентов временной отмены препарата, а у 28% пациентов – снижения дозы [7].
Повышение артериального давления является предиктором эффективности сунитиниба, но это не означает, что коррекция артериальной гипертензии (АГ) не требуется. АГ повышает риск развития других сердечно-сосудистых НЯ.
Риск развития других сердечно-сосудистых НЯ на фоне терапии сунитинибом оценивали в ретроспективном исследовании. Частота кардиальных событий у пациентов с АГ была несколько выше (5% кардиальных событий 3-й степени у пациентов с АГ против 3% у пациентов без АГ) [8–10].
Сунитиниб часто вызывает гипотиреоз. Так, в проспективном наблюдательном исследовании (n = 42) аномалии сывороточного тиреотропного гормона выявлены в 62% случаев. Механизм развития данного НЯ заключается в ингибировании протоонкогена RET, что опосредованно воздействует на рецепторы тиреоидного гормона. Определение функции щитовидной железы перед началом и в процессе терапии сунитинибом позволяет адекватно корригировать подобное НЯ [11].
Продолжительность терапии сунитинибом, по данным клинических исследований, обычно меньше года. Так, в клиническом исследовании сунитиниба в стандартной и альтернативной дозах (ежедневно по 37,5 мг) медиана числа циклов сунитиниба в стандартной дозе составила 5 (1–62 цикла), медиана продолжительности терапии – 7 месяцев (0,1–75,4). 32% больных получали лечение свыше года [12].
Нежелательные явления сунитиниба вынуждают врача прерывать терапию и/или редуцировать дозу. В одном из клинических исследований у 470 (42%) пациентов из-за развития нежелательных явлений терапия прерывалась, а редукция дозы сунитиниба была проведена у 484 (43%) пациентов. Всего прекратили участие в исследовании из-за НЯ 15% пациентов [12].
В последние годы возраст пациентов не рассматривают как противопоказание к проведению противоопухолевого лечения. При этом не следует забывать о проблеме коморбидности и полипрагмазии у пожилых больных. Результаты противоопухолевой терапии у них обычно хуже, чем у более молодых, а число и степень тяжести НЯ выше. У пожилых пациентов с диссеминированными ГИСО чаще имели место редукция дозы и НЯ [13].
Осложнения таргетной терапии нередко требуют коррекции дозы или отмены препарата, что значительно снижает эффективность лечения [14]. Для достижения противоопухолевого ответа необходимо соблюдение дозового и временного режимов таргетной терапии. В связи с этим становится очевидной важность готовности врача и пациента к своевременному выявлению НЯ и их коррекции. Одновременно актуальной представляется информированность терапевтов и врачей общей практики о НЯ на фоне терапии сутитинибом, ведь зачастую именно к ним обращаются больные по поводу лекарственной коррекции.
Материал и методы
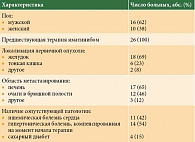
В 2016–2019 гг. под нашим наблюдением находилось 26 пациентов (средний возраст – 59,4 года) с распространенными формами ГИСО, которым проводилась вторая линия терапии (табл. 1).
Все пациенты ранее получали первую линию терапии иматинибом, у них было подтверждено прогрессирование заболевания на фоне лечения этим препаратом. Пациентам была назначена вторая линия терапии по стандартной схеме: сунитиниб 50 мг/сут внутрь ежедневно в режиме 4/2 (четыре недели лечения с последующим двухнедельным перерывом). Прием препарата прекращался при прогрессировании заболевания, развитии тяжелых НЯ или по желанию пациента. Нами собиралась информация о НЯ на фоне терапии, соблюдении режима лечения (перерывы, снижение дозы) и связи отклонений от установленного режима с развитием НЯ. Степень выраженности НЯ оценивали по шкале CTCAE (Common Terminology Criteria for Adverse Events), версия 4.0 [15], общий статус пациента – по шкале ECOG (Eastern Cooperative Oncology Group) [16]. Лабораторные исследования выполнялись перед началом каждого шестинедельного цикла терапии: общий анализ крови и мочи, биохимический анализ (билирубин общий, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), мочевина, креатинин, гормоны щитовидной железы). Пациенты ежедневно измеряли артериальное давление. Нами фиксировалось первичное назначение гипотензивных препаратов и изменение (усиление) гипотензивной терапии. Назначение или изменение гипотензивной терапии проводилось терапевтом или кардиологом.
Результаты
При анализе токсичности выявлено, что все больные испытывали слабость в процессе терапии (табл. 2).
Чаще имела место слабость 2-й степени, вследствие чего статус 23 пациентов по ECOG составил 2. Пациенты отмечали необходимость нахождения в постели или кресле менее 50% дневного времени. Тем не менее приверженность больных терапии была высокой: пациенты продолжали прием препарата, несмотря на явное ухудшение общего состояния. Слабость 3-й степени наблюдалась у 3 пациентов. На момент начала приема препарата у всех больных отмечались нормальное артериальное давление или артериальная гипертензия 1-й степени (систолическое артериальное давление ≤ 140 мм рт. ст., диастолическое ≤ 90 мм рт. ст.). У 14 пациентов ранее была диагностирована гипертоническая болезнь, по поводу которой они получали гипотензивную терапию. На момент начала терапии АГ была компенсирована. Пациентам был рекомендован ежедневный контроль артериального давления для выявления АГ в максимально ранний срок. В среднем АГ впервые выявлялась через 14 ± 6 дней приема препарата. При выявлении АГ пациентам, которые ранее не получали гипотензивную терапию, назначали корригирующую терапию. Более сложную задачу представляла коррекция АГ у пациентов, которые на момент начала терапии уже получали гипотензивные препараты. У 9 больных потребовалось изменение схемы гипотензивной терапии, 5 пациентов продолжали получать гипотензивную терапию, назначенную до начала приема сунитиниба. Сложности с подбором корригирующей терапии возникли у 4 пациентов, у которых АГ 3-й степени развилась на фоне приема гипотензивных препаратов: у этих пациентов разовая доза сунитиниба была снижена до 37,5 мг. Гипертонический криз не развился ни у одного пациента. У одного пациента на фоне повышения артериального давления возникло кровотечение из опухоли желудка, которое было остановлено консервативно.
Развитие диареи было зафиксировано у всех 26 пациентов. Назначение диеты с пониженным содержанием клетчатки с первого дня приема препарата позволило большинству больных избежать редукции дозы сунитиниба, при этом сохранялась диарея 1-й степени (жидкий стул до двух раз в день). Диарея 3-й степени (жидкий стул более семи раз в день) потребовала временного перерыва в терапии у 7 пациентов, снижения дозы препарата у 2 пациентов.
Гипотиреоз 1-й степени без клинических проявлений выявлен у 6 больных, терапия не проводилась.
Изменения кожи 1-й степени выраженности зарегистрированы у всех больных. У пациентов наблюдались эритема кожи, сухость кожи, шелушение. У 25 больных изменился цвет волос на волосистой части головы (частичная седина) и бровей. Все больные пользовались увлажняющим кремом для лица и кремом для рук с первого дня приема сунитиниба. Однако у 12 пациентов развился ладонно-подошвенный синдром, который не потребовал специального лечения.
Тошнота 1-й степени, позволяющая пациентам получать адекватное питание, развилась у 6 больных. Кроме того, эти пациенты отмечали снижение аппетита и объема съедаемой пищи. У 2 пациентов зафиксировано несколько эпизодов рвоты 1-й степени, что не повлияло на прием препаратов. Антиэметики не применялись.
Изменения лабораторных показателей выявлялись при контрольных анализах уже после первого цикла терапии (табл. 3).
Наиболее часто регистрировалась тромбоцитопения, у большинства больных 1-й степени, у 3 пациентов отмечалась тромбоцитопения 2-й степени, у одного – 3-й степени. Характерной особенностью было то, что отсутствовали клинические проявления, повышенная кровоточивость, петехии. Выявление анемии и лейкопении не выше 2-й степени выраженности не повлекло за собой редукции дозы. Всего у 7 больных имел место хотя бы один перенос начала очередного цикла в связи с гематологической токсичностью. Повышение уровней АСТ и АЛТ 1-й степени отмечалось не ранее чем после двух циклов терапии.
Обсуждение результатов
Профиль токсичности сунитиниба в настоящее время хорошо изучен, однако следует констатировать, что у пациентов в реальной клинической практике сопутствующих болезней значительно больше, чем у пациентов, включенных в рандомизированные клинические исследования. Большинство пациентов имели несколько сопутствующих заболеваний, при этом половина больных получала гипотензивную терапию в момент начала приема сунитиниба. Мониторинг артериального давления, подробное информирование пациентов о высокой вероятности его повышения позволили достаточно рано выявить данное НЯ и провести коррекцию терапии. 9 пациентам понадобилось изменение схемы гипотензивной терапии, что подтверждает необходимость включения терапевта или кардиолога в мультидисциплинарную команду при назначении терапии сунитинибом. В случае неэффективности гипотензивной терапии оправданно снижение дозы сунитиниба. Особое внимание при использовании сунитиниба следует уделять пациентам с неудаленной опухолью, поскольку изъязвления и кровотечения, характерные для ГИСО [17], требуют тщательного мониторинга артериального давления.
В целом частота развития АГ сравнима с частотой АГ, представленной в отчетах других клинических исследований [9–11].
Диарея развилась у всех больных. Назначение щадящей диеты с первого дня терапии позволило большинству из них продолжить прием препарата на фоне диареи 1-й степени. Частота и степень диареи в данной группе больных не противоречит частоте ее развития в различных клинических исследованиях [8–10].
Кожная токсичность не была лимитирующей у данной группы больных. Подготовленность пациентов к особым правилам ухода за кожей представляется нам важнейшей составляющей успеха. Ни одному пациенту не потребовалась дополнительная консультация дерматолога.
Изменения лабораторных показателей характерны для терапии сунитинибом.
Заключение
Анализ статуса коморбидности пациентов с ГИСО с учетом ожидаемых видов токсичности, информирование больных, мониторинг симптомов, назначение профилактических препаратов и своевременное лечение НЯ позволяют провести терапию второй линии ГИСО сунитинибом с соблюдением стандартного дозового и временного режимов.
A.M. Koroleva, L.M. Kogonya, I.A. Koroleva, M.V. Kopp
Multidisciplinary Clinic ‘Reaviz’, Samara
Moscow Regional Research and Clinical Institute (MONIKI)
Contact person: Aleksandra M. Koroleva, alexthelynx-uni@yandex.ru
The authors analyzed the adverse events of 26 patients with disseminated gastrointestinal stromal tumors in the 2nd line treatment with sunitinib. All patients had previously received imatinib as first-line therapy. In the course of therapy with sunitinib patients had adverse events: fatigue – 26 patients, arterial hypertension – 17 patients, diarrhea – 26, skin toxicity – 26 patients, hand-foot syndrome in 12 patients. 14 patients before therapy with sunitinib were receiving antihypertensive therapy. 9 patients required a change in the scheme of antihypertensive therapy, 5 patients continued to receive antihypertensive therapy prescribed before sunitinib. 4 patients developed hypertension 3 gr. in these patients, a daily dose of sunitinib was reduced to 37.5 mg.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.