количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Антибиотики в терапии угревой болезни: проблема рационального выбора
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Дерматовенерология и дерматокосметология" № 1 (4)
- Аннотация
- Статья
- Ссылки
- English
Миноциклин (Минолексин®) – высокоэффективный препарат для лечения папуло-пустулезных воспалительных акне среднетяжелой степени. Миноциклин хорошо сочетается с наружными методами терапии и повышает ее эффективность. Его можно назначать и взрослым, и детям (разрешен к применению с 8 лет). Гибкое дозирование (50/100 мг/сут) позволяет использовать препарат продолжительное время.
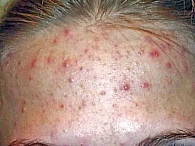
Рис. 1. Комедональная форма акне (1-я степень тяжести)
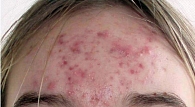
Рис. 2. Папуло-пустулезная форма акне (2-я степень тяжести)
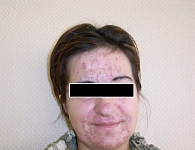
Рис. 3. Узловатая форма акне (3-я степень тяжести)

Таблица. Системные антибиотики в лечении акне
С проблемой угревых высыпаний в предпубертатном или пубертатном периоде сталкивается практически каждый человек. У одних появление акне носит транзиторный характер, у других заболевание приобретает длительное, тяжелое течение. Пик заболеваемости приходится на 15–16 лет. В пубертатном периоде акне выявляется у 90% девушек и у 100% юношей. У девушек угри появляются раньше, у юношей позже и носят более распространенный и тяжелый характер. Так, в 12-летнем возрасте акне наблюдаются у 37,1% девочек и 15,4% мальчиков, а в 16-летнем – у 38,8 и 53,3% соответственно. Угревая болезнь в подростковом периоде называется acne vulgaris. У большинства людей после 25–28 лет проявления акне постепенно стихают, и активный воспалительный процесс завершается, часто оставляя выраженные в той или иной степени косметические дефекты (постакне) [1–6].
Угревые высыпания могут присутствовать или впервые появляться у взрослых (acne adultorum). У 20% женщин за несколько дней до начала менструаций отмечается регулярное появление папуло-пустулезных высыпаний и их постепенное исчезновение в течение 5–7 дней в начале следующего менструального цикла. У ряда пациентов угревая сыпь может существовать постоянно в виде папуло-пустулезных, реже узловато-кистозных высыпаний (acne tarda). В последнее десятилетие наметилась тенденция к росту числа пациентов, преимущественно женщин, у которых дебют угревых высыпаний приходится на более поздний возраст – 25 лет и старше. Например, в США с 1990 по 1999 г. средний возраст больных акне увеличился с 26,5 до 40,5 года. Некоторые авторы подчеркивают, что в подростковом возрасте заболеваемость акне практически одинакова среди обоих полов, в то время как поздние угри свойственны в основном женщинам [3–6].
Согласно результатам многочисленных исследований, развитие и течение дерматоза во многом зависит от генетической (семейной) предрасположенности, а также от типа, цвета кожи, национальных особенностей. Акне – это генетически обусловленное наследственное мультифакториальное заболевание с высоким семейным накоплением (50%). Генетические нарушения определяют течение заболевания и детерминируют тип секреции, количество, размеры, чувствительность рецепторов себоцитов к различным агентам. Так, в многоцентровом рандомизированном исследовании, проведенном в США и Великобритании на монозиготных и дизиготных близнецах с акне и без проявлений угревых высыпаний, было установлено, что в 81% случаев ведущую роль в развитии дерматоза играют генетические факторы и лишь в 19% случаев прослеживается зависимость заболевания от факторов окружающей среды.
Y. Pang, обследовавший 445 пациентов (238 с угревыми высыпаниями различной локализации и 207 – без них), обнаружил, что число CAG-повторов в гене андрогенного рецептора и специфические гаплотипы связаны с риском развития акне и, следовательно, могут рассматриваться как достоверный маркер предрасположенности к данному заболеванию [7]. Изучение распределения акне по степени тяжести среди различных популяций также указывает на этнические особенности заболевания. Дерматоз реже развивается и протекает в более легкой форме у японцев и китайцев. У лиц европеоидной расы, напротив, отмечается высокая частота встречаемости и более тяжелое течение заболевания [8–10].
В настоящее время выделяют четыре главных патогенетических механизма, участвующих в развития акне. Инициальным звеном выступает наследственно обусловленная гиперандрогения (ГА). Она может проявляться в виде абсолютного увеличения количества андрогенов (тестостерон, дегидроэпиандростерон-сульфат, 17-гидроксипрогестерон и др.) или повышенной чувствительности рецепторов к нормальному, реже сниженному количеству андрогенов. То есть условно можно выделить абсолютную и относительную ГА. Состояние абсолютной ГА обычно наблюдается у женщин и связано с эндокринной патологией (синдром поликистозных яичников, неклассическая форма врожденной дисфункции коры надпочечников, опухоли яичников и/или надпочечников). Причиной относительной ГА является повышение активности фермента 5-альфа-редуктазы 1-го типа, которая переводит тестостерон в более активный метаболит дегидротестостерон – непосредственный стимулятор пролиферации и созревания себоцитов [11, 12].
ГА оказывает стимулирующее действие на сальные железы, увеличивая объем кожного сала. Продукция кожного сала при легкой степени акне увеличивается в 1,3 раза, при средней – в 1,7 раза, при тяжелой – в 1,9 раза. Кроме того, у больных акне сальных желез больше, чем у здоровых людей. В увеличенном объеме кожного сала снижается концентрация незаменимой альфа-линоленовой кислоты – основного регулятора дифференцировки кератиноцитов протока сально-волосяного фолликула (СВФ) – и увеличивается экспрессия фермента трансглутаминазы. В конечном итоге это приводит к фолликулярному гиперкертозу и закрытию протока СВФ с образованием открытых (черные угри) и закрытых (белые угри) комедонов в зависимости от уровня обтурации СВФ. Обтурация комедоном протока СВФ создает благоприятные условия для размножения патогенных микроорганизмов – факультативых анаэробов Propionibacterium acnes и P. granulosum, а также других представителей сапрофитной и условно патогенной микрофлоры (Staphylococcus epidermidis, St. aureus,
Pityrosporum ovale) [13, 14].
Антигены микроорганизмов привлекают к СВФ из периферической крови мононуклеарные фагоциты и нейтрофилы, которые продуцируют интерлейкины 1-альфа, 1- и 8-бета, фактор некроза опухоли альфа, стимулируют систему комплемента. Эти провоспалительные цитокины активируют фермент циклооксигеназу. В итоге из арахидоновой кислоты образуется главный медиатор воспаления – лейкотриен В₄, стимулирующий высвобождение гидролитических ферментов и монооксида азота из нейтрофилов, Т-лимфоцитов, моноцитов и эозинофилов. Разрушение стенки сальной железы с выходом ее содержимого в дерму обусловливает процесс воспаления – образование папул, пустул, узлов и кист. Результаты исследований свидетельствуют, что P. acnes может активировать экспрессию Toll-подобных рецепторов (Toll-like receptor, TLR; на сегодняшний день описано свыше 11 типов), что приводит к воспалительной реакции при акне. P. acnes активирует TLR2 и TLR4, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Кроме того, при акне повышается уровень антимикробных пептидов – бета-дефензина и кателецидина. В недавних исследованиях было выявлено, что P. acnes может активировать систему инсулиноподобного фактора роста (ИФР) 1 и рецептора ИФР 1-го типа (IGF1/IGF–R1) в эпидермисе, действуя как инсулин, и способствует пролиферации кератиноцитов [15–17].
Течение акне ухудшают [1, 5]:
- постоянные механические травмы кожи (выдавливание угрей, частое мытье с мылом);
- негативное воздействие внешней среды (загрязнение кожи маслами, бензином, пылью производственного происхождения);
- прием ряда лекарственных препаратов (стероидные гормоны, галогенсодержащие препараты, противотуберкулезные средства, антидепрессанты, противоэпилептические средства);
-
неправильное использование тех или иных косметических средств, некачественная декоративная косметика.
В настоящие время установлено, что в патогенезе акне особую роль играют нейропептиды – биологически активные вещества белковой природы, выделяемые нервными окончаниями в ответ на различные стимулы. Достаточно хорошо изучено влияние одного из таких веществ – субстанции Р. Показано, что субстанция Р влияет как на деление, так и на дифференцировку клеток сальной железы. Кожа людей, склонных к акне, характеризуется обилием нервных окончаний, увеличенным числом нервов, способных секретировать субстанцию Р, а также большим числом тучных клеток. Эти исследования позволяют предложить один из механизмов взаимосвязи эмоциональных стрессов с обострениями угревой болезни. В последнее время появились публикации о влиянии пищевых продуктов на развитие угревых высыпаний. Продукты со значительным содержанием сахара и других углеводов, увеличивая уровень гликемической нагрузки, влияют на концентрацию инсулина и ИФР-1, которые способны повышать концентрацию основных андрогенов в плазме крови. Последние в свою очередь могут запустить каскад реакций, приводящих к образованию угревых высыпаний на коже [18]. В зарубежных исследованиях было показано, что курение является главным фактором в развитии комедональных акне у женщин. Связь курения с развитием невоспалительных угрей объясняется тем, что никотин увеличивает продукцию кожного сала и снижает концентрацию витамина Е [19, 20].
Акне относится к особой группе кожных заболеваний – психосоматическим дерматозам, где велика роль психоэмоциональных нарушений, связанных с дефектом внешности. Проявление дерматоза, локализующегося на открытых участках кожи – лице, верхней половине груди, спине в виде ярко-воспалительных папуло-пустулезных элементов, заканчивающихся образованием многочисленных рубцов и гиперпигментаций, часто обезображивает внешний вид пациентов и вызывает помимо физических глубокие психические страдания.
В исследовании, проведенном W. Bodermer, выявлено, что у 40% пациентов вследствие кожного заболевания, сопровождающегося косметическими дефектами, снижается социальный статус. Помимо этого такие дефекты негативно сказываются на профессиональной деятельности пациентов [21].
Согласно данным литературы тревога и депрессия – наиболее частые реакции больных на кожное заболевание. По данным
U. Stangier, коморбидность дерматологической патологии с расстройствами депрессивного спектра составляет 59–77%, тревожного 6–30% [22].
На основании проведенного анкетирования членов Британской ассоциации дерматологов было установлено, что определенный вид дерматоза увеличивает риск суицидальных попыток [23]. Элементы самоповреждающего поведения, в ряде случаев приведшего к завершенному суициду, чаще наблюдались при акне, псориазе, экземе и крапивнице. W. Вowe и соавт. подробно описали дисморфофобические расстройства (убежденность в наличии физического недостатка или уродства) у пациентов с акне, подчеркнув, что такие больные имеют высокий риск попыток самоубийства, а также представляют угрозу для своих лечащих врачей [24].
Среди пациентов с акне много (64%) неработающих женщин и женщин с неустроенной личной жизнью, недовольных своим социальным статусом. У женщин с угревыми высыпаниями отмечен более высокий уровень тревожности по сравнению с мужчинами. У мужчин с папуло-пустулезными акне более выражена тревожная симптоматика, у женщин – депрессивные расстройства [24–26].
В основе успешного лечения акне лежат 5 принципов:
- снижение повышенной секреции кожного сала;
- нормализация цикла ороговения клеток;
- эрадикация P. acnes;
- снятие воспаления;
-
удаление структур, закупоривающих поры.
Выбор методов лечения основывается на адекватной клинической оценке степени тяжести заболевания, характера высыпаний, типа кожи, наличия сопутствующей патологии [27].
Общепризнанной классификации акне до сих пор не разработано. Существует множество классификаций угревой сыпи. В дерматологической практике чаще используется классификация, предложенная Американской академией дерматологии (American Academy of Dermatology), в модификации М.А. Самгина и С.А. Монахова. Согласно этой классификации различают следующие степени тяжести акне [13]:
- 1-я степень – наличие комедонов (закрытых и открытых) и до 10 папул (рис. 1);
- 2-я степень – комедоны, папулы, до 10 пустул (рис. 2);
- 3-я степень – комедоны, папуло-пустулезная сыпь, до 3 узлов (рис. 3);
-
4-я степень – выраженная воспалительная реакция в глубоких слоях дермы с формированием множественных болезненных узлов и кист.
Среди клинических проявлений угревой болезни чаще (в 70–80% случаев) встречается средне-тяжелая – папуло-пустулезная форма. Легкая комедональная форма и самое тяжелое проявление акне – конглобатные угри – отмечаются значительно реже (у 15–20% больных).
Таким образом, базовыми препаратами на протяжении 30 лет у большинства пациентов с акне остаются антибиотики системного и наружного применения. Они оказывают бактериостатическое действие на P. acnes за счет ингибирования синтеза бактериальных белков. Эти препараты наиболее эффективны в воспалительной стадии акне. Механизм их противовоспалительного действия следующий: подавление P. acnes приводит к уменьшению концентрации свободных жирных кислот (до 50% от исходного уровня) в кожном сале и экстрацеллюлярных липаз, препараты ингибируют хемотаксис нейтрофилов и активность провоспалительных цитокинов и металлопротеаз [1, 4, 6, 7, 28, 29].
При лечении акне антибиотиками необходимо придерживаться следующих рекомендаций [28].
- Антибиотики показаны для лечения акне средне-тяжелой и тяжелой степени.
- При назначении антибиотиков необходимо учитывать весь спектр их антимикробного действия, поскольку P. acnes не единственный микроорганизм, ответственный за развитие воспалительных реакций у пациентов с акне.
- Длительность терапии должна составлять в среднем 6–8 недель, максимально до 18 недель, но в случае непереносимости и неэффективности других средств лечение может быть продолжено.
- Не следует назначать антибиотики в качестве монотерапии.
- Целесообразно комбинировать антибиотики с бензилпероксидом (БПО) или адапаленом для повышения эффективности терапии, у женщин – с гормональной терапией. БПО также нужно назначать между курсами антибиотиков с целью снижения микробной резистентности.
-
Не следует назначать разные по химической структуре антибиотики при пероральном и местном применении.
Для лечения акне используются системные антибиотики – миноциклин, доксициклин, тетрациклин и эритромицин (см. таблицу).
Тетрациклины и макролиды, особенно эритромицин, способны вызывать побочные эффекты со стороны желудочно-кишечного тракта (дискомфорт, тошнота, диспепсия, дисбактериоз). Следствием дисбактериоза могут быть также грамотрицательный фолликулит и питироспорум-фолликулит. Тетрациклинам, особенно доксициклину, свойственны фототоксические реакции. Однако на сегодняшний день основной проблемой длительной антибиотикотерапии является возрастающая антибиотикорезистентность микробной флоры. Так, до широкого внедрения в практику местных антибиотиков случаи устойчивости
P. acnes отмечались крайне редко. Активное использование наружных лекарственных средств с эритромицином и клиндамицином в лечении акне привело к развитию резистентности P. acnes к этим препаратам. По обобщенным за 20 лет данным (с 1976 по 1996 г.), она выросла с 0 до 62%. Случаи резистентности P. acnes к макролидам (эритромицин) и линдамицинам (клиндамицин) были зафиксированы в США, Европе, Австралии, на Дальнем Востоке. Из-за длительного и не всегда рационального применения антибиотиков P. acnes и P. granulosum приобрели устойчивость к макролидам (мутация в локусе 23S p-РНК) и тетрациклинам (мутация в локусе 16S p-РНК) [7, 28, 29].
В 2006 г. FDA (Food and Drug Administration – Управление по контролю качества пищевых продуктов и лекарственных препаратов (США)) одобрило новые расширенные рекомендации по применению миноциклина в терапии угревой болезни. Эти рекомендации позволили существенно нивелировать некоторые дозозависимые побочные реакции (вестибулопатия, тошнота, рвота, головокружение, редкие аутоиммунные реакции), а также выработать гибкий режим дозирования. Последние рекомендуемые режимы лечения акне: миноциклин в дозе 50–100 мг 1–2 раза в день по старой схеме либо в дозе 1 мг/кг ежедневно согласно новым рекомендациям [30].
Проведенные исследования показали, что миноциклин активнее проникает в жировые фолликулы и подавляет рост P. acnes быстрее, чем тетрациклин и эритромицин. Кроме того, в отличие от тетрациклина миноциклин можно применять с пищей, что позволяет пациентам лучше соблюдать режим лечения и улучшает комплаенс [29].
L. Maffeis и S. Veraldi отмечают, что миноциклин высокоэффективен в отношении широкого спектра аэробных и анаэробных грамположительных и грамотрицательных бактерий, в том числе P. acnes. В исследовании, проведенном в Тоямском медицинском и фармацевтическом университете (Toyama Medical & Pharmaceutical Universitу, Япония), было установлено, что миноциклин эффективно подавляет синтез P. granulosum – микроорганизма, также часто встречающегося при акне. L. Maffeis и S. Veraldi особо подчеркивают, что резистентность патогенных микроорганизмов к миноциклину составляет менее 5%. Эффективность миноциклина в терапии акне объясняется его высокой липофильностью, что способствует его активному проникновению в сальные железы и накоплению в пилосебоцитном комплексе. Миноциклин оказывает также противовоспалительное действие, обусловленное угнетением нейтрофильного хемотаксиса, ингибицией провоспалительных цитокинов и подавлением в кожном сале синтеза свободных жирных кислот и бактериальных липаз [30, 31].
В исследовании F. Ochsendorf было показано, что резистентность антимикробной флоры к препаратам группы тетрациклина составляет 20%, а эритромицина – 50%. При этом доксициклин и миноциклин, обладая большим периодом полураспада по сравнению с тетрациклином, вызывают меньше побочных эффектов. Наилучшую фармакокинетику среди препаратов тетрациклинового ряда демонстрирует миноциклин. При его назначении побочные эффекты регистрируются редко. При необходимости системные антибиотики можно комбинировать с топическими ретиноидами или БПО [32].
В другом исследовании сравнивали эффективность миноциклина и лимециклина в лечении папуло-пустулезных форм угревой болезни. В двойном слепом рандомизированном исследовании участвовали 86 пациентов обоего пола с акне средней степени тяжести. Пациенты были разделены на 3 группы: в 1-й группе назначали лимециклин в дозе 300 мг в день в течение 12 недель, во 2-й – миноциклин (Минолексин®) в дозе 50 мг ежедневно в течение 12 недель, в 3-й – миноциклин (Минолексин®) 100 мг в день в течение 4 недель, затем 50 мг ежедневно в течение 8 недель. Эффективность терапии оценивали 1 раз в 3 недели с помощью подсчета акне-элементов, а также метода двойной проточной цитометрии. Максимальный клинический эффект от терапии (регресс папуло-пустулезных высыпаний и уменьшение бактериальной обсемененности) наблюдался у пациентов 3-й группы, а минимальный – у больных 1-й группы [33].
H.P. Gollnick, K. Graupe, R.P. Zaumseil провели открытое рандомизированное исследование по сравнению эффективности изотретиноина и комбинации перорального миноциклина в сочетании с 20%-ным кремом азелаиновой кислоты при тяжелых формах акне. В исследовании приняли участие 85 пациентов с конглобатными акне и тяжелой формой папуло-пустулезных акне с единичными узлами. Пациенты были разделены на 2 группы: 1-я группа (50 пациентов) получала миноциклин (Минолексин®) в комбинации с 20%-ной азелаиновой кислотой в форме крема, 2-я (35 пациентов) – изотретиноин в качестве монотерапии. Терапию проводили в течение 6 месяцев. В целом лечение оказалось эффективным в обеих группах. Комбинированная терапия была чуть менее эффективна по сравнению с приемом изотретиноина. В 1-й группе средний регресс комедонов достиг 70%, папул и пустул – 88%, узловато-инфильтративных элементов – 100%. Во 2-й группе количество комедонов уменьшилось на 83%, папул и пустул – на 97%, узловато-инфильтративных элементов – на 100%. Однако комбинированную терапию пациенты переносили лучше , чем терапию изотретиноином. Частота системных побочных эффектов при комбинированной терапии была значительно ниже – 8% (в основном желудочно-кишечные симптомы) по сравнению с 14,3% в группе больных, получавших изотретиноин. Частота местных побочных эффектов была значительно ниже у больных при использовании миноциклина и азелаиновой кислоты – 36,5 против 65,7% – и проявлялась в основном непостоянным жжением и зудом легкой или умеренной интенсивности. Авторы делают вывод, что терапия 20%-ным кремом азелаиновой кислоты в сочетании с пероральным миноциклином высокоэффективна в лечении тяжелых форм акне. Подобная терапия лучше переносится, вызывает меньше побочных реакций по сравнению с терапией изотретиноином, в частности не имеет тератогенного эффекта [34].
Таким образом, Минолексин® (миноциклин) является высокоэффективным препаратом для лечения папуло-пустулезных воспалительных акне средне-тяжелой степени. Препарат можно назначать взрослым и подросткам (разрешен к применению с 8 лет). Минолексин® (миноциклин) эффективен в отношении широкого спектра грамположительных и грамотрицательных бактерий, в том числе P. acnes и P. granulosum, и обладает выраженным противовоспалительным действием. Препарат хорошо сочетается с наружными методами противоугревой терапии – БПО, азелаиновой кислотой, ретиноидами, что улучшает эффективность противоугревой терапии. Возможность индивидуального подбора режима приема препарата (гибкое дозирование Минолексина (миноциклин) 50/100 мг в день) позволяет использовать его длительно, минимизируя количество побочных эффектов. Препарат можно применять с пищей, благодаря чему пациенты лучшее соблюдают режим терапии и сохраняют приверженность лечению.
1. Майорова А.В., Шаповалов В.С., Ахтямов С.Н. Угревая болезнь в практике врача-дерматокосметолога. М.: Фирма Кавель, 2005.
2. Эллинг Д. Секреты дерматологии. СПб., 1999. 513 с.
3. Collier C.N., Harper J.C., Cafardi J.A. et al. The prevalence of acne in adults 20 years and older // J. Am. Acad. Dermatol. 2008. Vol. 58. № 1. Р. 56–59.
4. Del Rosso J.Q., Bikowski J., Baum E. Prevalence of truncal acne vulgaris: a population study based on private practice experience // J. Am. Acad. Dermatol. 2007. Vol. 56. AB3.
5. Руководство по дерматокосметологии / под ред. Е.Р. Аравийской и Е.В. Соколовского. СПб.: ФОЛИАНТ, 2008.
6. Dreno B., Poli F. Epidemiology of acne. 20th World Congress Dermatology // Ann. Dermatol. Venerol. 2002. Is. 132.
7. Pang Y., He C.D., Liu Y.J. et al. Combination of short CAG and GGN repeats in the androgen receptor gene is associated with acne risk in North East China // Eur. Acad. Dermatol. Venereol. 2008. Vol. 22. № 12. Р. 1445–1451.
8. Pang Y., He C.D., Liu Y.J. et al. Combination of short CAG and GGN repeats in the androgen receptor gene is associated with acne risk in North East China // Eur. Acad. Dermatol. Venereol. 2008. Vol. 22. № 12. Р. 1445–1451.
9. Самцов А.В. Акне и акнеформные дерматозы. М., 2009. 287 с.
10. Суворова К.Н., Котова Н.В. Тяжелые формы акне // Международный медицинский журнал. 2000. С. 732–726.
11. Bataille V., Snieder H., MacGregor A.J. et al. The influence of genetics and environmental factors in the pathogenesis of acne: a twin study of acne in women // J. Invest. Dermatol. 2002. Vol. 119. № 6. Р. 1317–1322.
12. Горячкина М.В. Роль гормонально-эндокринных факторов в патогенезе рефрактерных форм угревой болезни у женщин: автореф. дис. … канд. мед. наук. М., 2009.
13. Vexiau P., Baspeyras M., Chaspoux C. et al. Acne in adult women: data from a national study on the relationship between type of acne and markers of clinical hyperandrogenism // Ann. Dermatol. Venereol. 2002. Vol. 129. № 2. Р. 174–178.
14. Монахов С.А., Иванов О.Л. Акне. Методическое пособие для врачей. М., 2010.
15. Webster G.F. Acne vulgaris // BMJ. 2002. Vol. 325. № 7362. Р. 475.
16. Jappe U., Ingham E., Henwood J. et al. Propionibacterium acnes and inflammation in acne; P. acnes has T-cell mitogenic activity // Br. J. Dermatol. 2002. Vol. 146. № 2. Р. 202–209.
17. Heymann W.R. Toll-like receptors in acne vulgaris // J. Am. Acad. Dermatol. 2006. Vol. 55. № 4. Р. 691–692.
18. Isard O., Knol A.C., Ariès M.F. et al. Propionibacterium acnes activates the IGF-1/IGF-1R system in the epidermis and induces keratinocyte proliferation // J. Invest. Dermatol. 2011. Vol. 131. № 1. Р. 59–66.
19. Melnik B.C., Schmitz G. Role of insulin, insulin-like growth factor-1, hyperglycaemic food and milk consumption in the pathogenesis of acne vulgaris // Exp. Dermatol. 2009. Vol. 18. № 10. Р. 833–841.
20. Capitanio B., Sinagra J.L., Ottaviani M. et al. Acne and smoking // Dermatoendocrinol. 2009. Vol. 1. № 3. Р. 129–135.
21. Gupta M.A., Gupta A.K. The psychological comorbidity in acne // Clin. Dermatol. 2001. Vol. 19. № 3. Р. 360–363.
22. Bodermer W. Psychosodermatology // Medicine Journal. 2001. № 6. Р. 297–302.
23. Stangier U. Hautkrankheiten und Koerperdysmorphe Stroerung. Hogrefe-Verlag, 2002.
24. Cotterill J.A., Cunliffe W.J. Suicide in dermatological patients // Br. J. Dermatol. 1997. Vol. 137. № 2. Р. 246–250.
25. Bowe W.P., Leyden J.J., Crerand C.E. et al. Body dysmorphic disorder symptoms among patients with acne vulgaris // J. Am. Acad. Dermatol. 2007. Vol. 57. № 2. Р. 222–230.
26. Монахов С.А. Дифференцированная терапия акне с учетом тяжести кожного процесса и спектра психоэмоциональных расстройств: автореф. дис. … канд. мед. наук. М., 2005.
27. Горячкина М.В. Роль психоэмоциональных факторов в развитии акне // Concilium Medicum. Дерматология. 2008. № 2. С. 8–12.
28. Горячкина М.В., Белоусова Т.А., Ткаченко С.Б. Современная стратегия дерматокосметологического лечения угревой болезни // Экспериментальная и клиническая дерматокосметология. 2012. № 1. С. 17–23.
29. Gollnick H.P., Krautheim A. Topical treatment in acne: current status and future aspects // Dermatology. 2003. Vol. 206. № 1. Р. 29–36.
30. Ho V., Schachter D., Miller R. et al. Acne Management for the 90s: Current Treatment Guidelines // Cdn. J. Diagnosis. 1995. Suppl. 12. Р. 1–25.
31. Maffeis L., Veraldi S. Minocycline in the treatment of acne: latest findings // G. Ital. Dermatol. Venereol. 2010. Vol. 145. № 3. Р. 425–429.
32. Higaki S., Kitagawa T., Morohashi M. еt al. Minocycline effectively reduces acid producted by Propionibacterium granulosum // J. Dermatol. 2002. Vol. 29. № 1. Р. 20–22.
33. chsendorf F. Systemic antibiotic therapy of acne vulgaris // J. Dtsch. Dermatol. Ges. 2006. Vol. 4. № 10. Р. 828–841.
34. Piérard-Franchimont C., Goffin V., Arrese J.E. et al. Lymecycline and minocycline in inflammatory acne: a randomized, double-blind intent-to-treat study on clinical and in vivo antibacterial efficacy // Skin Pharmacol. Appl. Skin Physiol. 2002. Vol. 15. № 2. Р. 112–119.
35. Gollnick H.P., Graupe K., Zaumseil R.P. Comparison of combined azelaic acid cream plus oral minocycline with oral isotretinoin in severe acne // Eur. J. Dermatol. 2001. Vol. 11. № 6. Р. 538–544.
Antibiotics in therapy of acne: a problem of rational choice
T.A. Belousova, M.V. Goryachkina
I.M. Sechenov First Moscow State Medical University
Contact person: Tatyana Alekseyevna Belousova, belka-1147@mail.ru
Minocycline (Minolexin) is a potent agent for the treatment of moderate and severe papulopustular inflammatory acne. When combined with topical drugs, Minocycline improve their efficacy. Minocycline may be used in adult and pediatric patients (from the age of 8). Flexible dosing of minocycline (50/100 mg/daily) offers the possibility of long-term treatment.
Новости на тему
07.02.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.