Клинические, эндоскопические и морфологические признаки хронического аутоиммунного гастрита с учетом статуса инфицирования Helicobacter pylori
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведено открытое когортное исследование методом поперечного среза с включением 124 участников с хроническим гастритом в возрасте от 18 до 75 лет (медиана возраста – 56 [47,5–65,0] лет). В основную группу было включено 35 пациентов с аутоиммунным гастритом (АИГ) (медиана возраста – 54 [43; 61] года). В группу сравнения 1 вошли 38 пациентов с H. рylori-ассоциированным и аутоиммунным гастритом (медиана возраста – 56 [49; 63] лет). Группа сравнения 2 состояла из 51 пациента с H. рylori-ассоциированным гастритом (медиана возраста – 58 [48; 64] лет). Анализ выраженности и встречаемости гастроинтестинальных симптомов у пациентов проводили с использованием опросника GSRS в дебюте заболевания и на момент включения в исследование. Выполнена оценка распространенности и интенсивности проявлений анемического, сидеропенического синдромов, дефицита витамина В12. Уточнялась информация о наличии сопутствующих аутоиммунных заболеваний, железодефицитной и В12-дефицитной анемии. Проведен анализ результатов лабораторных исследований, данных эндоскопического и морфологического исследований гастробиоптатов слизистой оболочки желудка (СОЖ) с забором по системе OLGA.
Результаты. Выделены наиболее информативные диагностические признаки АИГ у пациентов с различным статусом инфицирования H. рylori: наличие симптомов диспепсии по типу постпрандиального дистресс-синдрома, а также проявлений дефицита витамина В12, анемического и сидеропенического синдромов, коморбидность с аутоиммунным тиреоидитом, наличие эндоскопических и морфологических признаков атрофии и кишечной метаплазии СОЖ с обязательным вовлечением тела желудка. У пациентов с АИГ и отсутствием инфицирования H. рylori в анамнезе возможно выявление признаков воспаления и атрофии СОЖ антрального отдела вследствие модуляции микробиоты желудка на фоне гипохлоргидрии.
Заключение. По результатам исследования выделены наиболее значимые диагностические признаки АИГ у лиц с разным статусом инфицирования H. рylori, что может помочь клиницисту своевременно распознать аутоиммунное воспаление в СОЖ. Наличие признаков атрофических изменений в антральном отделе желудка у пациентов с АИГ и негативным статусом H. рylori нуждается в дальнейшем изучении.
Материал и методы. Проведено открытое когортное исследование методом поперечного среза с включением 124 участников с хроническим гастритом в возрасте от 18 до 75 лет (медиана возраста – 56 [47,5–65,0] лет). В основную группу было включено 35 пациентов с аутоиммунным гастритом (АИГ) (медиана возраста – 54 [43; 61] года). В группу сравнения 1 вошли 38 пациентов с H. рylori-ассоциированным и аутоиммунным гастритом (медиана возраста – 56 [49; 63] лет). Группа сравнения 2 состояла из 51 пациента с H. рylori-ассоциированным гастритом (медиана возраста – 58 [48; 64] лет). Анализ выраженности и встречаемости гастроинтестинальных симптомов у пациентов проводили с использованием опросника GSRS в дебюте заболевания и на момент включения в исследование. Выполнена оценка распространенности и интенсивности проявлений анемического, сидеропенического синдромов, дефицита витамина В12. Уточнялась информация о наличии сопутствующих аутоиммунных заболеваний, железодефицитной и В12-дефицитной анемии. Проведен анализ результатов лабораторных исследований, данных эндоскопического и морфологического исследований гастробиоптатов слизистой оболочки желудка (СОЖ) с забором по системе OLGA.
Результаты. Выделены наиболее информативные диагностические признаки АИГ у пациентов с различным статусом инфицирования H. рylori: наличие симптомов диспепсии по типу постпрандиального дистресс-синдрома, а также проявлений дефицита витамина В12, анемического и сидеропенического синдромов, коморбидность с аутоиммунным тиреоидитом, наличие эндоскопических и морфологических признаков атрофии и кишечной метаплазии СОЖ с обязательным вовлечением тела желудка. У пациентов с АИГ и отсутствием инфицирования H. рylori в анамнезе возможно выявление признаков воспаления и атрофии СОЖ антрального отдела вследствие модуляции микробиоты желудка на фоне гипохлоргидрии.
Заключение. По результатам исследования выделены наиболее значимые диагностические признаки АИГ у лиц с разным статусом инфицирования H. рylori, что может помочь клиницисту своевременно распознать аутоиммунное воспаление в СОЖ. Наличие признаков атрофических изменений в антральном отделе желудка у пациентов с АИГ и негативным статусом H. рylori нуждается в дальнейшем изучении.

Введение
Аутоиммунное воспаление слизистой оболочки желудка (СОЖ) наряду с инфекцией Helicobacter pylori (H. pylori) относится к одним из наиболее часто встречающихся этиологических факторов хронического гастрита (ХГ).
Диагностика на наличие инфицирования бактерией H. pylori является обязательной при обращении пациента с синдромом диспепсии, а также при обследовании по поводу ХГ. Тогда как выявление аутоиммунного воспаления, особенно у лиц с сопутствующей инфекцией H. pylori, запаздывает, что связано с преимущественным вниманием клиницистов в отношении выявления инфекта с одной стороны, а с другой – отсутствием четких диагностических критериев, позволяющих установить аутоиммунный гастрит (АИГ) на этапе первичного контакта.
Для улучшения диагностики АИГ у лиц с различным статусом инфицирования H. pylori было проведено открытое когортное исследование методом поперечного среза с целью выявления наиболее информативных клинических, эндоскопических и морфологических признаков заболевания.
Материал и методы
Протокол исследования был одобрен локальным этическим комитетом Омского государственного медицинского университета. Исследовательская выборка включала 124 пациента. После получения исчерпывающей информации о планируемом исследовании всеми участниками было подписано информированное согласие на участие.
Критерии включения:
- возраст (от 18 до 75 лет);
- установленный диагноз ХГ (для пациентов основной группы – АИГ; для группы сравнения 1 – H. рylori-ассоциированный + аутоиммунный гастрит; для группы сравнения 2 – H. рylori-ассоциированный гастрит);
- наличие подписанного информированного согласия на участие в исследовании.
Критерии исключения:
- язвенная болезнь желудка или двенадцатиперстной кишки;
- перенесенные оперативные вмешательства на желудке или объемные операции на желудочно-кишечном тракте;
- противопоказания к эндоскопическому исследованию;
- беременность, период грудного вскармливания;
- низкая комплаентность;
- онкологические заболевания;
- тяжелые сопутствующие заболевания (артериальная гипертензия III степени некорригированная, сахарный диабет декомпенсированный, хроническая сердечная недостаточность, функциональный класс III–IV, наличие в анамнезе инфарктов, инсультов);
- прием препаратов/биологически активных добавок, способных индуцировать лекарственную гастропатию.
Всем пациентам выполняли эзофагогастродуоденоскопию (ЭГДС) аппаратом экспертного класса с функцией близкого фокуса NBI с использованием видеогастроскопа Olympus CF – HQ 190, с проведением быстрого уреазного теста на H. pylori с использованием тест-системы Biohit и забором гастробиоптатов по системе OLGA [1], в заключение фиксировали степень и стадию гастрита (от 0 до IV) согласно Российскому пересмотру Международной классификации ХГ.
Диагноз ХГ устанавливали в соответствии с утвержденными Министерством здравоохранения Российской Федерации клиническими рекомендациями по ведению пациентов с гастритом и дуоденитом [2].
При включении в исследование всем больным проводили оценку наличия и выраженности гастроинтестинальных симптомов в дебюте заболевания и непосредственно на момент включения с использованием опросника GSRS, который валидирован Российским межнациональным центром исследования качества жизни (Санкт-Петербург). Данный опросник включает 15 пунктов, дополнительно разделенных на пять шкал: абдоминальная боль (вопросы 1, 4), гастроэзофагеальный рефлюкс (вопросы 2, 3, 5), диарейный синдром (вопросы 11, 12, 14), вздутие, переполнение и распирание живота (вопросы 6, 7, 8, 9), синдром запора (вопросы 10, 13, 15) [3]. Ответы на каждый вопрос представлены в семи вариантах, отражающих степень выраженности жалоб в виде балльной системы, где 7 баллов – очень сильно беспокоящие симптомы. Дополнительно оценивали интенсивность и встречаемость проявлений анемического и сидеропенического синдромов в дебюте заболевания и на момент включения, в том числе анализ признаков дефицита витамина В12, с использованием четырехбалльной шкалы выраженности, где 0 баллов – отсутствие проявлений, а 3 балла – сильно беспокоящие жалобы.
При расспросе пациентов важное внимание уделялось сбору анамнеза заболевания, а именно: данным дебюта симптомов синдрома диспепсии, а также наличию проявлений анемического, сидеропенического синдромов и дефицита витамина В12. У пациентов при уточнении анамнеза жизни акцент был сделан на наличие сопутствующих аутоиммунных заболеваний и отягощенной наследственности по раку желудка. В отношении лекарственного анамнеза обследуемые были опрошены о проводимой ранее эрадикационной терапии и ее эффективности, а также о принимаемых в течение последних шести месяцев препаратах, способствующих развитию лекарственной гастропатии: нестероидных противовоспалительных средств, ацетилсалициловой кислоты, антикоагулянтов, цитостатиков, глюкокортикостероидов, противоопухолевых препаратов и др. [4].
Всем пациентам, включенным в исследование, проводили физикальный осмотр с оценкой кожных покровов и видимых слизистых, а также осмотр и пальпацию живота.
Лабораторное исследование состояло из общего анализа крови (ОАК) с обязательной оценкой эритроцитарных индексов, определения уровня ферритина, сывороточного железа, трансферрина, общей железосвязывающей способности сыворотки (ОЖСС), витамина В12 и фолиевой кислоты. Серологическое исследование включало определение антител к париетальным клеткам желудка, Ig G и внутреннему фактору Касла.
В зависимости от статуса инфекции H. рylori и наличия аутоиммунного воспаления пациенты были распределены на три группы: основная группа включала больных АИГ, группа сравнения 1 – пациентов с H. рylori-ассоциированным гастритом + АИГ, группа сравнения 2 – с H. рylori-ассоциированным гастритом.
Анализ полученных данных статистики проводили с использованием пакета StatSoft Statistica 8 (StatSoft Inc, США) и программы Microsoft Excel (Microsoft, США). Ввиду распределения в выборках, отличного от нормального, при проверке с использованием критериев Шапиро – Уилка и Колмогорова – Смирнова для сравнения двух независимых друг от друга групп внутри выборки по количественным признакам использовали критерий Манна – Уитни (Mann – Withney U-test), трех и более групп – критерий Краскела – Уоллиса (Kruskal – Wallis Н-test). Для сравнения качественных признаков в группах применяли информационную статистику Кульбака (2I) и критерий сопряженности χ2 Пирсона, при объеме наблюдений в выборке менее 30 использовали критерий Фишера. На всех этапах статистического расчета уровень значимости p принимали равным 0,05. Количественные данные представлены как медиана (Ме) и межквартильный интервал в виде Me [Р25; Р75].
Результаты
Возраст участников исследования составил 56 [47,5; 65] лет, из них 107 (86,3%) женщин с медианой возраста 56 [46; 65] лет и 17 (13,7%) мужчин с медианой возраста 57 [55; 64] лет.
В основную группу входили 35 человек (Ме 54 [43; 61] года), в группу сравнения 1 – 38 человек (Ме 56 [49; 63] лет), в группу сравнения 2 – 51 человек (Ме 58 [48; 64] лет).
При анализе возраста дебюта заболевания у пациентов, включенных в исследование, было установлено, что синдромы диспепсии, анемический, дефицита витамина В12 у больных АИГ чаще встречались в возрасте 30–39 лет (37,1%), при смешанном генезе гастрита (АИГ + H. рylori) – 40–49 (36,9%) и 50–59 (31,6%) лет, у пациентов с H. рylori-ассоциированным гастритом – в возрасте 40–49 (43,2%) и 50–59 (37,3%) лет (рис. 1).
Длительность заболевания до установления диагноза АИГ в основной группе составила Ме 7,3 [3,3; 12,4] года, а в группе сравнения 1 – Ме 6,9 [4,8; 14,3] года.
Выраженность и встречаемость гастроинтестинальных симптомов оценивали в соответствии с опросником GSRS в дебюте заболевания и на момент включения в исследование. В дебюте заболевания в основной группе и группе сравнения 1 отмечалось статистические значимое увеличение интенсивности постпрандиального дистресс-синдрома (в виде чувства распирания, переполнения в животе) (p = 0,014 и р = 0,044, U-критерий Манна – Уитни), а также жалоб на урчание в животе (p = 0,011 и р = 0,003, U-критерий Манна – Уитни), метеоризм (p = 0,035, U-критерий Манна – Уитни) и синдром диареи (p = 0,047 и р = 0,037, U-критерий Манна – Уитни). В группе пациентов с АИГ+ H. Рylori в дебюте заболевания было отмечено увеличение выраженности боли в верхних отделах живота по сравнению с основной группой и группой сравнения 2 (p = 0,047, U-критерий Манна – Уитни).
На момент включения в исследование статистически значимых различий интенсивности гастроинтестинальных симптомов в группах сравнения не получено.
При анализе встречаемости симптомов, согласно опроснику GSRS, в дебюте заболевания у пациентов основной группы и группы сравнения 1 статистически значимо чаще отмечались жалобы на урчание в животе (р = 0,031, p = 0,003, критерий Фишера), а также на проявления синдрома диареи в группе сравнения 1 (p = 0,018, критерий Фишера).
На момент включения в исследование выявлено статистически достоверное повышение распространенности урчания в животе в основной группе (p = 0,021, критерий Фишера), метеоризма в группе сравнения 1 (p = 0,045, критерий Фишера). При анализе частоты встречаемости жалоб на эпигастральную боль, чувство тяжести и раннего насыщения статистически значимых различий не получено.
При анализе распространенности проявлений анемического синдрома в дебюте заболевания было отмечено, что такие симптомы, как общая слабость, утомляемость, головокружение, шум в ушах, одышка при привычной физической нагрузке, учащенное сердцебиение, мелькание мушек перед глазами, статистически чаще встречались в основной группе и группе сравнения 1 (p = 0,001, критерий Фишера). При оценке данных симптомов на момент включения в исследование было выявлено статистически значимое увеличение встречаемости проявлений общей слабости, утомляемости, головокружения, одышки при привычной физической нагрузке в основной группе и группе сравнения 1 (p = 0,01 и p = 0,001, критерий Фишера), а также жалоб на учащенное сердцебиение и мелькание мушек перед глазами в основной группе (р = 0,011 и p = 0,005, критерий Фишера), шум в ушах в группе сравнения 1 (p = 0,025, критерий Фишера).
Анализ встречаемости симптомов сидеропенического синдрома у исследуемых пациентов выявил статистически значимое превалирование распространенности жалоб на сухость кожи, сухость и ломкость волос, истончение ногтей в основной группе и группе сравнения 1 как в дебюте заболевания (p = 0,001, критерий Фишера), так и на момент включения в исследование (p = 0,001, критерий Фишера).
При оценке встречаемости симптомов дефицита витамина В12 отмечалось статистически значимое увеличение распространенности жалоб на онемение и парестезии конечностей, шаткость при ходьбе, жжение языка в группах пациентов с АИГ и различным статусом инфицирования H. рylori в дебюте заболевания (p = 0,001, критерий Фишера) и на момент включения в исследование (p = 0,001, критерий Фишера).
Сопоставление данных о частоте встречаемости сопутствующей аутоиммунной патологии в исследуемых группах выявило статистически значимое увеличение распространенности аутоиммунного тиреоидита (АИТ) у пациентов с АИГ по сравнению с H. рylori-ассоциированным гастритом без аутоиммунного поражения (основная группа (p = 0,009, критерий Фишера) и группа сравнения 1 (p = 0,001, критерий Фишера)). Распространенность других аутоиммунных заболеваний, таких как сахарный диабет 1-го типа, витилиго, первичный билиарный холангит, статистически не различалась по группам сравнения.
При анализе сопутствующей терапии у пациентов, включенных в исследование, было выявлено, что статистически достоверно чаще курсы приема препаратов железа и витамина В12 в анамнезе по поводу их дефицита отмечены у пациентов основной группы (p = 0,001, критерий Фишера) и группы сравнения 1 (p = 0,001, критерий Фишера).
При сопоставлении данных о частоте встречаемости отягощенного наследственного анамнеза по раку желудка установлено, что статистически значимо чаще анамнез был отягощен в группе с АИГ, ассоциированным с H. рylori, по сравнению с основной группой (p = 0,021, критерий Фишера), статистически достоверных различий между группами с АИГ и H. рylori-ассоциированным гастритом не было получено (р = 0,089, критерий Фишера).
При объективном осмотре статистически значимо чаще встречались проявления анемического синдрома, такие как бледность кожных покровов, у пациентов основной группы (p = 0,001, критерий Фишера) и группы сравнения 1 (p = 0,019, критерий Фишера), а также снижение тургора кожи в группе пациентов с АИГ без H. рylori (p = 0,004, критерий Фишера).
При сравнении результатов ОАК пациентов, включенных в исследование, были выявлены статистически значимые изменения в основной группе и группе сравнения 1. В основной группе значения гемоглобина – 128 [115; 131] и средней концентрации гемоглобина в эритроците (MCHC) – 32,9 [30,9; 33,8] (p = 0,009 и p = 0,014, U-критерий Манна – Уитни), а также в группе сравнения 1 показатели гемоглобина – 127,5 [113; 136], MCHC – 32,85 [31,3; 33,6] и среднего содержания гемоглобина в эритроците (МСН) – 28 [25,6; 29,4] были статистически достоверно ниже при сопоставлении с группой сравнения 2 (p = 0,034, p = 0,001, р = 0,042, U-критерий Манна – Уитни).
Анализ количественных показателей обмена железа выявил статистически значимое снижение в группах пациентов с АИГ и АИГ + H. рylori уровня сывороточного железа – 13,6 [6,3; 17,4] и 12,7 [6,6; 18], ферритина – 18,2 [10,9; 34,9] и 16,1 [11,2; 31,7], а также повышение значений трансферрина – 3,1 [2,7; 3,5] и 3,1 [2,6; 3,2], увеличение ОЖСС – 70,2 [60,2; 84,3] и 71,5 [66,9; 81,6] (p = 0,001, U-критерий Манна – Уитни). Снижение содержания ферритина констатировали при его уровне менее 30 мг/дл [5].
В основной группе и группе сравнения 1 наблюдалось статистически значимое снижение уровня витамина В12 – 156 [118; 177] и 245 [156; 412] (p = 0,005, U-критерий Манна – Уитни) соответственно. При сравнении групп пациентов с АИГ без H. рylori и с АИГ, ассоциированным с H. рylori, отмечено статистически достоверно более выраженное снижение уровня витамина В12 у пациентов основной группы (р = 0,002, критерий Манна – Уитни).
Каждому пациенту было проведено эндоскопическое исследование аппаратом экспертного класса с функцией близкого фокуса NBI. У всех участников исследования с АИГ были выявлены эндоскопические признаки атрофических изменений в теле желудка, имеющие статистическую значимость (p = 0,001, критерий Фишера) по сравнению с пациентами группы H. рylori-ассоциированного гастрита.
У 18 (24,6%) пациентов с АИГ при эндоскопическом исследовании были выявлены белые сферические очаги, являющиеся патогномоничными для АИГ и представляющие собой белесоватые, круглые, выступающие очаги вследствие кистозного расширения фундальных желез желудка [6]. Среди пациентов группы сравнения 2 данный эндоскопический признак не был определен.
У 14 (40%) больных с АИГ без инфицирования H. рylori наблюдались эндоскопические признаки атрофии и в антральном отделе. В то же время при морфологическом исследовании гастробиоптатов лишь у 4 (11,4%) пациентов определялись слабая атрофия и очаговая полная кишечная метаплазия. В группе пациентов с АИГ, ассоциированным с H. рylori, распространенность эндоскопических признаков мультифокального атрофического гастрита статистически значимо была выше (p = 0,007, критерий Фишера) при сравнении с основной группой и без статистической значимости при сопоставлении с группой пациентов с H. рylori-ассоциированным гастритом (p = 0,064, критерий Фишера).
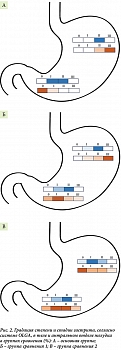
В результате оценки полученных данных морфологического исследования гастробиоптатов с применением системы OLGA согласно Российскому пересмотру Международной классификации ХГ, выявлено, что в группах пациентов с АИГ и АИГ в сочетании с H. рylori превалировала степень воспаления III (54,3 и 60,5%) в сравнении с группой больных H. рylori-ассоциированным гастритом, где преобладала степень II (56,8%), данные различия были статистически значимы (р = 0,011, критерий Фишера). При анализе стадии гастрита было отмечено, что в основной группе и группе сравнения 1 чаще определялась стадия атрофии III в сопоставлении с группой сравнения 2, что имело статистическую значимость (p = 0,001, критерий Фишера). При сопоставлении результатов градации стадии гастрита согласно системе OLGA в группах пациентов с АИГ не получено статистически значимых различий (р = 0,081, критерий Фишера). В то же время при анализе наличия и выраженности атрофии тела желудка в основной группе и группе сравнения 1 статистически достоверно превалировала выраженная атрофия (р = 0,001, критерий Фишера), по данным Российского пересмотра Международной классификации ХГ относящаяся к стадии атрофии III (рис. 2). В группе пациентов с H. рylori-ассоциированным гастритом в 51% случаев в теле желудка отмечено отсутствие морфологических данных по наличию атрофии. В группах пациентов с АИГ статистически достоверно чаще в теле желудка встречались такие изменения, как псевдопилорическая метаплазия (р = 0,001) и полная кишечная метаплазия (р = 0,001). Статистически значимых различий между пациентами основной группы и группы сравнения 1 по данным признакам не отмечено.
Дополнительно с вовлечением в патологический процесс тела желудка у пациентов с АИГ в сочетании с инфекцией H. рylori встречались изменения и в антральном отделе: в 44,7% случаев было отмечено наличие полной кишечной метаплазии, тип I, что имело статистическую достоверность (р = 0,001, критерий Фишера) по сравнению с основной группой и было ассоциировано с инфицированием бактерией H. рylori.
Обсуждение
Согласно представленным результатам проведенного клинического исследования, в группах пациентов с АИГ в дебюте заболевания отмечалось увеличение интенсивности симптомов постпрандиального дистресс-синдрома: чувства распирания, переполнения в животе после приема пищи, а также проявлений синдрома избыточного бактериального роста в виде метеоризма, диареи. У пациентов с АИГ+ H. рylori дополнительно было выявлено увеличение выраженности боли в верхних отделах живота. АИГ характеризуется неоднородностью клинических проявлений – от бессимптомного течения до выраженных гастроинтестинальных симптомов [7, 8]. В литературе выделяется ассоциация АИГ с такими клиническими симптомами, как боль, дискомфорт, вздутие в верхней части живота, тошнота, ощущение раннего насыщения и переполнения [9, 10].
В нашем исследовании у 33 (45,2%) пациентов с АИГ наряду с симптомами диспепсии дополнительно встречались жалобы на наличие изжоги, а у 44 (60,2%) – на отрыжку кислым и горьким. На фоне развития гипохлоргидрии, а следовательно, и гипергастринемии в результате потери части париетальных клеток на фоне иммуноопосредованного воспаления отмечается замедление поступательных движений желудка, вследствие чего увеличивается вероятность дуоденогастрального рефлюкса (ДГР). У пациентов с АИГ симптомы гастроэзофагеальной рефлюксной болезни чаще связаны со слабокислыми и щелочными рефлюксами [11].
В дебюте заболевания у большинства больных АИГ определялись признаки дефицита железа, а также витамина В12 со встречаемостью анемического синдрома в 88,6% случаев и сидеропенического синдрома в 77,1% случаев. Зачастую симптомы дефицита железа и витамина В12 могут быть единственными проявлениями данного заболевания, что способствует задержке постановки диагноза, уводя диагностический поиск в неверном направлении. В действующих клинических рекомендациях по железодефицитной анемии отсутствуют указания о необходимости диагностики атрофических изменений, в том числе и аутоиммунного характера, во время проведения ЭГДС у молодых менструирующих женщин и в постменопаузе, а также у мужчин [12].
Значимым для ранней диагностики АИГ является выявление сопутствующих аутоиммунных заболеваний. В нашем исследовании у 45,7–55,3% пациентов с АИГ встречался АИТ. Среди пациентов с АИТ риск развития у них иммуноопосредованного воспаления в теле желудка повышен в 3–5 раз по сравнению с общей популяцией [13]. По данным литературы, также часто отмечается сочетание данного заболевания с сахарным диабетом 1-го типа, витилиго, аутоиммунным гепатитом, целиакией, ревматоидным артритом [14, 15]. У пациентов, включенных в исследование, не отмечено статистически значимой ассоциации с данными нозологиями.
Среди лабораторных показателей диагностической ценностью в отношении АИГ обладают выявление микроцитарной, гипохромной анемии, сниженные показатели сывороточного железа, ферритина, повышенные показатели трансферрина и ОЖСС, а также сниженный уровень витамина В12.
В комплексном подходе при подозрении на АИГ важное значение имеет проведение ЭГДС аппаратом экспертного класса с функцией близкого фокуса с забором гастробиоптатов по системе OLGA. При помощи эндоскопии высокого разрешения возможно визуализировать патогномоничные признаки АИГ: прогрессирующую атрофию тела и свода желудка с определением кровеносных сосудов подслизистого слоя, при этом складки чаще сглажены или вовсе не определяются [16], признаки кишечной метаплазии в виде светло-голубых гребней и белых непрозрачных полей [17]. У пациентов с АИГ без анамнеза по инфицированию бактерией H. pylori эндоскопические изменения в большинстве случаев ограничиваются телом желудка. В нашем исследовании у 4 (11,4%) пациентов с АИГ с отрицательным анамнезом инфицирования H. pylori в антральном отделе были выявлены слабая атрофия и признаки очаговой полной кишечной метаплазии. Одной из возможных причин вовлечения антрального отдела желудка у пациентов данной группы может быть наличие ДГР с последующим повреждением СОЖ на фоне желчного рефлюкса. К патогномоничным морфологическим признакам билиарного гастрита относят выраженные регенераторные изменения эпителия (фовеолярная гиперплазия с гиперхромными ядрами клеток), наличие в собственной пластинке СОЖ отека с полнокровием сосудов, увеличение числа митозов, уменьшение продукции муцина [18, 19]. У 11,4% обследованных нами пациентов с изменениями в антральном отделе достоверных данных о наличии билиарного гастрита не было получено.
Возможной причиной, объясняющей наличие атрофических изменений в СОЖ антрума у пациентов с негативным статусом инфицирования бактерией H. рylori, может быть изменение микробиоты желудка на фоне развившейся гипохлоргидрии. В исследовании B. Parsons и соавт. [20] с использованием 16S рРНК секвенирования у больных АИГ были определены наиболее часто встречающиеся микроорганизмы: Streptococcaceae (38%), Prevotellaceae (9%), Flavobacteriaceae (7%), Campylobacteraceae (7%), Enterobacteriaceae (5%) и Pasteurellaceae (5%). По данным нескольких исследований, было выявлено, что Streptococcaceae, а точнее Streptococcus anginosus, являются наиболее доминирующей группой у пациентов с АИГ, способной привести к развитию вторичного воспаления в СОЖ [21].
У пациентов с АИГ и H. pylori встречаются изменения как в теле желудка, так и в антральном отделе [22]. По данным морфологического исследования гастробиоптатов согласно системе OLGA, у пациентов с АИГ с различным статусом инфицирования H. pylori чаще в теле желудка отмечались умеренное воспаление (II степени) и выраженная атрофия с признаками псевдопилорической и полной кишечной метаплазии, в большинстве случаев III стадии согласно Российскому пересмотру Международной классификации ХГ.
Выявление мультифокального атрофического гастрита у пациентов с текущей или предшествующей инфекцией H. pylori в большинстве случаев ограничивает специалистов только в отношении данного клинического сценария как единственной причины атрофии СОЖ, без диагностического поиска наличия возможного иммуноопосредованного воспаления в теле желудка.
Заключение
Диагностика АИГ у пациентов с различным статусом инфицирования H. pylori нуждается в комплексном подходе. Важным является оценка клинических проявлений, анамнеза коморбидности с аутоиммунной патологией, результатов лабораторных исследований с акцентом на наличие признаков дефицита железа и витамина В12, эндоскопических методов исследования, а также данных гистологии гастробиоптатов из тела и антрального отдела желудка с оценкой наличия и выраженности воспаления и атрофии СОЖ, преимущественно в теле. ![]()
Авторы заявляют об отсутствии возможных конфликтов интересов.
A.V. Gubanova, M.A. Livzan, PhD, Prof., S.I. Mozgovoi, PhD
Omsk State Medical University
Contact person: Gubanova Anastasia Viktorovna, anasta589@rambler.ru
Aim – to study was to identify the most informative diagnostic signs of autoimmune inflammation depending on the status of H. pylori infection.
Material and methods. An open cross-sectional cohort study was conducted with the 124 subjects with chronic gastritis (CG) aged 18 to 75 years (median age 56 y.o. [47.5; 65]). The study group included 35 patients with autoimmune gastritis (AIG), median age 54 [43; 61] years. Comparison group 1 included 38 patients with H. pylori-associated and autoimmune gastritis, median age 56 [49; 63] years. Comparison group 2 consisted of 51 patients with H. pylori-associated gastritis, median age 58 [48; 64] years. Analysis of the severity and incidence of gastrointestinal symptoms in patients was performed using the GSRS questionnaire at the onset of the disease and at the time of inclusion in the study. The prevalence and intensity of manifestations of anemic, sideropenic syndromes, vitamin B12 deficiency were assessed. Information on the presence of concomitant autoimmune diseases, iron deficiency and B12 deficiency anemia was necessarily clarified. The results of laboratory studies, endoscopic and morphological examination of gastrobiopsies of the gastric mucosa (GM) with sampling according to the OLGA system were analyzed.
Results. The most informative diagnostic signs of AIG in patients with different status of H. pylori infection were identified: the presence of dyspepsia symptoms such as postprandial distress syndrome, as well as manifestations of vitamin B12 deficiency, anemic and sideropenic syndromes, comorbidity with autoimmune thyroiditis, the presence of endoscopic and morphological signs of atrophy and intestinal metaplasia of the GM with mandatory involvement of the body of the stomach. In patients with AIG and the absence of H. pylori infection in the anamnesis, it is possible to identify signs of inflammation and atrophy of the antral GM due to modulation of the gastric microbiota against the background of hypochlorhydria.
Conclusion. The results of the study identified the most significant diagnostic signs of AIG in individuals with different H. pylori infection status, which can help the clinician to promptly recognize autoimmune inflammation in the GM. The presence of signs of atrophic changes in the antrum of the stomach in patients with AIG and a negative H. pylori status requires further study.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


