Безопасность использования мелоксикама (Мовалиса) в сравнении с некоторыми противовоспалительными препаратами в лечении ювенильных артритов
- Аннотация
- Статья
- Ссылки
Проанализирована в динамике частота поражения верхних отделов желудочно-кишечного тракта по клинико-эндоскопическим данным у 50 больных с ювенильным артритом (ЮА), по разным причинам переведенных с терапии диклофенаком на мелоксикам. Проведена оценка гепатотоксичности мелоксикама в сравнении с другими НПВП.
Показано, что применение мелоксикама в качестве противовоспалительной терапии ЮА снижает риск развития эрозивно-язвенных поражений слизистой оболочки верхних отделов желудочно-кишечного тракта.
Уровень гепатотоксичности на фоне приема НПВП составил 7,2%. В группе пациентов, получавших мелоксикам, частота повышения уровня трансаминаз была наименьшей.
Проанализирована в динамике частота поражения верхних отделов желудочно-кишечного тракта по клинико-эндоскопическим данным у 50 больных с ювенильным артритом (ЮА), по разным причинам переведенных с терапии диклофенаком на мелоксикам. Проведена оценка гепатотоксичности мелоксикама в сравнении с другими НПВП.
Показано, что применение мелоксикама в качестве противовоспалительной терапии ЮА снижает риск развития эрозивно-язвенных поражений слизистой оболочки верхних отделов желудочно-кишечного тракта.
Уровень гепатотоксичности на фоне приема НПВП составил 7,2%. В группе пациентов, получавших мелоксикам, частота повышения уровня трансаминаз была наименьшей.


Ювенильный артрит может дебютировать в любом возрасте, в том числе и на первом году жизни. В то же время перечень НПВП, разрешенных в детской практике, очень ограничен. Только два препарата – ибупрофен и нимесулид – разрешены и широко используются в России у детей с 12 лет. В педиатрии практически нет исследований сравнительной эффективности и побочных эффектов НПВП, что позволило бы официально разрешить применение препаратов данной группы в более ранних возрастных категориях. Одним из редких исследований в детской ревматологии было изучение сравнительной эффективности и побочных явлений мелоксикама в сравнении с напроксеном в многоцентровом двойном слепом, двойном маскировочном, рандомизированном исследовании, которое проводилось у пациентов с ЮА от 2- до 16-летнего возраста в краткосрочном (3 месяца) и долговременном (12 месяцев) режиме. Исследование показало сопоставимую эффективность препаратов, а частота некоторых неблагоприятных побочных явлений оказалась ниже при использовании мелоксикама по сравнению с напроксеном [4].
К наиболее частым побочным эффектам НПВП-терапии у детей относят гастротоксичность, которая редко приводит к серьезным осложнениям со стороны ЖКТ, таким как перфорация, язва, кровотечение. В то же время в ряде ранее проведенных исследований было показано, что частота эрозивно-язвенных поражений слизистой оболочки верхних отделов ЖКТ на фоне применения диклофенака у детей с ЮА достигает 29%, а частота гастродуоденитов составляет 80% [5, 6, 7, 8]. Значительно реже в качестве побочного эффекта НПВП отмечается гепатотоксичность, крайне редко – такие проявления, как аллергические реакции, нефротоксичность, гематотоксичность и другие нежелательные явления [9].
Профилактика НПВП-индуцированных гастропатий является одной из наиболее актуальных проблем безопасности использования НПВП. При лечении взрослых пациентов с этой целью назначают селективные ЦОГ-2-блокаторы, а также препараты антисекреторного действия. К селективным НПВП, разрешенным в детской практике, относятся нимесулид (Найз) и мелоксикам (Мовалис). Однако безопасность применения нимесулида не только у детей, но и в целом в медицинской практике вызывает массу дискуссий.
В США, Канаде, Великобритании, Австрии препарат не допущен к регистрации по причине гепатотоксичности, в Японии, Израиле, Испании принят запрет на использование нимесулида [9, 10]. По решению Европейского медицинского агентства (EMA) от 23 июня 2011 г. нимесулид рекомендован к использованию только в качестве препарата второй линии для лечения острой боли и первичной дисменореи у взрослых пациентов.
В целом ряде исследований показана достоверная разница в частоте побочных явлений при использовании селективного ингибитора ЦОГ-2 мелоксикама (Мовалис) у ревматологических пациентов по сравнению с другими НПВП. Мовалис разрешен в России только с 12-летнего возраста, хотя существуют положительные результаты исследований применения препарата у детей раннего возраста. Учитывая особенности фармакокинетики и доказанный благоприятный профиль эффективности и безопасности препарата, в странах Северной Америки мелоксикам разрешен к применению у детей с 2-летнего возраста [4, 11, 12].
Цель исследования: оценить безопасность мелоксикама (Мовалиса)
при длительном применении у детей с ювенильными артритами.
Задачи исследования:
- оценка гастротоксичности препарата мелоксикам при переключении с терапии диклофенаком;
- оценка риска гепатотоксического действия Мовалиса в сравнении с другими НПВП (диклофенаком, нимесулидом) при длительном использовании у детей с ювенильными артритами;
- оценка эффективности Мовалиса в комплексной терапии ювенильных артритов.
Материалы и методы
Исследование выполнено на базе ревматологического отделения университетской детской клинической больницы Первого МГМУ им. И.М. Сеченова. Оценка эффективности и побочных эффектов НПВП проводилась путем сравнения в динамике клинико-эндоскопических данных у 50 больных с ювенильным артритом, по разным причинам переведенных с терапии диклофенаком на прием Мовалиса.
Была проведена оценка гепатотоксичности Мовалиса в сравнении с другими НПВП. Группа пациентов, получавших Мовалис, включала 54 ребенка, группа терапии диклофенаком – 100 больных ЮА, группа нимесулида – 27 пациентов. Гепатотоксичность определялась как повышение аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) более одного верхнего предела нормы и изменения со стороны печени, выявленные при помощи ультразвуковой диагностики.
Результаты исследования
Первоначально мелоксикам был назначен 54 больным. Четверо больных выбыли из нашего наблюдения в связи с прекращением приема Мовалиса (из-за отсутствия препарата по месту жительства). При анализе гастротоксичности Мовалиса использовались данные обследования 50 детей, получавших препарат от 6 месяцев до 1 года.
Из 50 пациентов 42% (21) составляли мальчики, 58% (29) – девочки. Средний возраст детей на момент исследования составил 13 лет.
Диагноз ювенильного ревматоидного артрита (ЮРА) верифицирован у 27 детей, что составило 54%, в том числе с системной формой – 5 детей (9%), с суставной формой – 22 (44%). Диагноз ювенильного спондилоартрита (ЮСА) был установлен у 11 детей (22%), ювенильного хронического артрита (ЮХА) – у 12 (24%).
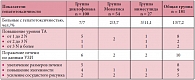
В среднем заболевание дебютировало в возрасте 5 лет (минимальный возраст – 1,5 года, максимальный – 15 лет). Средняя продолжительность заболевания составила 7 лет (минимальная – 3 месяца, максимальная – 15 лет). Возраст детей на момент назначения Мовалиса в среднем приходился на 12 лет (табл. 1).
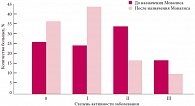
До назначения Мовалиса активность ЮА распределялась следующим образом: 1-я степень активности отмечалась у 12 детей (24%), 2-я степень – у 17 детей (34%), 3-я степень – у 8 (16%).
В 13 случаях (26%) лабораторные показатели активности ЮА (повышение СОЭ, СРБ, РФ и т.д.) отсутствовали. По данным рентгенологического обследования, поражение опорно-двигательного аппарата выявлено у 44 детей (88%), I стадия рентгенологических изменений отмечалась у 33 детей (66%), II стадия – у 9 (18%), III стадия – у 3 (6%). Серонегативность по ревматоидному фактору (РФ) выявлена у 48 детей (96%), у 2 (4%) пациентов РФ оказался положительным.
Суставной синдром был представлен моноартритом у 6 детей (12%), олигоартритом – у 24 (48%), полиартикулярным поражением – у 21 (42%).
Оценка предшествующей терапии показала, что 47 (94%) детей получали различные формы диклофенака (диклофенак натрия, вольтарен). Глюкокортикостероидные препараты (ГКС) в пероральной форме получали 5 (10%) детей, пульс-терапию метилпреднизолоном – 10 (20%) детей, внутрисуставное введение ГКС –
28 (56%). Внутривенное введение иммуноглобулина получали 6 пациентов (12%), введение инфликсимаба (Ремикейд) – 2 детей (4%). В качестве базисной терапии использовались следующие препараты: метотрексат – у 23 (46%) детей, сульфасалазин – у 15 (30%), Плаквенил – у 4 (8%), циклоспорин А – у 3 (6%), лефлуномид – у 1 ребенка (2%).
Необходимость перевода на Мовалис была продиктована следующими причинами: у 36 детей были выявлены клинико-эндоскопические признаки гастродуоденита, у 11 больных – эрозивно-язвенные поражения слизистой оболочки желудочно-кишечного тракта, у 3 – повышение трансаминаз на прием диклофенака, субъективная непереносимость диклофенака – у 3 пациентов, неэффективность предыдущей терапии другими НПВП –
у 7 детей. У одной пациентки лечение разными препаратами из группы НПВП вызывало выраженное обострение атопического дерматита. У 3 детей в связи с уже имеющимися признаками гастродуоденита Мовалис был назначен в качестве 1-го препарата (табл. 2).
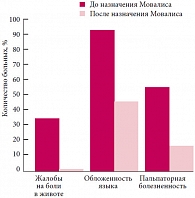
При первичном физикальном обследовании жалобы на боли в животе предъявляли 17 детей (34%), обложенность языка отмечалась у 46 (93%), пальпаторная болезненность в эпигастрии – у 27 детей (55%). Отягощенный наследственный анамнез по заболеваниям желудочно-кишечного тракта имели 9 детей (18%).
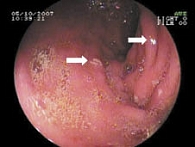
До назначения Мовалиса ЭГДС была проведена 39 детям (78%), в том числе 36 больным, получавшим в качестве противовоспалительной терапии диклофенак. Анализ данных первичной ЭГДС показал, что среди 36 пациентов, принимавших диклофенак, терминальный эзофагит обнаруживался в 25 случаях (69%), антральный гастрит – в 36 (100%), бульбодуоденит – в 31 (86%), дуодено-гастральный рефлюкс – в 17 (47%), эрозивно-язвенные повреждения желудка и двенадцатиперстной кишки обнаружены у 11 детей (30%) (рис. 1, 2). Инфицированность Helicobacter pylori выявлена в 10 случаях (28%). Таким образом, гастрит выявлялся у всех 36 детей, получавших диклофенак. Среди детей с эрозивно-язвенными повреждениями слизистой оболочки ЖКТ преобладали дети с суставной формой ЮРА (7 (64%) детей), длительно принимавшие НПВП.
После проведения антисекреторной и эрадикационной терапии (в случае Нр-ассоциированного гастрита) был назначен Мовалис в следующих дозировках: для детей с массой тела до 35–40 кг – 7,5 мг/сут, для детей с массой тела выше 40 кг – 15 мг/сут.
Эффективность и нежелательные явления терапии Мовалисом оценивались в среднем через 6 месяцев – 1 год от начала лечения.
Через 6 месяцев жалоб на боли в животе не было ни у одного пациента, при физикальном обследовании обложенность языка отмечалась только у 22 (45%), пальпаторная болезненность в эпигастрии – у 8 детей (16%) (рис. 3).
После назначения Мовалиса полное клинико-лабораторное обследование было проведено 32 пациентам. Отмечалось снижение гуморальной активности заболевания. Суставной синдром был представлен моноартритом у 3 (9%) детей, олигоартритом – у 15 (47%), полиартикулярным поражением – у 15 (44%). По данным рентгенологического обследования поражение опорно-двигательного аппарата I стадии отмечалось у 25 детей (78%), II стадии – у 4 (13%), III стадии – у 4 (13%).
Положительная динамика клинико-лабораторных показателей активности заболевания свидетельствует об эффективности Мовалиса в комплексной терапии ювенильных артритов, сопоставимой с предшествующей терапией, что подтверждается достоверным снижением количества пациентов с высокой степенью активности и увеличением числа больных с минимальной степенью активности (р < 0,05) (рис. 4).
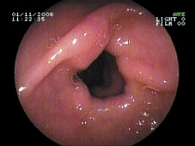
В связи с отсутствием жалоб на боли в животе и физикальных признаков поражения ЖКТ (отсутствие обложенности языка, пальпаторной болезненности) необходимость в проведении повторной ЭГДС у большинства больных отсутствовала. Повторная ЭГДС была выполнена 16 детям, в том числе 7 из 11 с эрозивно-язвенным поражением слизистой оболочки желудка и двенадцатиперстной кишки, обнаруженным при первой ЭГДС в период лечения диклофенаком. Все повторно обследованные дети продолжали получать в качестве НПВП Мовалис.
В таблице 3 представлены результаты эндоскопического обследования, проведенного до и после назначения Мовалиса у детей с ювенильными артритами и эрозивно-язвенными поражениями слизистой оболочки желудка и двенадцатиперстной кишки.
Как видно из таблицы 3, эпителизация эрозивно-язвенных повреждений наблюдалась во всех случаях повторного обследования у 7 больных. Однако частота выявления гастродуоденита, эзофагита, дуодено-гастрального рефлюкса практически не изменилась. Терминальный эзофагит обнаруживался в 7 случаях, антральный гастрит – в 6, бульбодуоденит – в 6, дуоденогастральный рефлюкс – в 3. По-видимому, выявленные изменения со стороны слизистой желудка и двенадцатиперстной кишки у пациентов, принимавших Мовалис, были обусловлены влиянием других факторов риска.
В связи с отсутствием жалоб на боли в эпигастрии, значительным уменьшением выраженности такого симптома, как обложенность языка, снижением пальпаторной болезненности в эпигастрии, а также отказом пациентов от проведения ЭГДС контрольное эндоскопическое обследование в полном объеме не проводилось. Отмечено достоверное уменьшение клинических проявлений НПВП-гастропатий, а также достоверное снижение риска развития эрозивно-язвенных поражений слизистой оболочки желудка и двенадцатиперстной кишки (р < 0,05).
С целью изучения гепатотоксичности Мовалиса был обследован 181 ребенок, из них 115 (64%) девочек и 66 (36%) мальчиков. Возраст детей на момент исследования составлял от 3 до 16 лет, средний возраст – 11,2 лет. Длительность заболевания в среднем составляла 4,4 года. Все дети получали НПВП, из них 100 детей получали диклофенак, 27 – нимесулид (Найз, Месулид), 54 – мелоксикам (Мовалис). Продолжительность непрерывного приема НПВП варьировала в диапазоне от 2 недель до 3 лет.
Обследовано 107 (59%) детей с ювенильным ревматоидным артритом (ЮРА), 49 (27%) – с ювенильным хроническим артритом (ЮХА), 13 (7,3%) – с ювенильным спондилоартритом (ЮСА), 9 (5,0%) – с реактивным артритом (РеА), 2 (1,1%) пациентов – с псориатической артропатией (ПсА).
Особенность фармакологического анамнеза заключалась в том, что из 181 ребенка 105 (58,2%) помимо НПВП получали базисную терапию, в том числе такой гепатотоксичный препарат, как метотрексат, – 71 (39,2%) пациент.
Из 181 ребенка повышение уровня трансаминаз, превышающее верхний предел нормы, на фоне приема НПВП отмечалось у 13 (7,2%) больных. Из них 7 больных принимали диклофенак, 3 – нимесулид, 2 – Мовалис и у одной девочки (по данным анамнеза) при приеме целого ряда НПВП (напроксен, диклофенак, нимесулид, мелоксикам) наблюдалось развитие гепатотоксичности.
Повышение уровня трансаминаз не более двух верхних пределов нормы регистрировалось у 8 детей, от двух до трех норм – у 2, более трех норм – в двух случаях. По данным ультразвуковой диагностики, у 8 из 13 детей наблюдалось увеличение размеров печени (на 1–1,5 см), у 9 – небольшое повышение эхогенности паренхимы печени и у 5 – усиление сосудистого рисунка.
Для проведения дальнейшего анализа все больные были разделены на три группы в зависимости от применяемого НПВП.
В группу больных, использовавших диклофенак, вошли 100 детей – 41 (41%) мальчик и 59 (59%) девочек. Средняя длительность заболевания составила 4 года; средний возраст детей – 10,6 лет. С диагнозом ЮРА в группу вошли 62 (62%) ребенка, с ЮХА – 25 (25%), с ЮСА – 6 (6%), с РеА – 5 (5%), с ПсА – 2 (2%). Препарат применялся в стандартной дозировке (2–3 мг/кг/сут). В данной группе развитие гепатотоксичности отмечалось у 7 детей (7%), из них 4 ребенка с ЮРА, 2 – с ЮХА и 1 – с ЮСА. Преобладали дети с 1–2-й степенью активности заболевания. Особое внимание следует обратить на то, что все дети с гепатотоксичностью параллельно с диклофенаком принимали и другие лекарственные препараты, которые могли вызвать развитие патологического процесса со стороны печени. Так, двоим из 7 больных одновременно с НПВП был назначен курс антибактериальной терапии. Четверо детей получали метотрексат, один из них – в сочетании с сульфасалазином, еще один – в сочетании с преднизолоном и Плаквенилом. У одного пациента в качестве базисного препарата использовался сульфасалазин.
По данным ультразвуковой диагностики, увеличение размеров печени (на 1–1,5 см) в группе диклофенака отмечалось у 5 детей, повышение эхогенности паренхимы – у 4, усиление сосудистого рисунка – у 2 больных. Повышение уровня трансаминаз от одного до двух верхних пределов нормы регистрировалось у 5 детей, от двух до трех – у 1, три и более верхних предела нормы отмечались в одном случае.
В группу больных, принимавших Мовалис, вошли 54 ребенка – 35 (65%) девочек и 19 (35%) мальчиков. Средняя длительность заболевания выше, чем в других группах, и составила 6 лет, средний возраст – 13,2 лет. С диагнозом ЮРА было 33 (61%) ребенка, с ЮХА – 12 (22%), с ЮСА – 8 (14,8%), с РеА – 1 (0,2%). Средняя доза Мовалиса составляла 10,6 мг/сут.
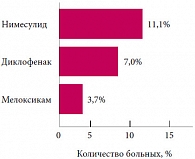
Развитие гепатотоксичности отмечалось у двоих детей (3,7%), из них одна девочка – с суставной формой ЮРА, с 3-й степенью активности заболевания, и мальчик – с системной формой ЮРА, с 1-й степенью активности.
По данным анамнеза, девочка в связи с тяжестью состояния одновременно с Мовалисом принимала метотрексат и сульфасалазин. Мальчик параллельно с Мовалисом принимал метотрексат. В данных случаях невозможно однозначно утверждать, что гепатотоксичность развилась в связи с приемом Мовалиса, так как одновременно с НПВП детям была назначена массивная базисная терапия, включающая в себя метотрексат.
По данным ультразвуковой диагностики, увеличение размеров печени (правая доля +1,5 см, левая +1 см) отмечалось у одного ребенка, повышение эхогенности паренхимы и усиление сосудистого рисунка – у двоих. В изучаемой группе повышение уровня трансаминаз в обоих случаях гепатотоксичности не превышало двух верхних пределов нормы.
В группу больных, принимавших нимесулид, вошли 27 детей – 21 (78%) девочка и 6 (22%) мальчиков. Средняя длительность заболевания составила 4,3 года, средний возраст детей – 10,8 лет. С диагнозом ЮРА было обследовано 12 (44,5%) детей, с ЮХА – 12 (44,5%), с РеА – 3 (11%). Препарат использовался в стандартной дозировке (5 мг/кг/сут).
В изучаемой группе гепатотоксичность развилась у трех детей (11,1%), из них у 2 детей с ЮРА и у одного – с ЮХА. Преобладали дети с 1–2-й степенью активности заболевания. Следует отметить, что лишь один ребенок из троих помимо нимесулида принимал базисный препарат – метотрексат. У двух других детей гепатотоксичность развилась на фоне монотерапии нимесулидом по 100 мг/сут.
По данным ультразвуковой диагностики, увеличение размеров печени (1–1,5 см) в изучаемой группе отмечалось у одной девочки, повышение эхогенности паренхимы – у двух детей. У одного ребенка регистрировалось повышение уровня трансаминаз от одного до двух верхних пределов нормы, у другого – от двух до трех и у третьего уровень трансаминаз превышал три верхних предела нормы (табл. 4).
Статистической разницы показателей гепатотоксичности в изучаемых группах не выявлено (р > 0,05) (рис. 5). Однако наблюдалась тенденция к повышению уровня трансаминаз в группе больных, получавших в качестве НПВП нимесулид, в то время как в группе пациентов, получавших Мовалис, частота увеличения уровня трансаминаз была самой низкой.
Выводы
Противовоспалительная терапия ювенильных артритов препаратом мелоксикам (Мовалис) достоверно снижает риск развития клинических проявлений НПВП-гастропатий (болевой синдром, обложенность языка, пальпаторная болезненность в области эпигастрия) по сравнению с диклофенаком (р < 0,05).
Применение Мовалиса в качестве противовоспалительной терапии ЮА достоверно снижает риск развития эрозивно-язвенных поражений ЖКТ.
Мовалис в комплексной терапии ЮА является эффективным препаратом, о чем свидетельствует снижение клинико-лабораторных показателей активности заболевания.
Повышение уровня трансаминаз выявлено у 13 детей из 181, получавших терапию НПВП (7,2%), только у двух пациентов уровень трансаминаз превышал норму в 3 и более раз, что свидетельствует о низкой гепатотоксичности на фоне применения НПВП.
Серьезных клинических проявлений поражения печени не было отмечено ни в одном из случаев применения НПВП. Статистической разницы показателей гепатотоксичности в изучаемых группах не выявлено (р > 0,05), однако в группе пациентов, получавших Мовалис, частота повышения уровня трансаминаз была наиболее низкой.
Показано, что применение мелоксикама в качестве противовоспалительной терапии ЮА снижает риск развития эрозивно-язвенных поражений слизистой оболочки верхних отделов желудочно-кишечного тракта.
Уровень гепатотоксичности на фоне приема НПВП составил 7,2%. В группе пациентов, получавших мелоксикам, частота повышения уровня трансаминаз была наименьшей.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.