Биовейвер: рабепразол и его воспроизведенные аналоги
- Аннотация
- Статья
- Ссылки
- English
Введение
Важной тенденцией развития современного фармацевтического рынка является высокая степень насыщения его базовых сегментов за счет внедрения воспроизведенных лекарственных препаратов (ЛП) [1]. Такое направление развития в основном связано с увеличением спроса на неоригинальные препараты, что объясняется прежде всего экономической составляющей. Упрощенная процедура государственной регистрации генерических ЛП и их более низкая стоимость позволяют сократить издержки производителей и потребителей [2].
В настоящее время общепринятого определения, трактующего термин «дженерик», не существует. Согласно определению Всемирной организации здравоохранения (ВОЗ), это лекарственный продукт, обладающий доказанной терапевтической взаимозаменяемостью с оригинальным ЛП аналогичного состава, выпускаемый иным, чем разработчик оригинального, производителем без лицензии разработчика. Эксперты Европейского медицинского агентства (European Medicines Agency – EMA) под дженериком понимают препарат с тем же качественным и количественным составом действующего вещества и в той же фармацевтической форме, что и оригинальный препарат, демонстрирующий биоэквивалентность референтному (эталонному) лекарственному средству при проведении тестов на биодоступность [3].
В Российской Федерации, в соответствии с Федеральным законом от 12 апреля 2010 г. № 61-ФЗ (ред. от 27 декабря 2018 г.) «Об обращении лекарственных средств», закреплены понятия воспроизведенного и референтного ЛП.
Референтный ЛП – препарат, который впервые зарегистрирован в России, качество, эффективность и безопасность которого доказаны на основании результатов доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов, проведенных в соответствии с требованиями частей 6 и 7 статьи 18 указанного выше закона в отношении лекарственных средств для медицинского применения.
Воспроизведенный ЛП – препарат, который имеет такой же качественный и количественный состав действующих веществ в такой же лекарственной форме, что и референтный, и биоэквивалентность или терапевтическая эквивалентность которого референтному препарату подтверждена в соответствующих исследованиях [4].
Одной из основных целей федеральной целевой программы «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу» (постановление Правительства РФ от 17 февраля 2011 г. № 91) является разработка и внедрение в производство конкурентоспособных воспроизведенных ЛП [5].
На данный момент прошел обсуждение проект распоряжения Правительства РФ «Стратегия развития фармацевтической промышленности Российской Федерации на период до 2030 года», предусматривающий увеличение объемов экспорта фармацевтической продукции на внешние рынки, что предполагает соответствие инновационных и воспроизведенных ЛП международным стандартам качества.
Использование воспроизведенных ЛП целесообразно с терапевтической и экономической точки зрения в том случае, если они обладают доказанной терапевтической эквивалентностью или биоэквивалентностью в отношении референтного ЛП и имеют эквивалентные ему качественный и количественный состав действующих веществ, состав вспомогательных веществ, лекарственную форму и способ введения, то есть являются взаимозаменяемыми [6].
По данным Росстата, болезни органов пищеварения занимают третье место среди причин смерти населения России, уступая болезням системы кровообращения и злокачественным новообразованиям. Значительную долю среди заболеваний органов желудочно-кишечного тракта (ЖКТ) составляют кислотозависимые заболевания (КЗЗ). Актуальность данной проблемы обусловлена широкой распространенностью КЗЗ среди населения всех стран (40–50%) и развитием серьезных осложнений. Ингибиторы протонной помпы (ИПП), к которым относится рабепразол, считаются терапевтическими лидерами при КЗЗ ЖКТ и обязательными для назначения в соответствии с ведущими клиническими рекомендациями [7–13].
ИПП относятся к пролекарствам, модификация которых в лекарственное средство происходит в кислой среде желудка [14, 15]. Наибольшая скорость наступления антисекреторного эффекта характерна для рабепразола, что доказано в многочисленных исследованиях [16–22] и объясняется рядом свойств препарата. Наибольшее значение константы ионизации (рКа) рабепразола по сравнению с другими веществами обусловливает более быструю трансформацию и высокую скорость его накопления в канальцах париетальных клеток. Значение рКа влияет также на стабильность молекулы в кислой среде. Рабепразол наименее стабилен в данных условиях, вследствие чего легко активируется как при низком, так и при достаточно высоком уровне pH. Уникальная особенность препарата заключается в его метаболизме, который минимально связан с системой цитохромов CYP2C19 и CYP3A4. Основным путем метаболизма является неэнзиматическое восстановление в тиоэфир, что обеспечивает стабильный антисекреторный эффект независимо от того, к какому типу метаболизаторов относятся пациенты [23, 24], а также минимизирует риск фармакокинетического взаимодействия с другими препаратами [25].
Препараты рабепразола широко представлены на российском фармацевтическом рынке. Так, в настоящее время зарегистрировано 13 воспроизведенных ЛП в виде твердых дозированных лекарственных форм, содержащих в качестве действующего вещества рабепразол натрия [26]. Изучение взаимозаменяемости данных генерических препаратов относительно референтного представляет особый интерес, обусловленный значительной эффективностью и безопасностью рабепразола, доказанной в многочисленных исследованиях [27–30].
По данным ВОЗ, от 10 до 20% воспроизведенных ЛП не проходят проверку по показателям контроля качества, что может быть связано с недоброкачественностью исходных субстанций, модификациями технологического процесса и другими фармацевтическими факторами, определяющими свойства готового препарата [31]. Таким образом, исследование взаимозаменяемости ЛП актуально и во многом способно повлиять на повышение эффективности и безопасности фармакотерапии.
Альтернативой длительным по времени и затратным по стоимости испытаниям in vivo для определения биоэквивалентности воспроизведенных ЛП может стать внедрение сравнительных испытаний in vitro по процедуре «биовейвер».
Биовейвер (biowaiver) – процедура, в соответствии с которой определение взаимозаменяемости и регистрация воспроизведенных лекарственных средств проводятся на основании их биофармацевтических свойств (по биофармацевтической классификационной системе (БКС)) и эквивалентности in vitro (изучение сравнительной кинетики растворения) либо другими методами in vitro как альтернатива исследованиям биоэквивалентности in vivo. Согласно позиции EMA [12, 32], ВОЗ [20] и Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration – FDA) [11], подтверждение биоэквивалентности фармацевтически эквивалентных или альтернативных ЛП в одном из вариантов может быть получено в результате проведения сравнительных исследований in vitro. Понятие «биовейвер» используется в российских нормативных документах как замена исследования биоэквивалентности на тест сравнительной кинетики растворения (ТСКР) [3]. Согласно данным литературы [33–36], в сравнительных исследованиях кинетики растворения in vitro авторами была установлена эквивалентность ряда воспроизведенных ЛП различных фармакологических групп референтному препарату, что может служить основанием для признания данных ЛП взаимозаменяемыми в соответствии с зарубежным законодательством.
Целью настоящего исследования является оценка эквивалентности in vitro по ТСКР препаратов рабепразола, представленных на российском фармацевтическом рынке.
Материал и методы
Объектом исследования явились представленные на фармацевтическом рынке Санкт-Петербурга ЛП рабепразола – таблетки, покрытые кишечнорастворимой оболочкой, и капсулы с содержанием активной фармацевтической субстанции (АФС) 20 мг. С помощью ТСКР сравнивали шесть различных воспроизведенных лекарственных средств, которым были присвоены названия R1, R2, R3, R4, R5, R6, с оригинальным препаратом рабепразола (R).
Эквивалентность in vitro оценивали на основании Руководства по экспертизе лекарственных средств [32] в средах объемом 900 мл с различным значением рН: НСl 0,1 М (рН 1,2) и фосфатных буферных растворах (ФБР) (рН 6,8 и 4,5). Испытание проводили на 12 единицах каждого ЛП на приборе «RC-6 Dissolution Tester» (Китай), аппарат «Лопастная мешалка».
Статистическая обработка данных проводилась с использованием программы Microsoft Office Excel при доверительном уровне Р = 95% и соответствующих коэффициентах Стьюдента (tp) согласно Государственной фармакопее РФ, XIV издание (ГФ XIV), том 1.
Результаты исследования
Рабепразол натрия – соль замещенного бензимидазола представляет собой белое или слегка желтовато-белое вещество, очень легко растворимое в воде и метаноле, растворимое в этаноле, хлороформе и этилацетате, нерастворимое в эфире и н-гексане. Согласно БКС, рабепразол относится к I или III классу вследствие высокой растворимости, что делает возможным проведение ТСКР для данной АФС.
В соответствии с требованиями ГФ XIV, кишечнорастворимые лекарственные формы должны быть устойчивы к воздействию желудочного сока и высвобождать действующее вещество в кишечном соке [37].
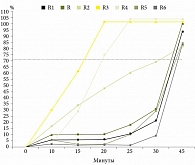
Все исследуемые ЛП соответствовали требованиям качества по показателю «растворение» согласно «ОФС.1.4.1.0015.18 Таблетки», «ОФС.1.4.1.0005.18 Капсулы» и «ОФС.1.4.2.0014.15 Растворение для твердых дозированных лекарственных форм» (ГФ XIV, том 2). В то же время было установлено, что высвобождение рабепразола из исследуемых ЛП в среде с pH 6,8 проходило c разной скоростью (рис. 1). Так, субстанция из капсул (R3 и R4) переходила в среду растворения быстрее по сравнению с таблетками, что связано с более высокой скоростью растворения твердой желатиновой оболочки капсул. Отличие в скорости высвобождения рабепразола из препарата R2 обусловлено, по-видимому, наличием в составе двух разрыхляющих веществ (метилцеллюлозы и карбоксиметилцеллюлозы) в сочетании с крахмалом.
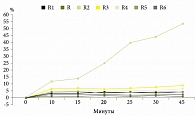
В среде с pH 4,5 высвобождение действующего вещества наблюдалось только из ЛП R2 (рис. 2), что может объясняться наличием в составе кишечнорастворимой оболочки данного препарата полисорбата-80, улучшающего смачиваемость и водопроницаемость лекарственной формы [38].
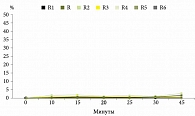
В среде растворения с pH 1,2, имитирующей желудочный сок, количество высвободившейся из всех исследуемых ЛП АФС не превысило 3% (рис. 3).
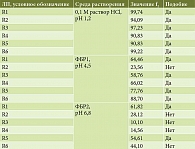
Подобие профилей растворения рабепразола из таблеток и капсул 20 мг в разных средах подтверждали расчетом коэффициентов подобия f2, значения которых должны находиться в пределах 50–100 (таблица). Так, в среде 0,1 М HCl pH 1,2 подобными референтному препарату оказались все исследуемые ЛП рабепразола. Значения коэффициентов подобия в среде с pH 4,5 свидетельствуют об эквивалентности пяти препаратов (R1, R3, R4, R5 и R6) референтному ЛП, тогда как в среде с pH 6,8 подобие было установлено только для двух препаратов (R1 и R5).
При оценке биологической эквивалентности препаратов рабепразола по ТСКР in vitro установлено подобие профилей растворения рабепразола натрия из препаратов R1 и R5, что позволяет предположить их биоэквивалентность референтному препарату Париет. Другие исследованные ЛП эквивалентны оригинальному препарату не во всех средах, поэтому нельзя с уверенностью говорить об их биоэквивалентности.
Обсуждение
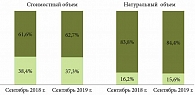
Основной тенденцией российского фармацевтического рынка на протяжении последних лет является переключение потребителя на воспроизведенные ЛП. В соответствии с данными аналитического отчета DSM Group, по итогам первых девяти месяцев 2019 г. доля оригинальных препаратов снизилась на 1,1% в рублях и на 0,6% в упаковках по сравнению с аналогичным периодом прошлого года. При этом отмечается значительное преобладание группы генерических ЛП – 62,7% в стоимостном и 84,4% в натуральном выражении. Согласно прогнозам, цифры будут увеличиваться (рис. 4) [2].
Как уже отмечалось, стоимость воспроизведенных ЛП обычно ниже, чем оригинальных ЛП, что объясняется отсутствием затрат производителя на поиск и разработку АФС, лекарственных форм, проведение полномасштабных клинических исследований, а также на рекламу и продвижение [31].
Не все воспроизведенные лекарственные средства полностью соответствуют референтным препаратам. Исследование препаратов in vitro по ТСКР может в сравнительно короткие сроки разрешить вопросы биоэквивалентности, по крайней мере сразу выявить препараты, свойства которых не соответствуют таковым оригинального лекарственного средства.
В приведенном исследовании различных аналогов рабепразола на соответствие характеристикам оригинального препарата продемонстрировано, что лишь два из шести воспроизведенных средств могут в полной мере служить альтернативой референтному препарату.
Быстрая растворимость большинства тестированных лекарственных средств в щелочной среде (pH 6,8) в отличие от оригинального рабепразола безусловно будет отражаться на клинической эффективности препаратов в условиях повышенных значений рН, что наблюдается, например, при щелочных рефлюксах.
Таким образом, остается вопрос выбора адекватной замены референтных препаратов по результатам исследования биоэквивалентности, первым этапом которого может быть ТСКР.
Авторы заявляют об отсутствии кофликта интересов.
O.V. Kalinina, I.E. Smekhova, PhD, Prof., S.V. Okovitiy, PhD, Prof., N.V. Bakulina, PhD, Prof., O.I. Solovyeva, PhD, I.G. Bakulin, PhD, Prof.
St. Petersburg State Chemical and Pharmaceutical University
I.I. Mechnikov North-West State Medical University
Contact person: Natalya V. Bakulina, natalya.bakulina@szgmu.ru
The appearance on the domestic pharmacy market of a large number of reproduced drugs poses a practitioner with a difficult choice which of these drugs to give preference. The study of drug interchangeability can greatly affect the effectiveness and safety of pharmacotherapy. The article discusses the results of in vitro tests according to the ‘biowaiver’ procedure of the reference preparation rabeprazole and its reproduced analogues. According to the results of the study, it turned out that only two of the six studied drugs correspond to the reference rabeprazole according to the results of the comparative dissolution kinetics test.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.