Эпидемиология Helicobacter pylori: клинико-лабораторные параллели
- Аннотация
- Статья
- Ссылки
- English
Актуальность обусловлена недостатком данных о распространенности в России инфекции H. pylori, ассоциированной с риском развития язвенной болезни и рака желудка.
Материал и методы. Обследовано 286 взрослых (57 мужчин, 229 женщин), ранее не получавших эрадикационную терапию. Выполнен 13С-уреазный дыхательный тест с тест-набором «ХЕЛИКАРБ». Проведена оценка анамнеза и клинических проявлений.
Результаты. H. pylori выявлен у 53% обследованных – 52,6% мужчин, 57,6% женщин. Доля инфицированных H. pylori увеличивалась с возрастом: с 44,1% у лиц 18–24 лет до 66,6% у лиц старше 60 лет. Симптомы диспепсии не коррелировали с наличием инфекции.
Актуальность обусловлена недостатком данных о распространенности в России инфекции H. pylori, ассоциированной с риском развития язвенной болезни и рака желудка.
Материал и методы. Обследовано 286 взрослых (57 мужчин, 229 женщин), ранее не получавших эрадикационную терапию. Выполнен 13С-уреазный дыхательный тест с тест-набором «ХЕЛИКАРБ». Проведена оценка анамнеза и клинических проявлений.
Результаты. H. pylori выявлен у 53% обследованных – 52,6% мужчин, 57,6% женщин. Доля инфицированных H. pylori увеличивалась с возрастом: с 44,1% у лиц 18–24 лет до 66,6% у лиц старше 60 лет. Симптомы диспепсии не коррелировали с наличием инфекции.
Россия относится к странам с высокой распространенностью Helicobacter pylori. Согласно данным недавно опубликованного метаанализа, распространенность Н. pylori в России составляет 78,5% (67,1–89,9), а Н. pylori-позитивная популяция оценивается в 112 585 054 человека [1]. Вероятно, авторы использовали неактуальные и ограниченные источники. Результаты недавних исследований продемонстрировали более низкую распространенность Н. pylori. Так, по данным, полученным в 2016–2018 гг. во всех федеральных округах России с использованием 13С-уреазного дыхательного теста (УДТ), она составляет 42,5% [2]. Распространенность H. pylori у медицинских работников – 54,9–59% [3, 4]. Такое снижение характерно для развитых стран и обусловлено повышением уровня жизни и улучшением гигиены [1, 5].
Н. pylori передается от человека человеку и вызывает хронический активный гастрит у всех зараженных лиц. Гастрит может стать причиной развития язвенной болезни, атрофического гастрита, аденокарциномы и MALT-лимфомы желудка. Эрадикация Н. pylori позволяет излечить гастрит и предотвратить развитие долгосрочных осложнений или рецидивов болезни [6, 7].
С уменьшением распространенности Н. pylori наблюдается значимое снижение заболеваемости раком желудка и язвенной болезнью в Западной Европе, США и Японии [8]. До 90% случаев рака желудка обусловлено Н. pylori [7], он развивается у 2–3% инфицированных Н. pylori [9]. Эрадикация H. pylori рассматривается в качестве стратегии первичной профилактики рака желудка [10].
Ежегодно в мире диагностируется свыше миллиона случаев рака желудка. Это пятый наиболее часто диагностируемый тип злокачественной опухоли в мире и третья по значимости причина смерти.
Совокупный риск развития рака желудка с рождения до 74 лет составляет 1,87% у мужчин и 0,79% у женщин [11, 12]. В развитых странах рак желудка у мужчин диагностируется в 2,2 раза чаще, чем у женщин. В развивающихся странах это соотношение составляет 1,83. Самые высокие показатели заболеваемости в Восточной и Центральной Азии и Латинской Америке. Заболеваемость раком желудка в Японии, Китае и Корее почти в десять раз выше, чем в США. В Корее самый высокий уровень заболеваемости – почти 60 случаев на 100 тыс. населения в год среди мужчин и 25 на 100 тыс. среди женщин [2].
В отечественной структуре заболеваемости злокачественными новообразованиями рак желудка занимает четвертое место у мужчин и шестое у женщин. Ежегодно в России регистрируется около 36 тыс. новых случаев рака желудка и свыше 34 тыс. летальных исходов от этого заболевания. Удельный вес новообразований желудка в возрастной группе 30–59 лет у мужчин составляет 7,4%, в возрастной группе 60 лет и старше – 7,8% у мужчин и 5,8% у женщин [13].
Доказательная база свидетельствует, что H. pylori является наиболее значимым и устранимым фактором риска развития рака желудка. Эрадикация H. pylori позволяет снизить этот риск, а также риск повторного развития рака желудка после эндоскопической резекции. Наиболее эффективна первичная профилактика рака желудка при эрадикации H. pylori до развития атрофического гастрита. После подтвержденной эрадикации H. pylori у больных с тяжелым атрофическим гастритом (стадии III–IV по OLGA/OLGIM) должна проводиться вторичная профилактика рака с помощью динамического эндоскопического наблюдения [14–17].
Сказанное определяет высокую значимость эпидемиологических исследований распространенности H. pylori в России.
Материал и методы исследования
В исследовании участвовали 286 пациентов (57 (19,9%) мужчин, 229 (80,1%) женщин) – взрослое трудоспособное население Москвы и Казани. Основным критерием отбора стало отсутствие эрадикационной терапии в анамнезе. Все участники исследования дали добровольное информированное согласие на проведение первичной диагностики H. pylori. Возрастные группы, согласно классификации Всемирной организации здравоохранения (2008 г.), составили: от 18 до 24 лет – 59 (20,6%) пациентов, от 25 до 44 лет – 135 (47,2%), от 45 до 59 лет – 77 (26,9%) и 60 лет и старше – 15 (5,3%) пациентов. Критериями включения стали отсутствие эрадикационной терапии в анамнезе, период после окончания приема любых антибиотиков по любому поводу и/или препаратов висмута – не менее четырех недель, период после окончания/прерывания приема ингибиторов протонной помпы – не менее двух недель. Каждый испытуемый заполнил анкету, включавшую следующие данные:
1) анамнестические:
- наличие/отсутствие в анамнезе у близких родственников (мать, отец, бабушка, дедушка, родные тетя, дядя) язвы желудка;
- наличие/отсутствие в анамнезе у близких родственников (мать, отец, бабушка, дедушка, родные тетя, дядя) рака желудка;
2) клинические:
- наличие/отсутствие у испытуемого диспепсических явлений (дискомфорт в эпигастрии, повышенное газообразование, быстрое насыщение);
- наличие/отсутствие у испытуемого эпигастральной боли.
Для систематизации обработки результатов рекомендовалось на каждый вопрос отвечать только «да» или «нет».
Всем обследованным выполнен 13С-уреазный дыхательный тест. Использовали тест-набор «ХЕЛИКАРБ» [18] с 13С-карбамидом 99% обогащения производства российской компании ООО «ИЗОКАРБ» (регистрационное удостоверение Росздравнадзора от 29.02.2016 № РЗН 2016/3773). 13С-УДТ проводили по следующей методике. Утром натощак испытуемые выпивали адъювант – 200 мл апельсинового сока. Спустя 5–10 минут осуществлялся выдох «базовой» пробы воздуха в одноразовый герметичный пакет емкостью 150–170 мл из тест-набора «ХЕЛИКАРБ». Сразу после выдоха «базовой» пробы пациенты выпивали 50 мг 13С-мочевины, разведенной в 50 мл питьевой воды непосредственно перед применением. После приема 13С-мочевины участники исследования 30 минут находились в статичном спокойном состоянии. Через 10, 20 и 30 минут после приема препарата осуществлялся выдох «диагностических» проб воздуха в одноразовые пакеты аналогично «базовой» пробе. Взятие проб через 10 и 20 минут (стандартная методика предусматривает взятие проб через 30 минут) связано с необходимостью исключить вероятность потери «положительных» результатов у быстрых «метаболизаторов». Все пробы выдыхаемого воздуха исследовали на изотопное соотношение 13С/12С на инфракрасном спектрометре IRIS.Doc (компания Kibio, Швеция) (регистрационное удостоверение Росздравнадзора от 02.06.2016 № ФСЗ 2008/03312). Определялась DOB (δ) 13С/12С в «диагностических» пробах по отношению к «базовой». Полученные значения выражались в промилле (‰).
Результаты 13С-УДТ, полученные с применением ИК-спектрометрии, интерпретировались по количественной характеристике: отрицательный (δ < 4,0‰) или положительный (δ ≥ 4,0‰).
Анализ данных
Выполнен расчет абсолютных (количество случаев) и относительных (проценты) показателей частоты выявления H. pylori и влияния на них пола, возраста, анамнестических факторов (язва или рак желудка у ближайших родственников), а также наличия или отсутствия гастроэнтерологических симптомов (диспепсия, эпигастральная боль). Статистическая обработка результатов выполнена с применением многофакторного критерия χ2 Пирсона.
Результаты
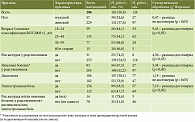
H. pylori выявлен у 53% обследованных. Гендерных различий в инфицированности не обнаружено: у мужчин она составила 52,6%, у женщин 57,6%. Отмечалось увеличение распространенности H. pylori с возрастом. Так, в возрастной группе 18–24 лет инфицированных насчитывалось 44,1%, в группе от 25 до 44 лет – 54,1% (р < 0,05). У лиц 45–59 лет распространенность H. pylori составила 68,8%, старше 60 лет – 66,6%.
Симптомы диспепсии не коррелировали с наличием инфекции. Среди 102 обследованных без жалоб инфекция выявлена в 55% случаев, а среди 184 пациентов с жалобами на диспепсию – в 58,1%. Этот показатель был несколько выше среди 156 обследованных с жалобами на боль в эпигастрии – 63,5%. При этом наличие эпигастрального болевого синдрома не являлось предиктором инфекции H. pylori: у 47,7% инфицированных его не было.
У H. pylori-инфицированных пациентов в 67,5% случаев имел место отягощенный анамнез по язвенной болезни (р < 0,05).
Следует отметить, что у инфицированных H. pylori пациентов чаще встречались родственники, больные раком желудка: 74,2 против 54,5% у H. pylori-негативных (р < 0,05) (таблица).
Обсуждение
Для исследований распространенности H. pylori рекомендованы неинвазивные тесты. Чаще применяются серологический (антитела к H. pylori класса IgG) и 13С/14С-УДТ, значительно реже – определение антигена H. pylori в кале [19]. Маастрихтский консенсус характеризует 13С/14С-УДТ как наиболее изученный и рекомендуемый неинвазивный метод диагностики в рамках стратегии «тестируй и лечи» [7]. При сопоставлении результатов пяти диагностических тестов отмечались преимущества 13С-УДТ [20]. В силу высокой чувствительности (96%) и специфичности (93%) он получил широкое распространение [21]. Не случайно в нашем исследовании был применен именно этот тест.
При обследовании 286 взрослых, ранее не получавших эрадикационной терапии, установлена высокая распространенность H. pylori (53%). В старших возрастных группах этот показатель достиг 68,8–66,6%. В ранее опубликованном исследовании распространенности H. pylori у медицинских работников также отмечалось увеличение доли инфицированных с возрастом с 41,8% у лиц в возрасте до 25 лет до 76,9% у пациентов в возрасте старше 60 лет с темпом прироста ~0,7% в год [3]. Распространенность H. pylori в Новосибирске у детей 5–14 лет составила 43%, у подростков – 55,4%, в возрастной группе 25–64 года – до 70,8% [22].
Основным путем заражения H. pylori считается внутрисемейная передача в возрасте до 12 лет [23]. Как правило, заражение происходит фекально-оральным путем и зависит от гигиенических условий. Распространенность H. pylori в популяции во многом отражает уровни урбанизации, санитарии, доступа к чистой воде и социально-экономического статуса. Так, при сопоставлении данных, полученных в 1970–1999 и 2000–2016 гг., отмечалось снижение распространенности H. pylori в Европе с 48,8 (95%-ный доверительный интервал (ДИ) 39,4–58,2) до 39,8% (95% ДИ 34,2–45,3), в Северной Америке – с 42,7 (95% ДИ 32,7–52,6) до 26,6% (95% ДИ 19,0–34,1) и Океании – с 26,6 (95% ДИ 20,4–32,8) до 18,7% (95% ДИ 11,6–25,7). Однако этот показатель не изменился в Азии (53,6 против 54,3%), Латинской Америке и Карибском бассейне (62,8 против 60,2%) [1].
Следовательно, выявленные нами отличия в распространенности H. pylori в разных возрастных группах могут быть главным образом обусловлены особенностями гигиенических условий в детском возрасте разных поколений. При этом не исключена вероятность инфицирования в более старшем возрасте.
В ходе опроса не выявлены клинические симптомы, которые свидетельствовали бы о возможном инфицировании. Более того, частота выявления симптомов диспепсии была сопоставима у H. pylori-позитивных и H. pylori-негативных пациентов. Это отражает современные представления о том, что у всех пациентов, инфицированных H. pylori, развивается хронический активный гастрит независимо от симптомов и стадии [7]. Вместе с тем у ряда больных гастрит, ассоциированный с H. pylori, может быть причиной возникновения симптомов диспепсии. Терапией первого выбора у H. pylori-позитивных пациентов с синдромом диспепсии является эрадикация H. pylori. Симптомы диспепсии могут расцениваться как обусловленные H. pylori в том случае, если эрадикация приводит к их долговременному купированию [6].
В клинической практике именно наличие симптомов диспепсии служит поводом для обращения к врачу и последующего обследования на наличие H. pylori [24]. Тем не менее высокая заболеваемость и смертность от рака желудка в России ставит задачу более активного выявления H. pylori. Последние международные и отечественные консенсусы рекомендуют проведение эрадикационной терапии у всех инфицированных в отсутствие противопоказаний [6, 7, 25].
Заключение
Результаты проведенного нами исследования продемонстрировали высокую распространенность H. pylori, увеличивающуюся с возрастом. Показано, что симптомы диспепсии не являются предиктором наличия H. pylori.
R.G. Plavnik, PhD, N.V. Bakulina, MD, PhD, Prof., D.V. Mareyeva, PhD, D.S. Bordin, MD, PhD, Prof.
People’s Friendship University of Russia
I.I. Mechnikov North-Western State Medical University
A.S. Loginov Moscow Clinical Scientific and Practical Center
Tver State Medical University
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Roman G. Plavnik, 1175459@gmail.com
The article presents the results of a study of the prevalence of Helicobacter pylori using a 13С -urease breath test.
The relevance is due to the lack of relevant data on the prevalence of H. pylori in Russia associated with the risk of developing peptic ulcer and stomach cancer.
Material and methods. The study involved 286 adults (57 men, 229 women) who had not previously received eradication therapy. A 13С -urease breath test with the HELICARB test kit was performed. The anamnesis and clinical data were evaluated.
Results. H. pylori was detected in 53% of the examined: 52.6% of men, 57.6% of women. The proportion of infected with HP increased with age: from 44.1% in people 18–24 years old to 66.6% in people over 60 years old. Symptoms of dyspepsia did not correlate with the presence of infection.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.