Что такое нормальный сон с субъективной и объективной точек зрения
- Аннотация
- Статья
- Ссылки
- English

Введение
В парадигме традиционной официальной медицины при определении нормы господствует принцип бинарности, или бинарной оппозиции (норма – патология), согласно которому факт нормальности или здоровья констатируется при отсутствии или невыявлении патологических отклонений. Однако подобный подход не всегда отвечает современным задачам, среди которых на первый план выходят ориентированность на адаптацию к вызовам и изменениям окружающей среды, выполнение функций отдельно взятого индивидуума в социуме. Это приводит к тому, что в рамках различных медицинских специальностей все больше внимания уделяется не отдельным нозологиям и патологическим состояниям, а таким понятиям, как «здоровье сердечно-сосудистой системы», «репродуктивное здоровье», «здоровье легких». В этом ряду стоит и термин «здоровье сна», который выходит за пределы общепринятого представления о «нормальном сне».
Термин предложил в 2014 г. D. Buysse [1]. Он определил «здоровье сна» (или здоровье, ассоциированное со сном) как многоуровневый паттерн сна и бодрствования, который характеризуется способностью адаптироваться к индивидуальным, социальным потребностям и потребностям окружающей среды, ведет к общему физическому и психическому благополучию. Хорошее здоровье сна отличается субъективной удовлетворенностью сном, адекватным временем и продолжительностью сна, высокой эффективностью и значительным уровнем активности в часы бодрствования.
Для балльной оценки «здоровья сна» D. Buysse предложил использовать шкалу SATED. Она включает пять основных критериев, по первым буквам которых и была названа: удовлетворенность сном/качество сна (Satisfaction), бодрствование/сонливость (Alertness), время/согласованность во времени (Timing), непрерывность и эффективность (Efficiency), продолжительность (Duration). Кроме того, есть три дополнительных критерия: глубина, регулярность/вариабельность, адаптивность/изменчивость. Для каждой из указанных характеристик получены доказательства связи с различными исходами, такими как смертность, нефатальные сердечно-сосудистые события, артериальная гипертензия, нарушения когнитивных функций, метаболические изменения и др. [1]. Однако корреляции данного показателя с объективно оцененными при полисомнографическом исследовании параметрами сна выявлено не было, что заставляет пересмотреть традиционное понимание «нормального сна» [2].
Подходы к оценке сна
Если ориентироваться на критерии, используемые в протоколах клинических исследований, то, как правило, под категорию людей с «нормальным сном» (нормально спящих) подпадают:
- лица, у которых не выявляются критерии нарушений сна;
- лица, которые субъективно определяют свой сон как «нормальный»;
- лица, которые ранее не обращались за медицинской помощью с проблемами, связанными со сном;
- лица, которые не принимают препараты для улучшения сна (по рекомендации врача или самостоятельно).
Однако все эти формулировки достаточно формальны и могут не учитывать малосимптомные варианты течения расстройств сна.
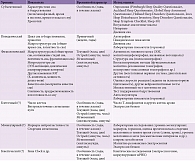
Условно оценку сна можно проводить на разных уровнях, из которых наиболее распространены и изучены субъективный, поведенческий и физиологический (табл. 1) [3]. Дальнейшего исследования требуют клеточный, молекулярный и генетический уровни, которые открывают возможности для более индивидуализированного подхода к определению нормальных показателей сна и их коррекции в случае отклонения от референтных значений.
Продолжительность сна как его базовая характеристика
Общая продолжительность сна коррелирует с субъективной оценкой его качества [4], что обусловлено возможностью произвольного контроля и регулирования данного показателя, но вместе с тем отличается высокой вариабельностью из-за влияния ряда немодифицируемых факторов (например, генетических, возрастных) [5–7]. Несмотря на возникающие сложности, в 2015 г. Национальный фонд сна США опубликовал консенсусный документ по продолжительности сна. В нем прописана рекомендованная длительность сна для разных возрастных групп от младенцев до пожилых людей: новорожденные (0–3 месяца), младенческий возраст (4–11 месяцев), преддошкольный (1–2 года), дошкольный (3–5 лет), школьный (6–13 лет), подростковый (14–17 лет), молодой (взрослый) (18–25 лет), зрелый (взрослый) (26–64 года), старший (пожилой) возраст (≥ 65 лет) [8].
Эксперты Американской ассоциации по медицине сна также выпустили согласительный документ [9, 10]. В нем на основании детального анализа имеющихся данных они определили величину оптимальной продолжительности сна взрослого человека (18–60 лет), которая должна составлять не менее семи часов в сутки для достижения «оптимального состояния здоровья». Оценка последнего базировалась на результатах анализа таких показателей, как общее состояние здоровья, состояние («здоровье») сердечно-сосудистой системы, состояние («здоровье») обмена веществ, психическое здоровье, функционирование иммунной системы, межличностное взаимодействие, рак молочной железы, боль, смертность, вероятность дорожно-транспортного происшествия, и их связь с продолжительностью сна. По мнению экспертов, при регулярной продолжительности сна менее семи часов возрастает риск неблагоприятных исходов в отношении всех перечисленных показателей, в то время как влияние длительного сна (более девяти часов) на эти параметры требует дальнейшего изучения. Не исключается приемлемость и польза длительного сна для молодых индивидуумов, лиц, перенесших депривацию сна, и больных людей [11].
Эти регламентирующие документы появились вследствие накопившихся доказательств того, что нарушения и изменение качества и продолжительности сна связаны с неблагоприятным прогнозом, а также опасений, вызванных постепенным уменьшением среднепопуляционной длительности сна и повышением встречаемости различных нарушений сна. Об этом свидетельствуют результаты субъективной оценки на основании опросов, проведенных в США и Европе [12, 13]. В то же время анализ опубликованных за последние 50 лет работ (всего 168 исследований с участием 6052 человек в возрасте 18–88 лет), в которых продолжительность сна оценивалась объективными методами (актиграфией, полисомнографией), позволили S. Youngstedt и соавт. (2016) прийти к выводу, что за это время значимых изменений в объективно оцениваемой продолжительности сна здоровых взрослых людей (во всех возрастных группах) не произошло [14].
Важно понимать и учитывать вариабельность продолжительности сна у одного и того же человека. Например, при обследовании пожилых людей (старше 65 лет) с интервалом в три года продолжительность сна существенно варьировалась. Согласно повторному опросу, только у 45,9% человек продолжительность сна не изменилась, 12,3% коротко спящих перешли в категорию длительно спящих, а 28,1% длительно спящих, напротив, стали коротко спящими, остальные обследуемые заняли промежуточные категории [5]. При этом предикторы перехода из одной категории в другую распределились следующим образом: ожирение и исходно низкое качество сна предопределяли переход в категорию длительно спящих, в то время как артериальная гипертензия и нетрудоспособность (инвалидизация) ассоциировались с сокращением продолжительности сна. Учитывая эти данные, необходимо осторожно подходить к интерпретации однократной оценки продолжительности сна и принимать к сведению все факторы, потенциально влияющие на его длительность.
О возможных неблагоприятных последствиях изменения продолжительности сна и в сторону уменьшения, и в сторону увеличения свидетельствуют результаты крупных исследований и метаанализов [15–17]. Как правило, коротким сном считается сон продолжительностью менее пяти-шести часов, но в ряде исследований используются и другие пороговые значения. Анализ данных актиграфии, выполненный D. Kripke и соавт. (2011), показал, что минимальный риск фатальных исходов отмечается при продолжительности сна 5–6,5 часа и повышается при длительности сна как менее 5 часов, так и более 6,5 часа [16].
В объединенном анализе 153 проспективных когортных исследований (n = 5 172 710) короткая продолжительность сна ассоциировалась с увеличением риска следующих состояний и заболеваний:
- сахарного диабета (относительный риск (ОР) 1,37, 95% доверительный интервал (95% ДИ) 1,22–1,53, р < 0,005) – увеличение риска на 37%;
- ожирения (ОР 1,38, 95% ДИ 1,25–1,53, p < 0,005) – увеличение риска на 38%;
- артериальной гипертензии (ОР 1,17, 95% ДИ 1,09–1,26, p < 0,005) – увеличение риска на 17%;
- сердечно-сосудистых заболеваний (ОР 1,16, 95% ДИ 1,10–1,23, p < 0,005) – увеличение риска на 16%;
- ишемической болезни сердца (ОР 1,26, 95% ДИ 1,15–1,37, p < 0,005) – увеличение риска на 26% [17].
В то же время можно говорить об U-образной кривой, отражающей зависимость между продолжительностью сна и неблагоприятными исходами. По результатам метаанализа, объединившего 95 исследований (n = 5 134 036), длинный сон (как правило, более восьми-девяти часов в сутки) ассоциировался с более высокими показателями смертности (ОР 1,39, 95% ДИ 1,31–1,47), развитием сахарного диабета (ОР 1,26, 95% ДИ 1,11–1,43), риском сердечно-сосудистых заболеваний (ОР 1,25, 95% ДИ 1,14–1,37), инсульта (ОР 1,46, 95% ДИ 1,26–1,69), ишемической болезни сердца (ОР 1,24, 95% ДИ 1,13–1,37) и ожирения (ОР 1,08, 95% ДИ 1,02–1,15) [15].
Необходимо отметить, что не всегда в исследованиях принимается во внимание дневной сон, который также нужно учитывать при оценке суточной продолжительности сна [5]. В целом мнения в отношении пользы дневного сна разнятся. Существует точка зрения, что дневной сон полезен. В частности, он способствует улучшению функционирования в дневное время (в период активной деятельности), приводя к ускорению реакции, бодрости, уменьшению количества ошибок при выполнении заданий на внимание. Дневной сон способствует снижению выраженности сонливости, усталости и позволяет адаптироваться при сменной работе [18]. Вместе с тем авторы объединенного анализа 19 исследований обращают внимание на вероятное повышение риска общей смертности, ассоциированное с дневным сном. Но данная взаимосвязь может быть обусловлена особенностями дизайна включенных работ и обследуемыми популяциями, а потому требует осторожной интерпретации [19].
Национальный фонд сна США допускает не более одного эпизода дневного сна в сутки длительностью до 100 минут (для пожилых людей до 120 минут) [20]. Однако многие вопросы остаются открытыми, в том числе определение идеального времени для дневного сна, индивидуальных факторов, влияющих на эффективность (пользу) дневного сна, механизмов, лежащих в основе эффектов дневного сна, роль различных показателей сна в реализации эффектов, область терапевтического применения и др.
Качество сна – объективная или субъективная характеристика
Такой простой, на первый взгляд, показатель, как качество сна, на самом деле складывается из множества составляющих, а его оценка зависит от подхода к «измерению». Казалось бы, каждый ответит на вопрос «как вы спали?». Однако на ответ повлияют различные субъективные качественные характеристики сна, включающие его глубину и «безмятежность», ощущение отдыха после сна, а кроме того, количественно устанавливаемые параметры, например продолжительность сна, длительность засыпания, число и продолжительность пробуждений. Именно на подобной субъективной оценке основаны диагностические критерии инсомнии [21]. Однако, несмотря на кажущуюся легкость субъективного определения качества сна, подходы к его количественной оценке вызывают много вопросов. Как было сказано ранее, существует четкая корреляция между субъективной оценкой качества сна и его продолжительностью [4, 22]. В нашем исследовании участникам предлагалось оценить качество сна во время полисомнографии. Те, кто выбрал вариант ответа «хуже, чем дома», считали, что спали мало, в отличие от тех, кто на вопрос о качестве сна ответил «как обычно» и «лучше, чем дома». При объективном измерении длительности сна, по результатам полисомнографии, различий между этими подгруппами не выявлено [22].
В 2017 г. на основании анализа большого пула данных (в финальный анализ вошли 277 статей, в которых применялся объективный метод оценки сна) Национальный фонд сна США сформулировал рекомендации по качеству сна [20]. Одной из важнейших характеристик названа непрерывность сна, которая определяется несколькими параметрами: латентностью, числом пробуждений длительностью более пяти минут, временем (продолжительностью) бодрствования после наступления сна (Wake Time After Sleep Onset – WASO), эффективностью сна (табл. 2) [19]. Еще одна значимая характеристика сна – его структура, в рамках которой оценивается продолжительность (доля от общего времени сна) фазы быстрых движений глаз (Rapid Eye Movement – REM) и медленной фазы (Non-REM), в которой выделяют стадии N1, N2 и N3. Наконец, третья группа показателей описывает дневной сон – число эпизодов в течение суток, их продолжительность, частоту (в неделю). Для каждого параметра выделены три диапазона значений: приемлемый, неприемлемый, неуточненный (требующий уточнения). Нормативы предложены в девяти возрастных группах, аналогичных представленным в рекомендациях по продолжительности сна [8].
Необходимо отметить, что в рекомендациях учтены не все объективные характеристики сна. Так, в них не включены число/индекс электроэнцефалографических (ЭЭГ) активаций, цикличность/число циклов сна (нормой считается четыре – шесть 90-минутных циклов сна при 6–8-часовом сне) и иные показатели, что заставляет искать другие подходы к оценке качества сна. В частности, F. Mendonca и соавт. (2018, 2019) выделяют не три, а шесть групп признаков (из которых не все общеприняты) [23, 24].
- Длительность. Включает латентность сна, латентность и длительность стадий N1, N2, N3, REM-фазы, длительность пребывания в постели, общую продолжительность сна, общее время бодрствования, длительность бодрствования после окончательного пробуждения и др.
- Интенсивность (или мощность) сна. Включает долю стадий N1, N2, N3, REM (%), соотношение REM/Non-REM (%), индекс смены стадий сна, соотношение стадий глубокого (N3) и поверхностного (N1, N2) сна и др.
- Непрерывность, которая характеризует степень фрагментации сна. Включает количество/индекс ЭЭГ-активаций, количество/индекс пробуждений, эффективность глубокого сна, количество/частоту смены стадий сна, частоту перехода от глубокого (N3) сна к стадиям N1, N2, эффективность сна, WASO.
- Стабильность, которая характеризует события, нарушающие сон. Включает параметры циклических альтернирующих паттернов (доли (%) и индексы трех типов этих паттернов – A1, A2, A3, их длительность, индекс, частоту, число циклов и общее время), долю ЭЭГ-активаций, спектральные характеристики ЭЭГ (альфа, бета, дельта, сигма, тета), количество и индекс периодических движений нижних конечностей.
- Частота, которая отражает циклы сна и периодичность возникновения стадий сна. Включает число периодов стадий N1, N2, N3, число циклов REM-сна.
- Эпизодичность (периодичность) сна, которая описывает моно/полифазность сна. Включает количество, длительность и частоту эпизодов дневного сна.
Однако даже эта расширенная классификация не учитывает всех возможных параметров, которые вносят вклад в общее качество сна. Так, согласно данным экспериментальных и клинических исследований, для качества сна важна не только макроструктура, но и микроструктура сна, которая включает показатели отдельных элементов, например веретен сна, К-комплексов, быстрых движений глаз (их плотность, амплитуду, интенсивность), а также спектральные характеристики сна с учетом топографии [25].
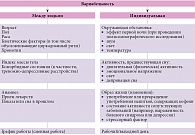
Как уже упоминалось ранее, оценка показателей сна и их нормативных величин осложняется высокой вариабельностью и между отдельными индивидуумами, и у каждого обследуемого от ночи к ночи (индивидуальная вариабельность) [7]. Один из наиболее существенных факторов, обусловливающих вариативность референтных значений параметров сна, – возраст (рисунок). В различные возрастные периоды меняется не только общая продолжительность сна (от приемлемых 11–19 часов у новорожденных до пяти – девяти часов у лиц старше 65 лет), но и характеристики макро- и микроструктуры сна. Чем старше человек, тем меньше общая продолжительность сна и длительность глубокого сна (дельта-сна) [8]. У пожилых людей снижается эффективность сна (хотя Национальный фонд сна США предложил одинаковые нормативы для всех возрастов – установленная норма ≥ 85% и допустимые значения – 75–84%), увеличиваются латентность сна (особенно у женщин), длительность поверхностного сна, число пробуждений и WASO (допустимо до 30 минут и более по сравнению с 10–20 минутами в детском и молодом возрасте) [20]. У пожилых людей преимущественно выражена фрагментация сна за счет большего числа ЭЭГ-активаций (16 ± 8,2 в час сна в возрасте 37–54 года до 21 ± 11,6 в час сна в возрасте старше 70 лет [25]), а полифазный сон рассматривается как норма. Существенно отличаются и спектральные характеристики. Так, с возрастом уменьшаются представленность, амплитуда и длительность веретен сна, представленность К-комплексов, увеличивается высокочастотная составляющая (спектр тета- и бета-активности), особенно во время REM-сна (нельзя исключить и действие лекарственных препаратов, которые чаще принимают пожилые люди), снижается дельта-активность [4, 25].
Важно отметить, что по прогностической ценности в отношении фатальных исходов у пациентов пожилого возраста на первый план выходят показатели сна, характеризующие его ритмичность и непрерывность (WASO) (исследование MrOS, n = 5994), определяемые по результатам актиграфии [26].
Гендерные различия, в отличие от возрастных, не столь значимы, а с возрастом (в особенности в постменопаузальном периоде у женщин) практически нивелируются [27].
Другие показатели сна
Говоря о нормальном здоровом сне, нельзя не упомянуть и нормативы показателей, касающиеся времени отхода ко сну и пробуждения, дыхания во время сна и двигательной активности. Традиционно в заключении полисомнографического исследования выделяются количество и индекс апноэ – гипопноэ с подтипами (обструктивное, центральное, смешанное апноэ сна), количество и индексы движений нижних конечностей и периодических движений нижних конечностей. Согласно классификации, предложенной F. Mendonca и соавт. (2018, 2019), эти параметры можно отнести в группу событий, нарушающих сон и характеризующих стабильность сна [23, 24].
Время (тайминг) сна
Несмотря на то что в настоящее время отсутствуют нормативы времени отхода ко сну и пробуждения, значительные различия по этим показателям у разных людей описываются как хронотипы. Несоответствие времени засыпания внутренним биологическим ритмам, нестабильный режим сна и бодрствования, в том числе с наверстыванием в выходные дни нарастающего в будние дни недосыпания, приводит к последствиям для здоровья в виде кардиометаболических нарушений и сонливости [28]. Согласно Международной классификации расстройств сна, основным критерием диагноза циркадианных нарушений сна в виде задержки или опережения цикла «сон – бодрствование» признано несоответствие желаемого и действительного времени засыпания. При этом легкая степень определяется как несоответствие более чем на два часа, средняя – на три часа, тяжелая – свыше четырех часов [21].
Дыхание во сне
Индекс апноэ – гипопноэ (норма для взрослых < 5 эпизодов в час сна) используется повсеместно для диагностики дыхательных расстройств и классификации их по степени тяжести. Однако в последние годы широко обсуждается вопрос о том, что применение только этого показателя для характеристики выраженности нарушений дыхания во время сна недостаточно и необходимо разработать новые параметры и установить их нормативные величины [29–33].
В настоящее время формируется концепция о комплексном подходе к оценке нарушений дыхания во время сна, выделении различных фенотипов на основании клинико-инструментальных данных, а в будущем, возможно, и использовании лабораторных показателей. В частности, группа авторов из Исландии, применив кластерный анализ с включением 23 показателей (характеристика симптомов, выраженность дневной сонливости, сопутствующие заболевания, общее состояние здоровья и др.), выделила три фенотипа. Они различаются по клиническим симптомам нарушений дыхания во время сна, приверженности к терапии и ответу на лечение неинвазивной вентиляцией легких [34, 35]. Сопоставимые результаты получены и при анализе данных большой когорты пациентов с обструктивным апноэ сна в исследовании ESADA (6555 пациентов из 17 европейских стран) [36].
Все это привело к тому, что рабочая группа по нарушениям дыхания во время сна Европейского общества по изучению сна в 2018 г. опубликовала заключение. В нем эксперты отметили, что существующие критерии диагностики обструктивного апноэ сна требуют пересмотра в отношении как используемых в настоящее время пороговых величин, так и применяемых оценочных показателей, а тактика лечения должна определяться с учетом установленного фенотипа и других показателей, помимо индекса апноэ – гипопноэ [37].
Двигательная активность
Существующие подходы к оценке двигательной активности (амплитуды, кратности, частоты) и нормативы разработаны с целью верификации или исключения периодических движений нижних конечностей. Согласно критериям диагностики, индекс периодических движений нижних конечностей признается патологическим, если превышает 15 эпизодов в час (причем в асимптомных случаях эти нарушения могут абсолютно не осознаваться пациентом). Синдром периодических движений нижних конечностей предполагает субъективную симптоматику (нарушения сна, избыточную дневную сонливость и др.) [38].
В настоящее время Международная рабочая группа по синдрому беспокойных ног проводит серьезную работу по пересмотру существующих подходов к анализу, количественному подсчету и классификации движений нижних конечностей, в том числе ассоциированных с нарушениями дыхания [39]. Вероятно, в скором будущем будет предложен иной, более комплексный подход к диагностике и дифференциации типов патологических движений нижних конечностей. Но пока при количестве периодических движений нижних конечностей ≤ 15 в час сна (по данным полисомнографического исследования) результат можно считать нормальным.
В отношении иных нарушений, связанных с двигательной активностью (например, сомнамбулизм) или изменением других физиологических параметров (например, тонус жевательной мускулатуры, бруксизм), четкие количественные критерии не разработаны. В случае бруксизма специалисты в проекте консенсусного документа обращают внимание на важность следующих моментов: опрос пациента и его родственников, определение не только числа эпизодов скрежетания зубами, но и таких характеристик, как мощность, пиковая амплитуда, длительность интервалов между эпизодами, а кроме того, общего тонуса жевательной мускулатуры (по сравнению с исходным), по данным электромиографии, и длительное/повторное мониторирование последнего [40].
Соотношение субъективного ощущения качества сна и объективных показателей
Ряд исследований свидетельствует о корреляции между субъективной и объективной оценками качества сна. Так, T. Åkerstedt и соавт. (2019), проанализировав данные субъективной оценки и полисомнографии в выборке женщин (n = 400) из исследования Sleep and Health in Women, пришли к выводу, что объективно измеренная общая продолжительность сна – сильный предиктор субъективно оцененного качества сна. Это позволило им выдвинуть постулат «короткий сон – плохой сон» [4]. Однако зачастую наблюдается несовпадение (несоответствие) субъективного восприятия и объективно измеренных показателей, что может быть обусловлено целым рядом факторов [41, 42]:
- особенностями объективных и субъективных методов исследования, условиями проведения обследования;
- неправильными расчетами (например, длительности сна при субъективной оценке);
- психологическими факторами, включая черты личности (невротический, ипохондрический тип, истероидный и др.), настроение (и его изменения);
- физиологическими особенностями (в том числе показателями макро- и микроструктуры сна, активацией центральной нервной системы, особенностями вегетативной регуляции);
- сопутствующими заболеваниями и приемом лекарственных препаратов.
С точки зрения количественной объективной оценки физиологические характеристики имеют немаловажное значение, поскольку могут влиять на субъективное восприятие начала сна (латентности сна) не только при отходе ко сну, но и после ночных пробуждений, а также на общую длительность и глубину сна.
Считается, что состояние гиперактивации (что типично для инсомнии), в том числе более выраженная реакция на стимулы при исследовании вызванных потенциалов, дисбаланс вегетативной нервной системы (гиперсимпатикотония, снижение активности парасимпатической нервной системы) приводят к более низкой субъективной оценке качества сна. Более высокий показатель WASO и большая доля N1 фазы в первый цикл сна ассоциируются с субъективным восприятием более длительной латентности сна [43, 44].
В то же время A. Saline и соавт. (2016) указывают на то, что фрагментация сна при засыпании или во время первого цикла сна не связана с изменением субъективного восприятия латентности ко сну [45]. Они также не выявили корреляции между субъективным восприятием длительности сна и представленностью различных стадий сна, его эффективностью. Отрицательный результат может объясняться ретроспективным характером исследования, особенностями обследуемой группы (преимущественно пациенты с нарушениями дыхания во время сна, в меньшей степени больные инсомнией, возможный прием психотропных препаратов в день проведения полисомнографии), подходом к анализу субъективной латентности сна и др.
Среди спектральных характеристик в качестве вероятных предикторов субъективного восприятия сна (латентности сна, общей продолжительности сна) обсуждаются бета-активность, присутствие К-комплексов в сочетании с веретенами сна в период засыпания и первые десять минут после наступления сна (чем выше бета-активность, тем дольше латентность сна) [44], соотношение дельта- и бета-активности в N2 фазу сна (во время первого цикла сна), эпизоды альфа-активности во время глубокого сна, циклических альтернирующих паттернов (особенно в N2 фазе сна). Однако в отношении этих взаимосвязей результаты исследований противоречивы и признаются не всеми авторами [43, 46].
Заключение
Многообразие показателей, характеризующих сон, подходов к их оценке, несоответствие субъективных и объективных оценок требуют разработки нового интегрального подхода, который, с одной стороны, охватывал бы все ключевые параметры, а с другой, был бы удобен для применения. Вероятно, подходы могут отличаться в зависимости от области использования (рутинная клиническая практика, клинические исследования, научные или научно-экспериментальные условия и др.).
Результаты исследования MrOS подтверждают, что одновременный анализ множества характеристик сна (субъективных и объективных) повышает мощность выводов о прогнозе в отношении неблагоприятных (фатальных) исходов [26].
Учитывая быстрое развитие современных технологий, возможности обработки большого объема данных, можно предположить, что именно комплексный подход, позволяющий анализировать сразу большое количество субъективных, клинических, лабораторных, инструментальных показателей, обеспечит персонализированную направленность сомнологии. Тогда реализуется шанс определения индивидуальных норм исходя из личностных характеристик каждого конкретного человека, особенностей образа жизни, социальной занятости и прочих параметров, а также коррекции выявляемых отклонений.
L.S. Korostovtseva, PhD, M.V. Bochkarev, PhD, Yu.V. Sviryaev, MD, PhD
Almazov National Medical Research Centre, Saint Petersburg
Contact person: Lyudmila S. Korostovtseva, korostovtseva_ls@almazovcentre.ru
The paper reviews the approaches to measure healthy sleep. Subjective and objective (e.g. polysomnography, actigraphy) approaches to assess sleep quality and duration are considered. The novel recommendations by the National Sleep Foundation on sleep duration/time and sleep quality in different age groups are presented. Subjective and objective assessments, their discrepancies and the underlying causes are discussed. The review also considers the opportunities of the integral sleep assessment in personalized medicine.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.