Дегенеративные дископатии: анализ клинического случая
- Аннотация
- Статья
- Ссылки
- English



Неспецифическая боль в нижней части спины – одна из ведущих причин потери временной трудоспособности в среднем возрасте [1]. Поставить этиологический диагноз боли в спине – крайне сложная задача в первую очередь из-за отсутствия корреляции между анатомическими находками и клиническими симптомами. Дегенеративные изменения дисков обычно не сопровождаются болезненными проявлениями. Однако в недавно проведенных исследованиях, где большой когорте пациентов с болью в спине выполнялась МРТ, удалось доказать связь между рецидивирующей/хронической болью в спине и дегенеративной болезнью диска [1]. В частности, легко определяемые с помощью МРТ изменения диска и краевых пластин в начальной стадии дегенеративного каскада (стадия 1 по классификации Modic), которые запускаются и поддерживаются низкоградуальным локальным и системным воспалением, у некоторых пациентов с неспецифической хронической поясничной болью могут проявляться клинически [2]. Далее представлен случай, демонстрирующий связь между симптомами и морфологическими изменениями диска.
История заболевания
Пациент Н., 42 года, в силу профессиональной деятельности ведет сидячий образ жизни. Четыре месяца назад у него возникла боль в пояснице, которую пациент связал с неудачной тренировкой в фитнес-клубе. В течение первых трех недель пытался купировать боль, используя аппликации геля, содержащего нестероидный противовоспалительный препарат (НПВП), на область поясницы. Топические средства приносили облегчение, но полностью боль не купировали. Приблизительно через месяц боль распространилась на верхнюю треть бедра, появилось ощущение жжения/сверления по латеральной поверхности бедра. Пациент обратился к врачу, который рекомендовал прием миорелаксанта и витаминов группы В. Интенсивность болевого синдрома уменьшилась, пациент попытался возобновить тренировки, но боль вновь усилилась.
В настоящее время боль распространяется на верхние отделы бедра, нарастая в положении сидя, из-за чего пациент вынужден периодически прерывать работу.
У пациента Н. нет социальных или связанных с профессиональной деятельностью проблем. В истории болезни нет указаний на признаки возможных серьезных заболеваний («красные флаги»). Хронические соматические заболевания отсутствуют.
Оценка болевого паттерна
Поскольку анализ истории заболевания и общее соматическое обследование на первом этапе позволили исключить вторичный характер боли в спине, на втором этапе оценивался болевой паттерн, чтобы определить этиологические факторы болевого синдрома и прогноз заболевания.
Клиницисту полезно стратифицировать пациентов с мышечно-скелетной болью в спине на группы: с иррадиацией боли в ногу и без таковой. Боли, иррадиирующие в конечность, протекают тяжелее, чаще переходят в хроническую форму и, соответственно, требуют более агрессивной терапии. Кроме того, для радикулярной боли, часто приводящей к стойкой утрате трудоспособности, также свойственно распространение на конечность.
Иррадиация боли в конечность, возникшая спустя несколько недель после начала болевого эпизода у пациента Н., – важный маркер, указывающий как минимум на высокий риск хронизации боли, что и произошло в дальнейшем. Болевой синдром продолжал беспокоить пациента и спустя 12 недель, а значит, боль перешла в хроническую фазу.
Для идентификации первичного источника боли в спине в первую очередь необходимо провести оценку болевого синдрома по следующим категориям:
- локализация;
- распространение на конечность;
- тяжесть;
- дескрипторы;
- временные характеристики;
- провоцирующие факторы;
- облегчающие факторы.
Анализ характеристик болевого синдрома пациента Н. (табл. 1) позволяет предположить, что генератором хронической боли являются структуры переднего сегмента позвоночника (дискогенная боль).
Неврологический/ортопедический осмотр
Стандартизированное клиническое обследование поясничного отдела позвоночника имеет решающее значение при диагностике этиологических факторов боли в пояснице. Оно включает осмотр позвоночника, тазобедренных суставов и конечностей с дальнейшим тестированием диапазона активных и пассивных движений, а также пальпацию мышц тазобедренного пояса.
В первую очередь оценивается состояние физиологических изгибов позвоночника (увеличение физиологического лордоза/кифоза или их сглаженность), наличие асимметрии кожных складок, деформации или искривления позвоночника, атрофии мышц. В положении пациента сидя с согнутыми до 90° коленями и бедрами оценивают асимметрию таза. Исследование подвижности тазобедренных суставов проводится в положении лежа. Врач сгибает бедро и колено до 90° и производит медиальное (30–40°) и латеральное (40–60°) вращение. Паттерн анталгической походки рассматривают с трех позиций. Уточняются болезненность и симметрия движения.
Диапазон активных движений поясничного отдела позвоночника оценивается с учетом состояния пациента. После достижения возможного предела активного движения врач осторожно пытается продлить движение для оценки диапазона пассивного движения. При оказании давления необходимо проявлять крайнюю осторожность, поскольку это может усугубить симптомы. Чтобы обеспечить движение только в позвоночнике, врач должен сидеть позади пациента и стабилизировать его, положив руки на подвздошные гребни таза.
Движение поясничного отдела позвоночника изучается в трех плоскостях и четырех направлениях:
- переднее сгибание 40–60°;
- разгибание 20–35°;
- боковое сгибание (наклон влево и вправо) 15–20°;
- вращение (влево и вправо) 3–18°.
Врач фиксирует ограничения в движении и/или болезненность.
Неврологическое обследование имеет особое значение, если есть подозрение на радикулярный характер боли. Ошибочно рассматривать любую боль, которая исходит из люмбосакрального сегмента и распространяется на конечность, как радикулярную. Радикулярной боли присуща невропатическая окраска (стреляющая, похожая на электрическое раздражение) в сочетании с парестезиями. Типично распространение боли ниже колена. Об уровне поражения корешка исключительно по иррадиации боли судить нельзя. Только сочетание боли с гипестезией в соответствующем дерматоме может служить надежным маркером топирования радикулопатии.
Цель неврологического обследования – поиск фокальных симптомов, подтверждающих радикулопатию. Классическое неврологическое обследование включает оценку болевой/тактильной чувствительности в дерматомах, иннервируемых соответствующими корешками. При этом необходимо искать как негативные (гипестезия), так и позитивные (гипералгезия, аллодиния, гиперпатия) симптомы. Радикулопатия S1 вызывает гипестезию/аллодинию по задней поверхности голени и наружному краю стопы. Сдавление корешка L5 приводит к гипестезии тыльной поверхности стопы, большого пальца и первого межпальцевого промежутка.
Оценивают симптомы натяжения и прежде всего симптом Ласега. Для этого медленно поднимают прямую ногу больного вверх, ожидая воспроизведения корешковой иррадиации боли. При вовлечении корешков L5 и S1 боль появляется или резко усиливается при подъеме ноги до 30°, а при последующем сгибании ноги в коленном и тазобедренном суставах проходит. Полезны и прямой (с болевой стороны), и перекрестный симптом Ласега, поскольку они имеют разную чувствительность и специфичность при радикулопатии.
При подозрении на вовлечение корешка L4 проверяют «передний» симптом натяжения – симптом Вассермана. О положительном результате теста можно говорить при появлении резкой боли в паховой области и по передней поверхности бедра, когда врач поднимает вверх прямую ногу пациента, лежащего на животе, и разгибает бедро в тазобедренном суставе либо сгибает ногу в коленном суставе.
Вибрационная проба – усиление боли при вибрационном раздражении области межпозвонковых дисков позволяет подтвердить локализацию генератора боли в переднем отделе позвоночника.
Обязательная манипуляция – исследование коленных и голеностопных (ахилловых) рефлексов. Ахиллов рефлекс ослабевает (выпадает) при вовлечении корешка S1. Ослабление коленного рефлекса возможно при радикулопатии L4 и типично для фораминального стеноза.
Мышечная слабость при дискогенных радикулопатиях обычно отсутствует или выражена незначительно. Тем не менее важно исследовать эффекторные мышцы. Слабость при разгибании большого пальца и стопы указывает на вовлечение корешка L5. Для поражения корешка S1 характерен парез икроножной мышцы (больной не может ходить на носках).
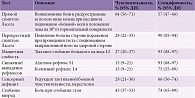
Диагностическая ценность наиболее клинически значимых симптомов радикулопатии представлена в табл. 2.
Пациент Н. был обследован по стандартному протоколу (табл. 3). Полученные результаты, в первую очередь ограничение флексии позвоночника и позитивный вибрационный тест, подтвердили первичную оценку локализации генератора боли в межпозвонковом диске L5-S1. Отсутствие симптомов выпадения корешка и постепенное начало болевого синдрома дали возможность с высокой долей вероятности исключить у пациента Н. радикулопатию. Особенностью дискогенной боли у пациента Н. является невропатическая окраска боли (типичные дескрипторы боли).
Анализ клинической картины и данные осмотра пациента Н. позволяют клинически диагностировать у него дискогенную боль на основании совокупности следующих характеристик:
- молодой возраст (< 45 лет);
- скрытое (постепенное) начало;
- усиление боли при аксиальной нагрузке;
- ухудшение состояния в положении сидя, облегчение в положении лежа;
- локализация по средней линии поясницы;
- иррадиация в верхние отделы бедра.
Концепция активной дископатии
Дискогенные боли ввиду высокой распространенности представляют собой значительную медико-социальную проблему. Около 80% взрослых людей моложе 50 лет переживают как минимум однократный эпизод боли в спине, ассоциированный с дегенеративными изменениями в дисках [3]. Более чем у трети (40%) больных в течение шести месяцев происходит рецидив боли. Таким образом, дегенеративные дископатии – одна из самых важных причин боли в спине.
Клиническая картина дискогенной боли не коррелирует с дегенеративными изменениями диска, выявляемыми на МРТ. Но еще в 1990-х гг. M. Revel и соавт., проанализировав рентгеновские снимки, сообщили, что быстрое сужение межпозвонкового пространства (≥ 50% в течение двух лет) при отсутствии конкретных причин заболевания диска связано с воспалительным процессом, ассоциированным с дегенерацией диска [4]. Важно, что пациенты с дискогенной болью лучше отвечали на НПВП, чем пациенты с неспецифической болью в спине, возникшей из-за других причин. Авторы предположили, что визуализация и клинический фенотип могут быть вызваны активным процессом нарушения молекулярной архитектоники диска. В дальнейшем связь между дискогенной болью и деструктивной болезнью межпозвонковых дисков была показана с использованием МРТ-классификации дегенеративных дископатий по Modic [5, 6].
В некоторых работах также установлена ассоциация между дискогенной болью, повышением уровня С-реактивного белка, маркера неспецифического воспаления, и МРТ-изменениями межпозвонковых дисков [7]. Концепция активной дископатии в настоящее время охватывает клинические, молекулярные и структурные (МРТ-находки) особенности, которые отражают активность (в первую очередь локальных провоспалительных процессов) в подгруппе пациентов с хронической болью в нижних отделах спины [8].
Под воздействием различных факторов (физических или длительных аксиальных нагрузок, травм, генетической предрасположенности) могут происходить надрывы фиброзного кольца. Повторные компрессионные нагрузки, например во время флексии, подвергают диск риску надрыва волокон фиброзного кольца. Фиброзное кольцо достаточно резистентно к кратковременным аксиальным нагрузкам. Однако при длительных нагрузках в сочетании с компрессионным мышечным усилием нарастает внутридисковое давление, которое может превышать прочность волокон фиброзного кольца. Содержимое пульпозного ядра просачивается через эти надрывы. В этом случае нуклеарный материал мигрирует в наружный регион фиброзного кольца, а иммунная система распознает его как инородное тело и способствует активации цитотоксических Т-лимфоцитов и продукции цитокинов. С течением времени фиброзный разрыв тампонируется гранулярной тканью, которая останавливает поток цитокинов, прекращая химическое раздражение. Но иногда при закрытии надрыва фиброзного кольца рубцовой тканью в хрящевую ткань могут прорастать сосуды и вслед за ними ноцицептивные волокна, в результате чего локальное воспаление усугубляется и пролонгируется. Неоваскуляризация ведет к хронизации воспаления за счет повышенной проницаемости. В норме хрящ не васкуляризован, но патологический ангиогенез в хрящевой ткани приводит к развитию в ней воспаления и ускоряет деструкцию хряща. В условиях хронического воспаления под влиянием провоспалительных цитокинов активируется нейрогенез. Нервные окончания подвергаются механическому сдавливанию, что может способствовать развитию невропатического компонента боли. Кроме того, при воспалении их чувствительность увеличивается в результате действия медиаторов воспаления, что приводит к усилению болевых ощущений [9]. Неонейрогенез может способствовать формированию невропатического компонента боли без компрессионного поражения корешка. Изменения, ассоциированные с активной дископатией, суммированы в табл. 4.
Пораженный сегмент диска становится более восприимчивым к вибрации и физическим перегрузкам. В свою очередь и нейроны становятся более сенсибилизированными к дальнейшей механической стимуляции, что ведет к усилению и пролонгации боли. Таким образом, именно провоспалительные агенты, связанные с дегенерацией дисков, способствуют формированию периферической сенситизации.
С большой вероятностью невропатический компонент боли у пациента Н. связан с неонейрогенезом в условиях хронического локального воспаления. МРТ-картина поясничного отдела позвоночника пациента Н. не противоречит диагностической концепции. На серии Т1- и Т2-взвешенных изображений поясничный лордоз сохранен, отмечается снижение интенсивности МР-сигнала на Т2-взвешенных изображениях межпозвонкового диска на уровне L5-S1 за счет дегидратационных изменений. Имеет место сублигаментарная экструзия пульпозного ядра межпозвонкового диска L5-S1. В смежных замыкательных пластинах тел позвонков L5-S1 наблюдается повышение интенсивности МР-сигнала на Т2, STIR и снижение интенсивности на Т1 за счет отека (соответствует Modic 1). Паравертебральные мягкие ткани на уровне L5-S1 без особенностей. Спинной мозг прослеживается до уровня L1 позвонка, имеет обычную конфигурацию и однородную структуру. Заключение: МР-картина дегенеративно-дистрофических изменений поясничного отдела позвоночника, экструзия межпозвонкового диска L5-S1, субхондральные изменения тел позвонков L5-S1.
Терапия
Лечение хронической боли в спине направлено на купирование боли, увеличение активности пациентов, редукцию психосоциального дистресса. Программа терапии и профилактики хронической боли в спине включает:
- контроль боли и воспалительного процесса, ассоциированного с дегенеративными процессами суставного аппарата позвоночного столба;
- восстановление подвижности суставов и растяжимости мягких тканей;
- усиление мышечного каркаса;
- расширение двигательной активности.
Пошаговое достижение целевой терапевтической программы возможно только при использовании мультидисциплинарных подходов с применением фармакологических и немедикаментозных методов, включая лечебную гимнастику, когнитивную терапию и информационно-образовательные программы для пациентов. Немедикаментозные методы в первую очередь ориентированы на восстановление функции и редукцию стресса.
Провоспалительные медиаторы играют ключевую роль в развитии боли в спине и представляют собой важную мишень для терапевтического вмешательства. Фармакологическое лечение, направленное на контроль боли (ингибицию провоспалительных медиаторов), подразумевает применение НПВП как патогенетических препаратов первой линии. Только при диагностировании невропатического компонента боли можно дополнительно назначить антиконвульсанты, в частности габапентин.
На протяжении последнего десятилетия выполнено несколько широкомасштабных метаанализов, в том числе Кокрановских обзоров. Они продемонстрировали строгие доказательства превосходства НПВП над плацебо в контроле острой и хронической боли в спине (уровень доказательности 1а) по таким показателям, как снижение интенсивности и время полной редукции боли, восстановление функциональной активности, меньшая потребность в дополнительной анальгезии [10]. Именно поэтому НПВП следует считать препаратами первой линии при острой и хронической боли в спине с невропатическим компонентом и без такового. Поскольку для купирования хронической боли НПВП применяются длительно (минимум четыре недели), надо учитывать возможность развития рисков, связанных с лечением: гастропатии, сердечно-сосудистые осложнения, повышение артериального давления и другие не столь частые побочные эффекты.
Купирование болевого эпизода с помощью НПВП нужно начинать как можно раньше, желательно в первые дни. Своевременное воздействие на воспалительные процессы, сопровождающие боль в спине, позволяет предупредить центральную сенситизацию и, соответственно, снизить риск перехода острой боли в хроническую. Следовательно, уже в первые часы необходимо использовать мощные быстродействующие анальгетики. Кроме того, важно информировать пациентов о благоприятном прогнозе заболевания и высокой вероятности полного регресса острого болевого эпизода.
Основная ошибка ведения пациента Н. заключалась в длительном применении топических форм НПВП, несмотря на сохранение боли и изменение ее характеристик. То, что пациент на протяжении долгого времени не получал активного противовоспалительного лечения, стало одним из факторов пролонгирования у него болевого синдрома.
Чрезмерное пребывание в постели может отрицательно сказаться на состоянии межпозвонковых дисков и мышечного каркаса, привести к общей дезадаптации, снижению мотивации на противостояние боли. Больные должны знать, что возвращение к нормальной активности должно начаться так скоро, насколько это возможно. Ориентиром в наращивании ежедневной двигательной активности служит интенсивность болевого синдрома. Расширение двигательных возможностей пациентов не должно усугублять болевой синдром. В представленном клиническом случае попытки пациента Н. возобновить физическую активность сопровождались усилением боли, изменением ее характеристик, что также свидетельствует о недостаточном фармакологическом контроле боли.
Контроль боли, особенно на ранних этапах, безусловно, предполагает использование самых эффективных обезболивающих средств. В этом аспекте заслуживают внимания производные пропионовой кислоты (флурбипрофен, ибупрофен, кетопрофен, напроксен), которые отличаются наилучшим соотношением эффективности и безопасности. В свою очередь среди производных пропионовой кислоты лидирующее положение по анальгетической активности занимает кетопрофен. Выраженный обезболивающий эффект кетопрофена складывается из общего для всех представителей НПВП механизма действия, связанного с подавлением активности циклооксигеназы, а также из дополнительных анальгетических механизмов и некоторых фармакокинетических характеристик препарата.
Кетопрофен представляет собой рацемическую смесь двух стереоизомеров. В отношении анальгетического эффекта активен только один, в то время как другой обладает слабо выраженными основными эффектами, но значительно повышает частоту развития нежелательных явлений. Было установлено, что только S(+)-изомер (правовращающий) ингибирует циклооксигеназу. Для обеспечения высокой терапевтической эффективности и безопасности из рацемической смеси был выделен S(+)-изомер, который в виде водорастворимой соли (трометамоловой, или декскетопрофена трометамола) используется в готовых лекарственных формах. Декскетопрофен реализует эквивалентную кетопрофену анальгезию в половинной дозе и при этом обладает лучшей переносимостью [11].
По данным клинических исследований, на модели острой боли в спине доказано превосходство декскетопрофена трометамола над трамадолом по соотношению «эффективность – безопасность» [12].
Результаты фармакокинетических исследований свидетельствуют о том, что декскетопрофена трометамол быстро и полностью абсорбируется после приема внутрь. Время достижения максимальной концентрации декскетопрофена в плазме крови короче, чем у кетопрофена, и составляет около 15 минут. Использование активного изомера, короткий период полувыведения и быстрая элиминация снижают риск развития серьезных побочных явлений. Сходные после однократного и повторного введения фармакокинетические параметры свидетельствуют об отсутствии у препарата кумулятивных свойств, что также обеспечивает его высокую безопасность.
Наличие инъекционной формы позволяет проводить незамедлительное обезболивание при высокой интенсивности болевого синдрома. Необходимо отметить универсальность применения декскетопрофена в форме раствора для инъекций (внутривенно струйно или капельно, внутримышечно), что выгодно отличает препарат от других анальгетиков.
Не рекомендуется проводить инъекционное лечение дольше двух суток. Через сутки или двое следует перейти на таблетированную форму, которая содержит 25 мг активного вещества и начинает действовать при пероральном приеме в течение 30 минут, причем эффект сохраняется на протяжении трех – шести часов (максимальная суточная доза – 75 мг). Длительность терапии Дексалгином, независимо от способа приема, составляет пять дней.
Сравнительное исследование эффективности декскетопрофена и диклофенака при неспецифической боли в спине продемонстрировало преимущество декскетопрофена. Начиная с первой недели и до окончания лечения в группе декскетопрофена отмечались достоверно более низкие значения интенсивности боли по визуальной аналоговой шкале. По данным дисперсионного анализа, выбор НПВП – наиболее значимый фактор, определяющий эффективность лечения [13]. Авторы делают вывод, что применение декскетопрофена при неспецифической боли в пояснице приводит к более быстрому возвращению к полной физической активности и, следовательно, более быстрому возвращению к работе. Крупное постмаркетинговое наблюдательное исследование продемонстрировало эффективность и безопасность перорального применения декскетопрофена при различных показаниях. Большинство пациентов отметили умеренный или выраженный терапевтический эффект без каких-либо нежелательных явлений. Серьезных побочных реакций, особенно связанных с желудочно-кишечными и нервными расстройствами, зарегистрировано не было [14].
Длительность приема НПВП при хронической боли в спине может превышать четыре недели, поэтому у пациентов в группе риска необходимо использовать гастропротекторы (ингибиторы протонной помпы). Кроме того, надо следить за артериальным давлением, водно-электролитным балансом и ренальной функцией больных. Индивидуально подобранная комбинированная терапия может усилить обезболивающий эффект при одновременном уменьшении дозы составных веществ, тем самым снижая частоту побочных явлений. В случае длительности болевого синдрома свыше шести недель показан прием антидепрессантов. Некоторые антидепрессанты, в частности ингибиторы обратного захвата норадреналина и серотонина, обладают свойством модулирования боли независимо от влияния на депрессивное настроение. Появляется все больше доказательств пользы применения в качестве адъювантной терапии симптоматических препаратов замедленного действия (Symptomatic Slow Acting Drugs for Osteoarthritis – SYSADOA). Эти средства назначаются на длительный срок (шесть и более месяцев), то есть пациентам нужно продолжать принимать SYSADOA даже после купирования болевого эпизода и отмены НПВП.
Неадаптивное болевое поведение – основной барьер на пути к выздоровлению. Необходимо побуждать пациентов к позитивному изменению образа жизни (отказ от курения, контроль веса, занятия лечебной физкультурой, ежегодные курсы массажа, владение аутогенной тренировкой с умением расслаблять мышцы). Последнее время набирают популярность так называемые противовоспалительные диеты. Убедительных доказательств их эффективности пока недостаточно, однако надо отметить рациональность принципов, на которых они построены. Как и средиземноморская диета, противовоспалительные диеты предполагают включение в рацион больше рыбы, свежих фруктов и овощей, здоровых жиров, умеренных порций орехов и минимальное употребление красного мяса.
Для модификации неадаптивного ответа на боль применяется когнитивно-поведенческая терапия. В ее основе лежит идея о том, что мышление и поведение человека могут влиять на симптомы боли. Терапия позволяет человеку изменить отношение к боли, ускоряя восстановление организма. После когнитивно-поведенческой терапии пациенты быстрее возвращаются к профессиональной деятельности, нуждаются в меньшем количестве медикаментозных средств и реже испытывают эпизоды боли в дальнейшем [15].
После анализа клинической картины и результатов обследования пациента Н. стало понятно, что в значительной степени ранее проводившееся лечение было неуспешным из-за недооценки интенсивности локального воспаления. Поэтому пациенту был рекомендован прием Дексалгина в максимальной дозе 75 мг/сут коротким курсом (пять дней) в сочетании с омепразолом 20 мг/сут. В качестве адъювантной терапии назначили прегабалин (целевая доза 150 мг/сут) и комплексный препарат из группы SYSADOA, содержащий глюкозамин и хондроитин. Через пять дней интенсивность боли снизилась на 40% (с 68 до 41 балла по визуальной аналоговой шкале). Для хронической боли редукция на 40% за короткий период рассматривается как оптимальный ответ на терапию. Выраженная редукция боли на фоне приема Дексалгина, обладающего мощным анальгетическим и противовоспалительным эффектом, косвенно подтверждает роль локального воспаления в генезе боли у пациента Н. В дальнейшем лечение было продолжено и усилено дулоксетином по 60 мг/сут – антидепрессантом из группы селективных ингибиторов обратного захвата серотонина и норадреналина. Пациенту также рекомендовалось постепенно наращивать дневную физическую активность под контролем специалиста.
После восьми недель лечения интенсивность боли снизилась до 21 балла по визуальной аналоговой шкале. Каких-либо побочных явлений за время терапии пациент Н. не отмечал. Уменьшение хронической боли более чем на 50% считается хорошим результатом. Были отменены прегабалин, дулоксетин, а прием препарата из группы SYSADOA решили продолжить. С целью воздействия на «остаточную» боль и профилактики рецидивов для пациента Н. была разработана индивидуальная немедикаментозная программа, включающая лечебную гимнастику, изменение позы во время работы, релаксирующий массаж мышц спины.
Выводы
Представленный клинический случай демонстрирует успешное консервативное ведение пациента с хронической дискогенной болью в условиях поликлинического звена.
O.V. Vorob’eva, MD, PhD, Prof.
I.M. Sechenov First Moscow State Medical University
Contact person: Olga V. Vorob’eva, ovvorobeva@mail.ru
Back pain is often being regarded as non-specific because of the difficulties in identifying of the pain primary source in routine clinical practice. The article considers approaches to the diagnosis of discogenic pain on a clinical example, discusses the concept of active discopathy. The presented clinical case demonstrates the possibilities of successful complex conservative treatment, in particular with the use of dexketoprofen, of chronic discogenic pain in the conditions of primary polyclinic.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.