Промежуточная оценка обеспеченности витамином D в проспективной когорте женщин в поздней постменопаузе
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Выполнено одномоментное обследование женщин в период поздней постменопаузы, которым предложено участие в проспективной когорте наблюдения. Всего с 2016 по 2019 г. обследовано 107 жительниц Среднего Урала, проживающих самостоятельно и не нуждающихся в посторонней помощи.
Результаты. Оптимальный уровень 25(OH)D выявлен у 24 (22,4%) пациенток, недостаточность витамина D – у 35 (32,7%), дефицит – у 48 (44,8%) женщин. Пациентки значимо различались по возрасту, данным кистевой динамометрии доминирующей кисти и результатам тандем-теста.
Из 107 обследованных 89 (83%) не принимали колекальциферол, 18 (17%) принимали. Регулярно принимавшие колекальциферол в профилактических дозах имели значимо более высокие значения 25(OH)D в крови. Дефицит и недостаточность витамина D в группе не получавших колекальциферол встречались значимо чаще, чем в группе получавших этот препарат. Значимых сезонных различий в уровне витамина D у не получавших колекальциферол не обнаружено.
Заключение. У жительниц Среднего Урала, находящихся в периоде поздней постменопаузы, дефицит и недостаточность витамина D выявлялись с высокой частотой. Профилактический прием колекальциферола не обеспечивал достижения оптимальной концентрации витамина D, однако способствовал более высоким его значениям. Женщины, оптимально обеспеченные витамином D, имели значимо лучшие показатели физического функционирования.
Материал и методы. Выполнено одномоментное обследование женщин в период поздней постменопаузы, которым предложено участие в проспективной когорте наблюдения. Всего с 2016 по 2019 г. обследовано 107 жительниц Среднего Урала, проживающих самостоятельно и не нуждающихся в посторонней помощи.
Результаты. Оптимальный уровень 25(OH)D выявлен у 24 (22,4%) пациенток, недостаточность витамина D – у 35 (32,7%), дефицит – у 48 (44,8%) женщин. Пациентки значимо различались по возрасту, данным кистевой динамометрии доминирующей кисти и результатам тандем-теста.
Из 107 обследованных 89 (83%) не принимали колекальциферол, 18 (17%) принимали. Регулярно принимавшие колекальциферол в профилактических дозах имели значимо более высокие значения 25(OH)D в крови. Дефицит и недостаточность витамина D в группе не получавших колекальциферол встречались значимо чаще, чем в группе получавших этот препарат. Значимых сезонных различий в уровне витамина D у не получавших колекальциферол не обнаружено.
Заключение. У жительниц Среднего Урала, находящихся в периоде поздней постменопаузы, дефицит и недостаточность витамина D выявлялись с высокой частотой. Профилактический прием колекальциферола не обеспечивал достижения оптимальной концентрации витамина D, однако способствовал более высоким его значениям. Женщины, оптимально обеспеченные витамином D, имели значимо лучшие показатели физического функционирования.


Введение
Недостаточная обеспеченность витамином D – широко распространенное явление в мире. В настоящее время это стало серьезной проблемой здравоохранения [1]. Основными факторами снижения уровня кальцидиола крови (25-гидроксивитамина D – 25(OH)D) являются пожилой возраст, женский пол, более высокая широта места жительства, зимний сезон, более темная пигментация кожи, меньшая продолжительность воздействия солнечного света, пищевые привычки и недостаточная фортификация пищевых продуктов витамином D [2].
Витамин D влияет на гомеостаз кальция и фосфора, а также обладает множественными плейотропными эффектами [3, 4].
Протективная роль эстрогенов в отношении минеральной плотности кости у женщин достаточно известна. Одними из ведущих проблем поздней постменопаузы являются остеопения, остеопороз, а также высокий риск падений и переломов [5]. Согласно эпидемиологическим данным, второе место среди наиболее частых причин падений у пожилых занимают внутренние причины – мышечная слабость и нарушение равновесия. Витамин D является важным компонентом, обеспечивающим самостоятельный протективный эффект в отношении скелетно-мышечных расстройств и профилактики падений у лиц пожилого возраста. Изменения, возникающие при дефиците витамина D, затрагивают в основном проксимальные группы мышц, чаще нижних конечностей, ответственных за вертикальное положение тела и ходьбу [6]. Согласно данным метаанализов, дополнительный прием колекальциферола в дозе 482–770 МЕ/сут приводит к снижению риска переломов позвонков как минимум на 20%, переломов бедра – на 18% [7]. Адекватная обеспеченность витамином D может положительно влиять на мышцы, улучшать баланс за счет восстановления нервно-мышечных функций.
Целью нашего исследования стала оценка обеспеченности витамином D у женщин в поздней постменопаузе, влияния дефицита витамина D и мероприятий по его профилактике на физическое функционирование [8].
Материал и методы
С 2016 по 2019 г. обследовано 107 жительниц Среднего Урала, проживавших самостоятельно и не нуждавшихся в посторонней помощи. Медиана возраста участниц – 67 (65–69 (25–75%)) лет.
Критерии включения в исследование:
- длительность постменопаузы пять лет и более;
- подписанное информированное согласие на участие в исследовании.
В исследование не включали пациенток, принимавших активные метаболиты витамина D (альфакальцидол).
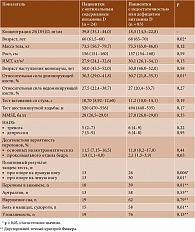
Характеристика участниц исследования представлена в табл. 1.
В данной когорте проведен унифицированный сбор жалоб и анамнеза, определены рост и масса тела, рассчитан индекс массы тела (ИМТ), десятилетняя вероятность основных остеопоротических переломов и переломов проксимального отдела бедренной кости с помощью FRAX [6], российская модель (https://www.sheffield.ac.uk/FRAX/tool.aspx?lang=rs). Остеоартрит и остеопороз диагностировали согласно действующим клиническим рекомендациям Ассоциации ревматологов России [9, 10]. Обеспеченность витамином D оценивали по концентрации 25(OH)D в крови согласно классификации Российской ассоциации эндокринологов [10]. Адекватным считали уровень более 30 нг/мл, недостаточным – от 20 до 30 нг/мл. Дефицит витамина D диагностировали при уровне 25(OH)D менее 20 нг/мл. Перед сдачей анализа крови прекращения приема колекальциферола не требовалось [10]. Сбор венозной крови проводился после восьмичасового голодания. Уровень 25(ОН)D оценивали с помощью электрохемилюминесцентного иммуноанализа (ECLIA).
Физическое функционирование определяли по результатам кистевой динамометрии, теста шестиминутной ходьбы и краткого комплекса тестов физической активности (Short Physical Performance Battery – SPPB) [11]. Для оценки мышечной силы кисти использовали электронный динамометр кистевой ДК-50, подходящий для женщин [12]. Результат замеров фиксировался в деканьютонах (даН). Диапазон измерений от 5 до 50 даН, цена деления шкалы – 0,01 даН, предел допустимой абсолютной погрешности ±1,5 даН. Габаритные размеры – 135 × 50 × 25 мм. Оценку абсолютной сгибательной силы кистей проводили стоя: пациентки отводили вытянутую руку с динамометром под прямым углом к туловищу (на уровне плеча), вторую (свободную) руку оставляли опущенной и расслабленной. По сигналу исследователя пациентка максимально сжимала динамометр в течение трех – пяти секунд – по два измерения на каждой руке с интервалом одна минута. Для интерпретации полученных результатов использовали показатель относительной силы кисти, соотнесенный с массой тела [12].
Тесты для определения индивидуального риска падения проводил не осведомленный о целях исследования медицинский персонал.
Тест вставания со стула (Chair Rising Test) проводили по следующим правилам. Пациенткам предлагалось как можно быстрее встать и сесть по пять раз на стул высотой не более 46 см без помощи рук (руки сложены на груди крест-накрест). Риск падений считался повышенным, если вставание со стула занимало более десяти секунд или было невозможным [12].
Тандем-тест (Tandem Gait) проводился после полутандемных тестов, с помощью которых оценивалась способность сохранять равновесие в покое. Пациенткам предлагалось поставить ступни в положение тандем (последовательное расположение стоп одна за другой по прямой линии, при этом пятка передней стопы касалась носка задней), не закрывая глаз. Положение рук произвольное. При выполнении теста исследователь должен был находиться рядом для предупреждения падения. Перемещение стоп или потеря равновесия расценивались как преждевременное завершение теста. Неспособность пациенток сохранять данное положение в течение десяти секунд расценивалось как высокий риск падений. Допускалось не более трех попыток [12].
Тест вставания со стула и тандем-тест не проводили у женщин с остеоартритом коленных и тазобедренных суставов, перенесших инсульт или передвигавшихся с тростью из-за выраженной мышечной слабости, головокружения, нарушения зрения или иных причин, а также с болью любой локализации более семи баллов по визуальной аналоговой шкале (ВАШ). У этих участниц риск падений признавался высоким.
Диагностику когнитивных нарушений проводили с помощью краткой шкалы оценки психического статуса (Mini-Mental State Examination – MMSE) [13]. Выраженность симптомов тревоги и депрессии – Госпитальной шкале тревоги и депрессии (Hospital Anxiety and Depression Scale – HADS) [14].
Как было отмечено ранее, интенсивность боли оценивали по ВАШ. Отсутствие боли соответствовало нулю, максимальная боль – десяти баллам [15].
Для статистической обработки данных использовали программу Statistica (версия 10.0), критерий Манна – Уитни для сравнения несвязанных совокупностей, а также коэффициент ранговой корреляции Спирмена. Значимость различий определяли с помощью точного критерия Фишера, критерия χ2 Пирсона.
Результаты
В целом адекватный уровень 25(OH)D выявлен у 24 (22,4%) женщин, недостаточность – у 35 (32,7%), дефицит – в 48 (44,8%) случаях. Результаты сравнения групп с оптимальным содержанием витамина D (n = 24) и недостаточным уровнем или дефицитом витамина D (n = 83) представлены в табл. 2. Пациентки этих групп значимо различались по возрасту. Так, женщины с недостаточностью и дефицитом витамина D были старше. По данным кистевой динамометрии, у них также была меньше относительная сила доминирующей кисти (p = 0,01). Они чаще не справлялись с выполнением тандем-теста. Однако статистически значимых различий по результатам тестов вставания со стула и шестиминутной ходьбы между данными группами не выявлено (см. табл. 2).
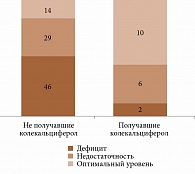
Из 107 женщин 89 (83,1%) не принимали колекальциферол или принимали его нерегулярно (группа не получавших колекальциферол). Колекальциферол в виде монотерапии или в комбинации с препаратами кальция получали 18 (16,8%) пациенток (группа получавших колекальциферол). Так, пять (27,7%) женщин получали препараты витамина D в виде монотерапии, пять (27,7%) – комбинированный препарат кальция карбоната и колекальциферола, три (16,6%) – комбинированный препарат плюс масляный раствор колекальциферола, пять (27,7%) пациенток – биологически активные добавки с колекальциферолом.
Пациентки, как не получавшие, так и получавшие колекальциферол, значимо не различались по возрасту, длительности постменопаузы, ИМТ.
У регулярно принимавших колекальциферол в профилактических дозах значения 25(OH)D в крови были значимо выше, чем у не принимавших или принимавших препарат нерегулярно, – 33,7 (25,0–39,7) против 19,7 (15,2–24,6) нг/мл (критерий Манна – Уитни, p = 0,00002). Дефицит и недостаточность витамина D у не получавших колекальциферол выявляли значимо чаще (df = 2, χ2 = 16,083, p = 0,0003) (рис. 1). При этом их обеспеченность витамином D не зависела от сезона, хотя с января по апрель были зарегистрированы более низкие показатели (табл. 3).
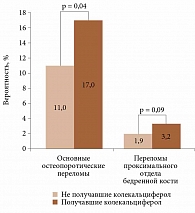
Данные группы различались по десятилетней вероятности основных остеопоротических переломов (критерий Манна – Уитни, p = 0,04) и не различались по риску переломов проксимального отдела бедренной кости (критерий Манна – Уитни, p = 0,09). Так, среди получавших колекальциферол первый показатель оказался выше (рис. 2). Значения FRAX, без учета уровня минеральной плотности костной ткани, выше порога терапевтического вмешательства отмечены у 58 (54,2%) пациенток без остеопоротических переломов в анамнезе и семи (12%) с уже состоявшимися переломами, при этом одна из них получала колекальциферол.
Обсуждение результатов
Дефицит и недостаточная обеспеченность витамином D диагностированы у большинства обследованных жительниц Среднего Урала. Так, у каждой третьей (32,7%) женщины в период поздней менопаузы обнаружена недостаточность витамина D, у каждой второй (44,8%) – его дефицит. Аналогичные результаты получены в отношении жителей Северо-Западного региона (37,5 и 45,7%), однако в этом исследовании принимали участие и мужчины, и женщины, а также дети семи лет и старше [16]. Установлено, что в зимнее время у 47% жителей Екатеринбурга в возрасте 50 лет и старше уровень 25(ОН)D ниже 10 нг/мл [17].
С учетом территориального расположения России (выше 35° северной широты) дефицит гормонотропного воздействия солнечных лучей ожидаем. Для Екатеринбурга, расположенного на уровне 56° северной широты, на таковой приходится четыре месяца в год – с середины апреля до середины августа [3]. Низкая инсоляция обусловлена загрязненностью атмосферы и толщиной облаков, а также инфильтрацией солнечных лучей через озоновый слой под более острым углом [3].
В нашем исследовании у не получавших витамин D женщин концентрация 25(OH)D не зависела от сезона, несмотря на более низкие показатели в период с января по апрель. Однако анализ литературы свидетельствует о возможности сезонных различий в выработке витамина D [18]. Так, у женщин в постменопаузе, проживающих в Москве, отмечались сезонные колебания уровня 25(ОН)D. При этом низкие средние показатели регистрировались в январе – апреле. Согласно результатам исследования, проведенного в Республике Башкортостан, в период максимальной инсоляции у 66% обследованных городских жителей старше 50 лет диагностирован гиповитаминоз D [19]. При этом уровень 25(OH)D среди городского и сельского населения не различался. Максимальная инсоляция ассоциировалась с повышением уровня витамина D, особенно выраженным у жителей сельской местности. В исследованиях, проведенных в Санкт-Петербурге, у женщин позднего репродуктивного периода высокая распространенность дефицита и недостаточности витамина D (86,9% случаев) не была связана с определенным временем года [20, 21].
Период поздней постменопаузы характеризуется дефицитом эстрогенов и, следовательно, снижением их остеопротективных эффектов. Это обусловливает уменьшение уровня минеральной плотности костной ткани у женщин. Эстрогены влияют на активацию 1-альфа-гидроксилазы, участвующей в синтезе кальцитриола. Немаловажными являются возрастное снижение количества и чувствительности рецепторов витамина D (VDR) в кишечнике, а также почти трехкратное снижение способности кожи к выработке витамина в период постменопаузы [22, 23]. Отрицательная корреляция между уровнем 25(OH)D и возрастом прослеживалась и в других исследованиях, при этом в период максимальной инсоляции она приобретала более выраженный характер (-0,366 в период минимальной инсоляции и -0,512 в период максимальной инсоляции) [23]. Аналогичные данные получены в отношении лиц старше 65 лет, проживающих в Северо-Западном регионе: низкие показатели 25(ОН)D чаще встречались в возрастной группе старше 85 лет (р < 0,001) [20].
Полученные данные обусловливают актуальность диагностики и коррекции недостаточности или дефицита витамина D по мере увеличения возраста.
Данные метаанализов, систематических обзоров подтверждают связь между дефицитом витамина D и риском развития остеопороза, остеопоротических переломов, падений, мышечной слабости, а также снижением физической активности пациентов старшей возрастной группы [24].
В проведенном нами исследовании также отмечена зависимость степени физического функционирования пациенток от уровня витамина D. Так, данные кистевой динамометрии доминирующей кисти свидетельствовали о мышечной слабости, тандем-теста – высоком риске падений. Различие результатов тандем-теста при опоре на правую или левую ногу могли быть обусловлены деформацией стопы из-за изменения походки у лиц старшего возраста [23].
В ряде исследований с участием пациентов старше 65 лет показана важная роль низкого уровня витамина D в формировании саркопении и увеличении риска падений [4, 6, 7, 20–22]. Однако существуют работы, в которых связь между уровнем витамина D и силой мышц не зафиксирована [23].
В настоящее время получены убедительные доказательства, что длительное применение витамина D в виде монотерапии или в сочетании с кальцием при адекватной приверженности способствует снижению риска падений и периферических переломов, включая переломы проксимального отдела бедренной кости [24].
Ограничением нашего исследования является отсутствие данных об актуальных дозах принимаемого колекальциферола. Кроме того, участники исследования отмечали, что применяли как водный, так и масляный раствор витамина D, в зависимости от наличия последних в аптечной сети. Именно поэтому сравнить эффективность, безопасность и переносимость разных форм витамина D не представлялось возможным.
Заключение
Дефицит или недостаточность витамина D с высокой частотой выявляются у жительниц Среднего Урала, находящихся в периоде поздней постменопаузы. Профилактический прием колекальциферола не обеспечивает достижения оптимальной концентрации витамина D, однако способствует ее повышению. У лиц, получающих профилактические дозы витамина D, необходимо периодически определять уровень 25(ОН)D. У женщин с оптимальной обеспеченностью витамином D отмечаются значимо лучшие показатели физического функционирования.
Оценка риска переломов с помощью FRAX может мотивировать больных следовать рекомендациям врачей.
Авторы заявляют об отсутствии конфликта интересов.
Исследование не имело спонсорской поддержки. Ни одна фармацевтическая или иная компания не оказывала финансового или иного влияния на планирование, проведение и обработку результатов исследования.
Авторы выражают благодарность В.М. Бахтину за помощь в сборе анамнеза, проведении тестов, И.Н. Поповой за помощь в оформлении рукописи перед отправкой в редакцию.
N.V. Izmozherova, MD, PhD, Prof., A.A. Popov, MD, PhD, А.A. Vikhareva, Ye.A. Safyanik, A.V. Spevak
Ural State Medical University
Contact person: Anna A. Vikhareva, anna1993vi@gmail.com
Objective: to assess vitamin D repletion in prospective cohort of late postmenopausal women and to establish the contribution of vitamin D deficiency and measures for its prevention to physical functioning of women.
Material and methods. 107 postmenopausal Middle Urals region residents were recruited to a prospective cohort nested cross-sectional study. The data were obtained from 2016 to 2019.
Results. According to the concentration level of 25(OH)D, an adequate level was detected in 24 patients (22.4%), insufficiency in 35 (32.7%), deficiency in 48 cases (44.8%). No significant seasonal differences in vitamin D levels were found. Patients significantly differed in age, according to the wrist dynamometry of dominant hand and according to results of tandem test.
By the inclusion visit, 89 patients (83.1%) were not receiving vitamin D supplementation, 18 persons (16.8%) were compliant to cholecalciferol prophylactic doses consumption, had significantly higher values of 25(OH)D in the blood.
Vitamin D deficiency and insufficiency in the group not receiving cholecalciferol were significantly more common than in the group who followed the recommendations.
Conclusion. Deficiency and insufficiency of vitamin D are detected with high frequency in the residents of the Middle Urals in late postmenopause. Prophylactic administration of cholecalciferol did not achieve optimal concentration of vitamin D, but contributed to its higher values. Women who were optimally provided with vitamin D had significantly better physical functioning.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.