Лечение острой боли
- Аннотация
- Статья
- Ссылки
- English

Устранение боли часто является первостепенной задачей врача независимо от его специализации. Именно боль – наиболее распространенная причина обращений за медицинской помощью [1]. Врачам часто приходится сталкиваться с острой болью, связанной с каким-либо повреждающим действием и играющей сигнальную роль. Такая боль как бы оповещает о наличии повреждения, запуская в организме каскад ответных реакций, направленных на ограничение распространения и подавление действия повреждающих факторов. Ежегодно до 20% людей в развитых странах испытывают острую боль [2]. В ряде случаев она бывает интенсивной, что определяет необходимость ее максимально быстрого купирования, и, как правило, непродолжительной. Однако без адекватной и своевременной терапии длительная боль может утратить связь с первопричиной и со временем перейти в хроническую, сохраняющуюся годами. Хроническая боль регистрируется реже острой. Часто такая боль сопровождает хронические заболевания, например ревматоидный артрит, остеоартрит, многие онкологические заболевания. Во многом именно от того, как контролируется боль, зависит ее исход. В аналогичных ситуациях исход может быть разный – от полного устранения боли в кратчайшие сроки до формирования хронической боли. Не случайно важность адекватного купирования боли была подчеркнута Американским обществом боли (American Pain Society), назвавшим боль «пятой из жизненно важных функций» [3].
Боли могут сопутствовать серьезные психологические проблемы, такие как тревога, депрессия, нарушение сна. Кроме того, учитывая немаловажные социальные аспекты боли, ее не следует рассматривать только как проблему больного, которую должен решить врач. Лечение боли дорого обходится и работодателям. Например, в США ежегодные экономические затраты, связанные с болью, составляют порядка 80 млрд долларов, и каждый год около 50 млн рабочих дней теряются из-за боли [4].
Цели терапии острой и хронической боли различны. Очевидно, что при острой боли необходимо обеспечить быстрое эффективное обезболивание и лечение, направленное на устранение ее причины [5]. При хронической боли, обычно связанной с хроническими заболеваниями, необходимо поддерживать состояние, при котором боль будет временно устранена или максимально уменьшена [6].
В настоящее время лечение ноцицептивной боли (наиболее распространенный тип боли, связанный с любым повреждающим действием (механическая травма, воспаление, оперативное вмешательство, термический или электрический ожог и т.д.), вызывающим раздражение болевых рецепторов) проводится по схеме, рекомендованной Всемирной организацией здравоохранения (ВОЗ).
Казалось бы, алгоритм максимально прост. На первой ступени назначают нестероидные противовоспалительные препараты (НПВП) или ненаркотические анальгетики (парацетамол). При их недостаточной эффективности к терапии добавляют слабые опиоидные анальгетики (вторая ступень), а при сохранении боли в этом случае (на третьей ступени) – сильные. В зависимости от причин, вызывающих боль, для усиления аналгетического действия и уменьшения потребности в наркотических анальгетиках дополнительно могут использоваться и другие группы препаратов. Тем не менее в основе лечения боли, как правило, лежит назначение именно препаратов из описанных выше групп. Очевидно, что для проведения адекватной терапии боли необходимы определенные знания, соответствующая подготовка медицинских работников. Это особенно важно при индивидуальном подходе к выбору эффективных анальгетиков – для минимизации риска побочных явлений. В реальности же только один из четырех больных в послеоперационном периоде получает адекватную аналгезию, а около 40% больных с умеренной или сильной болью не достигают ее адекватного уменьшения [1, 7]. Между тем следует отметить, что сегодня в распоряжении врачей имеется большой арсенал обезболивающих средств.
Oпиоиды
Oпиоиды, производные алкалоидов, извлеченных из сока недозрелого papaver somniferum (мак), и их синтетические производные, часто рассматриваются как эталон в лечении боли. В связи с этим при исследовании эффективности других препаратов, назначаемых с целью аналгезии, их часто сравнивают именно с опиоидами.
Активация опиоидных рецепторов приводит к ингибированию синаптической нейротрансмиссии в центральной (ЦНС) и периферической нервной системе (ПНС). Опиоиды связываются с рецепторами и повышают нейротрансмиссию нескольких основных классов опиоидных рецепторов. Физиологические эффекты опиоидов опосредуются главным образом через мю- и каппа-рецепторы в ЦНС и ПНС. В результате взаимодействия опиоидов с мю-рецепторами возникают такие эффекты, как обезболивание, эйфория, угнетение дыхания и миоз; с каппа-рецепторами – обезболивание, миоз, угнетение дыхания и седативный эффект. Два других опиатных рецептора (сигма и дельта) обусловливают эффекты некоторых опиатов: сигма-рецепторы – развитие дисфории, галлюцинаций, психотических реакций; дельта-рецепторы – эйфории, обезболивания и судорог. Опиаты уменьшают ощущение боли, не устраняя и не снижая болевую стимуляцию. Однако, вызывая эйфорию, опиоидные агонисты снижают чувствительность к экзогенным стимулам.
В России ведется строжайший контроль за назначением опиоидов, в связи с чем их применение в клинической практике сведено к минимуму и в основном ограничено назначением пациентам в послеоперационном периоде и онкологическим больным. C одной стороны, это уменьшает наши возможности в выборе, с другой, если опираться на опыт стран, где широко используются опиоиды, позволяет избежать осложнений, связанных с их назначением. Во многих странах мира использование этих средств прогрессивно увеличивается. Так, в США за последние 20 лет (с 1993 по 2012 г.) производство морфина возросло более чем в 4 раза, а оксикодона – более чем в 40 раз (!) [8]. При этом Федеральное агентство по контролю за пищевыми продуктами и лекарственными препаратами США (Food and Drug Administration, FDA) всерьез обеспокоено участившимися сообщениями о нехватке наркотических анальгетиков. Проведенное в США исследование, посвященное боли в пояснице, показало, что общее использование опиоидов для лечения этой боли возросло с 11,6% в 1996 г. до 12,6% в 1999 г. [9]. Лечение опиоидной зависимости крайне дорогое (в США это десятки миллиардов долларов ежегодно, что во много раз превышает стоимость лечения больных без такой зависимости). Кроме того, применение подобных средств связано с риском смертельных осложнений (в США число смертей, связанных с применением опиоидов, приближается к 20 тыс. и непрерывно растет) [10]. По оценкам A. Casati и соавт., в Канаде 1,3% населения злоупотребляют опиоидами рецептурного отпуска. Данная проблема актуальна и для европейских стран – Франции, Италии, Литвы и Польши [11]. В настоящее время 8,7% американцев в возрасте старше 12 лет – активные потребители наркотических препаратов, и на фоне снижения, например, числа пользователей героина в последние годы он вытесняется именно опиоидами рецептурного ряда, потребителей которого становится больше год от года [12–15].
Одна из основных причин популярности опиоидов – быстрота эффекта, что позволяет с успехом применять их именно при острой боли. Как правило, пик эффекта достигается через 10 минут при внутривенном введении, через 10–15 минут при интраназальном применении (буторфанол, героин), через 30–45 минут при внутримышечном введении, через 90 минут при пероральном приеме и через 2–4 часа после кожного применения (фентанил). При этом устойчивое мнение об эффективности наркотических анальгетиков при хронической неонкологической боли не находит научных доказательств, а медицинский персонал зачастую не обладает должными навыками контроля за больными, получающими такое лечение [13–16].
Большинство опиоидов метаболизируется путем печеночной конъюгации до неактивных соединений, которые легко выводятся с мочой. Однако опиоиды оказывают пролонгированное действие у пациентов с заболеваниями печени, например с циррозом, что приводит к накоплению препарата в организме и опиоидной токсичности. Токсическому действию препаратов может способствовать и нарушение функции почек. В связи с этим, помимо тщательного сбора анамнеза, направленного на выявление возможных причин, способных усиливать риски, связанные с назначением опиоидных препаратов (в частности, потребление алкоголя), необходим строжайший динамический мониторинг больных.
Ненаркотические анальгетики
Парацетамол – ненаркотический анальгетик, производный анилина, один из наиболее часто применяемых в мире препаратов у больных с острой болью, используется в медицинской практике уже более 100 лет. Тем не менее причины аналгетического действия парацетамола стали понятны совсем недавно. Вероятно, они связаны прежде всего с непрямой активацией каннабиноидных рецепторов CB₁ в головном мозге и ганглиях задних корешков [17, 18].
Противовоспалительные свойства парацетамола не столь сильны, как НПВП, что, с одной стороны, ограничивает его применение у лиц с воспалительными заболеваниями, с другой – определяет низкий риск ряда побочных эффектов, характерных для НПВП (со стороны желудочно-кишечного тракта (ЖКТ) и сердечно-сосудистой системы). Кроме того, НПВП в отличие от опиоидов не угнетают дыхательный центр. Парацетамол уступает НПВП и по аналгетическому эффекту [19]. Таким образом, парацетамол является препаратом выбора для лечения только слабой боли, причем невоспалительной, особенно у больных, склонных к заболеваниям ЖКТ, принимающих салицилаты и/или антикоагулянты, или при коагулопатиях. Аналгетическая эффективность парацетамола эквивалентна таковой аспирина, а необходимые для достижения аналгезии плазменные концентрации выше тех, которые требуются для жаропонижающего эффекта [20]. Максимальный эффект у взрослых достигается при приеме 1000 мг парацетамола, и последующее увеличение дозы не усиливает аналгезию, но повышает токсичность препарата [21]. При этом период полувыведения у парацетамола очень мал – 1–3 часа, а длительность аналгетического действия всего 3–4 часа, что определяет необходимость его приема несколько раз в день. Однако терапевтическое окно у препарата очень узкое, и небольшая передозировка может оказать тяжелое побочное действие, обусловленное, как правило, гепатотоксичностью. Парацетамол метаболизируется в основном в печени путем конъюгации с глюкуронидом, сульфатом и окисления при участии смешанных оксидаз печени и цитохрома P450. Гидроксилированный метаболит парацетамола N-ацетил-p-бензохинонимин, образующийся в небольших количествах в печени и почках (обычно детоксицируется путем связывания с глутатионом), способен накапливаться при передозировке парацетамола и вызывать повреждения тканей. В странах, где парацетамол применяется наиболее широко (например, в Великобритании, США, некоторых странах Европы), он занимает ведущее место среди причин смерти, связанной с передозировкой лекарственных средств [22–24]. Так, в Великобритании почти каждый второй случай передозировки лекарственных препаратов связан именно с приемом парацетамола. Ежегодно регистрируется 100–200 смертельных исходов от вызываемых им осложнений [25]. Следует подчеркнуть, что значение имеет не длительность приема, а разовая доза.
Особенно часто тяжелые нарушения со стороны печени развиваются при неоднократном использовании парацетамола в дозах, превышающих допустимые [26]. Риск поражения печени при применении парацетамола многократно возрастает при приеме алкоголя, недостатке глутатиона любого генеза, одновременном приеме ряда лекарственных средств, метаболизируемых с участием ферментов цитохрома P450 (карбамазепин, барбитураты и др.). В этих случаях для поражения печени может быть достаточно даже минимальных доз препарата. Кроме того, длительное применение может способствовать привыканию к парацетамолу, а его отмена – спровоцировать развитие абстинентного синдрома.
Нестероидные противовоспалительные препараты
В большинстве стран не анальгетики и не опиоиды, а НПВП – наиболее часто используемые средства для лечения боли. В Европе с этой целью НПВП применяются почти в 3 раза чаще, чем парацетамол, и более чем в 2 раза чаще, чем опиоидные анальгетики [27], а в России – чаще, чем все остальные препараты вместе взятые [28]. Действительно, именно НПВП обычно позволяют достигать основной цели лечения как острой, так и хронической боли.
При назначении терапии НПВП основной вопрос – выбор конкретного препарата. Если для лечения хронической боли существенной разницы в выраженности клинического эффекта между отдельными препаратами (в том числе в различной степени влияющими на циклооксигеназу-1 (ЦОГ-1) и 2 (ЦОГ-2) – ферменты, ингибирование которых лежит в основе действия НПВП), нет, то далеко не все НПВП зарегистрированы и рекомендованы для лечения острой боли и заболеваний, для которых она характерна (например, при подагре, зубной боли, боли в нижней части спины). Так, для лечения острой боли на первый план при выборе препарата, в частности НПВП, выходят особенности фармакокинетики и фармакодинамики, что позволяет оптимизировать скорость развития и длительность эффекта [29]. Совершенно очевидно, что при острой боли применение препаратов, пик действия которых достигается, например, через 5–6 часов после приема, нерационально, как и в случае, когда аналгетический эффект сохраняется в течение слишком короткого периода.
Известны данные метаанализа, включавшего плацебоконтролируемые исследования отдельных НПВП, применяемых при острой послеоперационной боли (диклофенак, аспирин, флурбипрофен, дифлунизал, фенопрофен, ибупрофен, пироксикам, напроксен, декскетопрофен, этодолак, лорноксикам, коксибы – эторикоксиб, рофекоксиб, люмиракоксиб, целекоксиб), анальгетиков (парацетамол, метамизол), а также опиоидов (кодеин, кодеин в комбинации с парацетамолом; оксикодон в комбинации с парацетамолом; декстропропоксифен (препарат, схожий с метадоном) с парацетамолом) в разных дозах (рис. 1)[30]. В качестве основного критерия оценки сравнительной эффективности рассчитывалось минимальное число больных, которых следовало пролечить для достижения цели терапии (снижение интенсивности боли на 50% после приема препарата как минимум на 4–6 часов) у одного больного. Наилучший терапевтический результат был получен у больных, принимавших эторикоксиб. Эффект препарата был сопоставим с действием комбинации оксикодона и парацетамола. На последнем месте оказался другой опиоид – кодеин, немного лучше был эффект парацетамола. Другая часть анализа отражала длительность эффекта – среднее время, которое требовалось для повторного применения препаратов. И здесь первые позиции заняли НПВП – эторикоксиб, при приеме которого 50%-ное снижение боли сохранялось в течение 20 часов, и кетопрофен.
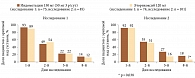
Последний метаанализ, включавший 7 плацебоконтролируемых исследований, показал, что применение эторикоксиба в дозе 120 мг/сут в 66% случаев уменьшало итенсивность боли более чем на 50% у 2/3 больных с острой болью. При этом частота нежелательных явлений при приеме препарата не отличалась от таковой при приеме плацебо [31]. Интересно, что при длительном приеме препаратов различия в эффективности могут нивелироваться, а различия в частоте развития побочных эффектов, напротив, нарастать. Показательны сравнительные исследования действия НПВП у больных подагрой, приступ которой характеризуется максимальной интенсивностью боли. Сравнивали два препарата – неселективный по отношению к ЦОГ-2 (индометацин, 150 мг/сут) и селективный (эторикоксиб, 120 мг/сут). Оказалось, что эторикоксиб намного чаще способствовал купированию боли в течение первых 4 часов после приема. И хотя впоследствии различия в эффективности сравниваемых препаратов нивелировались, частота побочных эффектов к 8-му дню терапии у больных, принимавших индометацин, была в 2 раза выше, чем в группе лечения эторикоксибом (рис. 2) [32]. Аналогичные результаты получены и в другом исследовании: по сравнению с индометацином эторикоксиб в первые часы после приема уменьшал боль у большинства больных подагрой, а число отмен эторикоксиба из-за побочных эффектов к концу недельного курса было меньше [33]. Отличные результаты были получены и при назначении эторикоксиба больным с острым приступом подагры в клинической практике. Причем препарат был эффективен и в случаях, когда предыдущая терапия другими препаратами оказалась неэффективной [34].
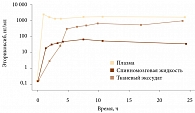
Столь мощное аналгетическое действие отдельных НПВП, возможно, связано с их способностью проникать в ликвор. Несколько лет назад было доказано, что после повреждения ткани происходит индукция ЦОГ-2, в том числе в задних рогах спинного мозга, и простагландины участвуют в сенсибилизации нервной системы, приводя к аллодинии и гипералгезии. Это в некоторой степени объясняет, почему в ряде случаев проводимое лечение неэффективно, и является отличной перспективной мишенью при назначении терапии. Оказалось, что возможность разных НПВП проникать в спинномозговую жидкость различается во много раз и именно эторикоксиб имеет наибольший потенциал такого проникновения, благодаря чему его концентрация в спинномозговой жидкости намного выше, чем у других препаратов (рис. 3) [35].
В заключение отметим, что выбор оптимальной медикаментозной терапии боли не может быть обусловлен только личными предпочтениями врача или пациента. Такой выбор должен основываться на знаниях (хотя бы минимальных) о различиях в механизмах действия, рисках возникновения побочных эффектов, дозах и сравнительной эффективности лекарственных средств.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.