Понимание и лечение боли в нижней части спины: принципы эффективного и безопасного обезболивания
- Аннотация
- Статья
- Ссылки
- English
На протяжении жизни боль в спине хотя бы однократно развивается у большинства людей (70–90% и более) [1–5], при этом частота возникновения боли в шее составляет 40–70%, в пояснице – до 84% [6, 7]. Боль в нижней части спины (люмбалгия) занимает одно из ведущих мест среди причин обращения за медицинской помощью лиц различного возраста [3, 8]. По данным большого эпидемиологического исследования, которое проводилось в 188 странах мира в период с 1990 по 2013 г., люмбалгия входит в первую десятку причин временной нетрудоспособности в каждой из этих стран [9].
Выделяют острую (до шести недель), подострую (6–12 недель) и хроническую (более 12 недель) боль. Боль в спине может существенно снизить качество жизни пациента, особенно если приобретет хроническое течение.
Согласно общепринятой классификации, выделяют [3, 10]:
- специфическую боль в спине – боль вследствие остеопороза, опухоли, формирования сирингомиелической полости, компрессионного перелома, инфекционного заболевания, аутоиммунного воспалительного процесса или миеломной болезни, патологии органов малого таза и др.;
- радикулопатию – компрессионно-ишемическое поражение спинномозгового корешка;
- неспецифическую боль – боль скелетно-мышечного происхождения.
Специфическая боль обусловливает от 1 до 3% болей в спине, радикулопатия – от 1 до 5%. Все остальные дорсалгии связаны с неспецифической болью. Именно боли скелетно-мышечного происхождения ответственны за не менее чем 85% случаев острой люмбалгии.
Неспецифическая (скелетно-мышечная) боль не связана с поражением корешков спинного мозга и специфическими заболеваниями позвоночника, а возникает вследствие патологии мышечно-суставно-связочного аппарата. Наиболее часто в ее основе лежит дисфункция крестцово-подвздошных сочленений, фасеточных суставов позвоночника, мышечно-тонический или миофасциальный болевой синдром.
Для выяснения причин боли у конкретного пациента врач проводит неврологический и невроортопедический осмотр: проверяет симметричность костных ориентиров, наличие сколиоза, гиперлордоза или кифоза. При пальпации и с помощью разных провокационных проб определяется болезненность в области крестцово-подвздошного сочленения и фасеточных суставов, а также выявляется локализация мышечно-тонического и/или миофасциального синдрома.
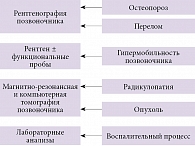
В последние 15 лет опубликовано несколько крупных руководств по лечению болей в спине различной локализации и различного происхождения [7, 11, 12]. В 2016 г. выпущены обновленные рекомендации Национального института здравоохранения и усовершенствования медицинского обслуживания Великобритании (National Institute for Health and Care Excellence – NICE) по ведению пациентов с неспецифической люмбалгией и радикулопатией [13]. Согласно указанным источникам, основная диагностическая задача врача при ведении пациентов с жалобами на боли в нижней части спины – исключение специфических причин болевого синдрома и радикулопатии. Инструментальное (рентгенография, рентгеновская компьютерная томография, магнитно-резонансная томография, электронейромиография и др.) и лабораторное обследование рекомендовано только при подозрении на специфическую природу боли в спине (рисунок) [7, 11–14].
Ведение пациентов со специфической болью в нижней части спины должно быть направлено прежде всего на терапию основного заболевания. Цель лечения неспецифической боли в нижней части спины и радикулопатии – скорейшее восстановление активности пациента. Эта цель достигается комплексом мер: эффективным обезболиванием, информированием пациента о благоприятном прогнозе и доброкачественном характере заболевания, разумной физической активностью и нелекарственными методами реабилитации.
Эффективное обезболивание преследует несколько целей: улучшение самочувствия и качества жизни, скорейшее восстановление двигательной активности и предотвращение хронизации болевого синдрома. Для обезболивания оптимальным признано использование нестероидных противовоспалительных препаратов (НПВП). Выбор препарата в каждом конкретном случае определяется главным образом спектром ожидаемых побочных эффектов лечения [7, 11–13].
Монотерапия парацетамолом в настоящее время не рекомендуется при боли в спине [13]. Опиоидные анальгетики с парацетамолом или без него используются при неэффективности или непереносимости НПВП [7, 11, 13]. НПВП необходимо назначать на максимально короткий срок и в минимально эффективной дозировке, причем предпочтение следует отдавать пероральным формам [13].
Механизм действия НПВП заключается в подавлении активности циклооксигеназы (ЦОГ) – фермента, участвующего в метаболизме арахидоновой кислоты, предшественника простагландинов, простациклинов и тромбоксанов. Существуют как минимум две изоформы ЦОГ: 1 и 2 [15]. ЦОГ-1 постоянно присутствует в большинстве тканей, участвуя в регуляции физиологических процессов. ЦОГ-2 в норме в тканях не присутствует, но образуется в воспалительном очаге. Терапевтический противовоспалительный эффект НПВП связан с ингибированием ЦОГ-2, а развитие побочных эффектов – с подавлением ЦОГ-1 [16]. Наиболее селективны в отношении ЦОГ-2 препараты из группы коксибов. Они сохраняют специфичность в любых дозировках. Менее селективные ЦОГ-2-ингибиторы – мелоксикам и нимесулид показывают высокое сродство к ЦОГ-2 в низких дозах, а при повышении дозы утрачивают специфичность. Наконец, существуют неселективные ингибиторы ЦОГ, которые воздействуют на ЦОГ-2 и ЦОГ-1.
Наиболее частыми нежелательными эффектами НПВП считаются желудочно-кишечные осложнения, такие как диспепсия, эрозии и язвы желудка и двенадцатиперстной кишки, желудочно-кишечное кровотечение. Риск этих нежелательных явлений увеличивается с возрастом [15, 17]. Только желудочно-кишечные осложнения вследствие применения НПВП приводят к смерти большее число людей, чем рак шейки матки, бронхиальная астма или меланома [18]. Более селективные ЦОГ-2-ингибиторы в три-четыре раза реже вызывают осложнения со стороны желудочно-кишечного тракта, чем менее селективные [19–21]. Однако при повышении дозы и увеличении длительности приема, а также при комбинации с другими НПВП риск гастропатии возрастает и у этих относительно безопасных препаратов [16].
С целью предотвращения развития эрозивно-язвенных процессов пациентам с повышенным риском развития НПВП-гастропатии рекомендовано профилактическое назначение блокаторов протонной помпы параллельно с курсом НПВП [13, 16].
Еще одна группа нежелательных явлений при приеме НПВП – сердечно-сосудистые осложнения: повышение артериального давления, тромбоэмболические осложнения, отеки. Известно, что все НПВП подавляют биосинтез простаноидов. Было высказано предположение о том, что при селективном подавлении синтеза простациклина без сопутствующего ингибирования синтеза тромбоксана может возрасти риск указанных сердечно-сосудистых побочных эффектов. Простациклин связан с ЦОГ-2 и оказывает сосудорасширяющее и антитромбоцитарное действие, ингибирует пролиферацию гладкомышечных клеток сосудов. Тромбоксан связан с ЦОГ-1 и, напротив, будучи сосудосуживающим фактором, способствует агрегации тромбоцитов и пролиферации сосудов [16, 22, 23]. Таким образом, пациентам с высоким риском сердечно-сосудистых осложнений лучше назначать менее селективные НПВП. По данным исследований, некоторые НПВП (напроксен, ибупрофен) могут подавлять антитромбоцитарный эффект аспирина. В то же время препараты, умеренно или высоко селективные к ЦОГ-2 (мелоксикам, коксибы), не оказывают подобного воздействия [24, 25]. Можно сказать, что умеренно селективные НПВП имеют сбалансированный риск желудочно-кишечных и сердечно-сосудистых осложнений [16].
НПВП могут снижать эффективность диуретиков и других антигипертензивных препаратов. У некоторых пациентов с нарушением функции почек одновременное применение ингибитора ангиотензинпревращающего фермента или антагониста ангиотензина II и препаратов, ингибирующих ЦОГ, может приводить к дальнейшему нарастанию почечной недостаточности. При приеме различных НПВП также описаны гепатотоксические побочные эффекты [26].
В клинической практике хорошо зарекомендовал себя представитель класса НПВП нимесулид (Нимесил®). Нимесулид – первый избирательно селективный (умеренно селективный) НПВП, который широко применяется с 1985 г. К настоящему времени нимесулид зарегистрирован в более чем 50 странах мира [27]. В России он входит в число препаратов, которые чаще остальных выписываются для купирования болевого синдрома различной локализации [28].
После приема внутрь препарат хорошо всасывается из желудочно-кишечного тракта, достигая максимальной концентрации в плазме крови через два-три часа, период полувыведения составляет от 3,2 до шести часов. Нимесулид связывается с белками плазмы на 97,5% и легко проникает через гистогематические барьеры, поэтому может накапливаться в очагах воспаления, имеющих кислую реакцию среды, в концентрации, превышающей концентрацию в плазме крови [15, 29]. Фармакокинетический профиль нимесулида у лиц пожилого возраста не изменяется при назначении однократных и многократных/повторных доз. Важно, что нимесулид имеет слабощелочную реакцию, из-за чего он хуже проникает в слизистую оболочку верхних отделов пищеварительной системы, что в итоге снижет риск контактного повреждения [15, 29]. По результатам многоцентрового контролируемого исследования, риск кровотечения из верхних отделов желудочно-кишечного тракта оказался минимальным на фоне использования нимесулида, ибупрофена и ацеклофенака по сравнению с другими НПВП [30]. Преимущество нимесулида было также показано в эпидемиологическом исследовании, проанализировавшем 10 608 сообщений о серьезных нежелательных явлениях при применении НПВП в период с 1988 по 2000 г. в одном из регионов Италии. Нимесулид оказался самым назначаемым НПВП. Кроме того, количество желудочно-кишечных осложнений на фоне приема нимесулида было приблизительно в два раза меньше (10,4%), чем при назначении диклофенака (21,2%), кетопрофена (21,7%) и пироксикама (18,6%). Кроме того, диклофенак и пироксикам продемонстрировали у пожилых пациентов большую токсичность по сравнению с нимесулидом и кетопрофеном [31].
Высокую степень безопасности нимесулида иллюстрируют исследования, посвященные длительному применению препарата при остеоартрозе. В 12-месячном отечественном исследовании сравнивались эффективность и безопасность нимесулида (Нимесила) и парацетамола у пациентов с остеоартрозом. В исследование было включено 40 женщин с остеоартрозом коленных суставов и интенсивностью боли не менее 40 мм по Визуальной аналоговой шкале. После года наблюдения отмечалась более высокая эффективность нимесулида (Нимесила) по сравнению с парацетамолом [28].
K.D. Rainsford в систематическом обзоре отметил высокую анальгетическую, противовоспалительную и антипиретическую активность нимесулида, а также относительно низкую частоту желудочно-кишечных осложнений на фоне его использования. По сравнению с коксибами нимесулид реже оказывал отрицательное влияние на сердечно-сосудистую систему [27]. Нимесулид (Нимесил®) подавляет секрецию гистамина, что делает возможным его использование у пациентов со склонностью к развитию аспириновой астмы.
Немаловажен экономический аспект назначения НПВП. Нимесил® выпускается по девять и 30 пакетиков в упаковке. При этом упаковка с 30 пакетами может быть более выгодной для пациентов с ревматологическими заболеваниями, требующими длительной терапии. Самая маленькая пачка, содержащая девять пакетиков, может быть достаточной для купирования острого болевого синдрома, например при обострении неспецифической люмбалгии, что соответствует принципу назначения НПВП на минимальный срок. Препарат в таком количестве также может использоваться в составе ступенчатой терапии: НПВП парентерально в течение одних-двух суток с последующим переходом на пероральный прием (например, в сочетании с декскетопрофеном).
Другими часто назначаемыми НПВП являются препараты кетопрофена. Кетопрофен применяют в клинической практике уже более 30 лет, и его эффективность была неоднократно доказана при различных болевых синдромах [32]. Кетопрофен представляет собой смесь двух стереоизомеров. Один из них (правовращающий) обладает сильно выраженным антиноцицептивным эффектом, а у другого (левовращающего) этот эффект выражен слабо. При этом второй значительно увеличивает частоту развития побочных явлений. Для обеспечения высокой терапевтической эффективности и повышения безопасности из рацемической смеси был выделен правовращающий (S(+)) изомер. Его водорастворимая трометамоловая соль составляет основу оригинального препарата Дексалгин®. Степень очистки препарата от левовращающего изомера составляет 99,9% [4, 32]. Использование активного изомера, короткий период полувыведения и быстрая элиминация декскетопрофена снижают риск развития серьезных побочных явлений [4, 32].
В ряде исследований была показана хорошая эффективность и переносимость декскетопрофена при лечении острых и хронических болей в поясничной области [33, 34]. В сравнительном исследовании эффективности декскетопрофена и диклофенака у 185 пациентов с хронической болью в нижней части спины декскетопрофен продемонстрировал явное превосходство в отношении не только интенсивности боли, но и степени инвалидизации по шкале Освестри с первой недели терапии и до конца наблюдения [33].
В систематическом обзоре 35 исследований по применению декскетопрофена при острых или хронических болях различной этиологии, включавших в общей сложности 6380 пациентов, отмечена сходная эффективность декскетопрофена с другими НПВП и комбинацией опиоида и парацетамола [35].
В нескольких исследованиях декскетопрофен назначался пациентам для уменьшения послеоперационной боли различной локализации, в том числе при микродискэктомии и в абдоминальной хирургии. С целью купирования болевого синдрома все пациенты могли принимать трамадол «по требованию». При добавлении декскетопрофена трамадол обеспечивал эффективное обезболивание в меньшей дозе [36–38].
Дексалгин в инъекционной форме (для внутримышечного и внутривенного введения) заслуженно вошел в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2018 г. [39]. Следует отметить возможность смешивания декскетопрофена в одном шприце с раствором гепарина, морфина, теофиллина или лидокаина. Смешивание с лидокаином может повысить эффективность и сократить дозу препарата при введении в триггерные точки при миофасциальном болевом синдроме, тем самым снизив вероятность нежелательных явлений [17].
В одном сравнительном исследовании (n = 60) наблюдалось достоверное повышение эффективности терапии при назначении Нимесила (в дозе 200 мг/сут в течение 14 дней) после короткого курса Дексалгина (в дозе 75 мг/сут в течение пяти дней) по сравнению с монотерапией Дексалгином. Авторы предлагают подобную схему назначения НПВП для купирования затянувшегося обострения. Назначение умеренно селективного НПВП в данной ситуации преследует цель уменьшить вероятность нежелательных явлений со стороны желудочно-кишечного тракта [40].
При недостаточном эффекте НПВП или его отсутствии при неспецифической боли, связанной с дисфункцией фасеточных суставов или крестцово-подвздошного сочленения, может проводиться радиочастотная денервация [13]. Помимо НПВП при признаках невропатической боли, связанной с радикулопатией, показано дополнительное назначение противосудорожных препаратов (прегабалина, габапентина), антидепрессантов (амитриптилина, дулоксетина), а также выполнение эпидуральных инъекций с глюкокортикостероидами [12, 13, 41].
Крайне важными и первоочередными составляющими лечения пациента с болью в нижней части спины являются немедикаментозные методы. При расспросе часто выясняется, что пациент имеет неправильные представления о причинах, механизмах и примерном прогнозе своего состояния. Информационный поток, окружающий человека с болью, чаще имеет негативную окраску, а негативная информация, преувеличивающая опасность симптомов, может способствовать ухудшению самочувствия пациента и хронизации боли [16]. Нередко пациент воспринимает назначение НПВП в качестве компенсации его «слабости», считает, что врачи выписывают обезболивающие препараты только для того, чтобы он не терпел боль. При избыточной настороженности больного по отношению к побочным эффектам лечения снижается приверженность лечению. Прием препарата в дозе ниже терапевтической может замедлить выздоровление. При проведении необоснованных обследований пациент акцентируется на обнаруженных дегенеративно-дистрофических изменениях («протрузии», «грыжи Шморля», «остеофиты»), воспринимает их в качестве причины боли и проводит параллели между степенью выявленных изменений и интенсивностью болевого синдрома [3].
Приведенные примеры свидетельствуют о важности беседы врача с пациентом, которая должна выходить за рамки выяснения жалоб и назначения лекарств. При острой неспецифической люмбалгии в первую очередь необходимо информировать пациента о доброкачественном характере заболевания и благоприятном прогнозе. Нужно обоснованно мотивировать его сохранять умеренную двигательную активность и избегать избыточных физических нагрузок для скорейшего выздоровления. При нежелании пациента «лечиться анальгетиками» следует подчеркнуть важный противовоспалительный эффект лекарственного средства в очаге поражения (воспаленном суставе, растянутой связке и др.), а также необходимость обезболивания с целью увеличения подвижности и объема движений, что будет способствовать ускорению выздоровления. При хронизации болевого синдрома в нижней части спины нужно постараться оценить двигательный режим пациента (рабочее место, двигательные стереотипы и др.) и на основании этого рекомендовать увеличение физической активности и добавление лечебной гимнастики [7].
При хронической боли в спине когнитивно-поведенческая терапия может стать основным методом лечения. Аргументом в пользу когнитивно-поведенческой терапии выступает теория о том, что у пациента с хронической болью в спине инвалидизация вызвана не только механическими изменениями, но и психологическими и социальными факторами (убеждениями пациента, психологическими расстройствами, «болевым» поведением). Основа когнитивно-поведенческой терапии состоит в выявлении и помощи в осознании пациентом неадаптивных (ложных) мыслей и способов поведения, замена их на адаптивные (верные) стратегии управления болью [7, 42–44].
Таким образом, лечение пациента с болью в нижней части спины должно быть комплексным и индивидуальным в зависимости от генеза болевого синдрома. Больному необходимо назначать эффективные и безопасные препараты, которые влияют на интенсивность болевого синдрома, ускоряют выздоровление, при этом не ухудшают течение сопутствующих заболеваний. Кроме лекарственной терапии необходимо включение на разных этапах немедикаментозных компонентов: информирования, когнитивно-поведенческой терапии, лечебной гимнастики. Желательно проводить лечение в специализированном центре или отделении, в рамках амбулаторной помощи (возможно после непродолжительного стационарного этапа). Среди НПВП следует отметить нимесулид и декскетопрофен, которые хорошо справляются с задачами эффективного обезболивания при боли в спине, имеют несколько форм выпуска, позволяющих применять их в различных ситуациях.
N.V. Vakhnina, Ye.Yu. Kalimeyeva
I.M. Sechenov First Moscow State Medical University (Sechenovskiy University)
Contact person: Natalya Vasilyevna Vakhnina, nvakhnina71@mail.ru
Low back pain (lumbar pain) is a prevalent condition in outpatients practice. This article covers main reasons, approaches to diagnosis and treatment of patients with low back pain. It is noted that safe and effective anesthesia for patients has a great effect if applied in combination with education and behavioral therapy as a complex management. The article shows the place of non-steroidal anti-inflammatory drugs in non-specific pain therapy usage, provides data on efficiency and safety of these medications.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.