Диабетическая полиневропатия: особенности этиопатогенеза, диагностики и патогенетической терапии
- Аннотация
- Статья
- Ссылки
- English

Диабетическая полиневропатия (ДПН) входит в состав классической триады поздних осложнений сахарного диабета (СД) наряду с диабетическими ретинопатией и нефропатией. СД является основной причиной полиневропатии – 30% всех случаев [1].
ДПН представляет собой одну из острейших медико-социальных проблем современного общества, поскольку существенно снижает качество жизни пациентов и приводит к глубокой инвалидизации и летальным исходам. ДПН считается одним из основных факторов риска и патоморфологических причин развития язвенных дефектов стоп. Так, по данным разных авторов, от 40 до 70% всех нетравматических ампутаций приходится на пациентов с СД [2].
Симптомы полиневропатии наблюдаются у 50% пациентов с СД, а электронейромиографические признаки поражения периферических нервных стволов – у 90% [2, 3].
Безусловно, ведение пациентов с проявлениями ДПН представляет междисциплинарную проблему, в решении которой должны участвовать неврологи, эндокринологи, терапевты, дерматологи, хирурги, педиатры и реабилитологи.
У пациентов с СД на фоне ДПН отмечается субклиническое или имеющее клинические признаки поражение периферической нервной системы [4]. При ДПН имеет место прогрессирующая гибель волокон периферических нервов, что проявляется нарушением чувствительности, снижением мышечной силы дистальных отделов нижних конечностей, формированием язв стоп, нарушением сна, снижением трудоспособности и качества жизни, а также увеличением смертности у больных СД [5].
Для верификации ДПН необходимо исключить иные возможные причины развития полиневропатии.
Среди основных факторов риска развития полиневропатии у пациентов с СД выделяют возраст, повышенный уровень триглицеридов в крови, артериальную гипертензию, курение [6, 7]. В последнее время появились данные о генетической предрасположенности к развитию ДПН, а именно генетически детерминированной повышенной активности супероксиддисмутазы и альдозоредуктазы [6, 7].
К основным факторам риска развития ДПН относится продолжительность течения СД. В 40–65% случаев ДПН развивается через 15–25 лет после начала СД, хотя у 5% пациентов с СД симптомы полиневропатии наблюдаются в дебюте заболевания [4].
Среди множества теорий развития ДПН следует в первую очередь выделить метаболическую, сосудистую, наследственную и дизиммунную. Но, безусловно, наиболее важным установленным патогенетическим механизмом развития ДПН считается воздействие гипергликемии на нервные стволы [8, 9].
По мнению М.А. Pfieffer и М.Р. Schumer, патогенетические механизмы развития ДПН условно можно разделить на функциональные и анатомические [10]. Функциональные изменения развиваются на ранних стадиях ДПН и представляют собой полностью или частично обратимые нарушения на фоне постоянного контроля уровня глюкозы в крови [7, 11].
Согласно метаболической теории патогенеза невропатии, ведущим фактором поражения нервной ткани при СД является гипергликемия, которая приводит к значительным патологическим изменениям в метаболизме нервных клеток.
Гипергликемия вызывает нейрональное повреждение вследствие внутриклеточного повышения уровня глюкозы с избыточным метаболизмом: повышение степени действия альдозоредуктазы и соответственно активацию полиолового пути утилизации глюкозы, а также избыточное накопление сорбитола, фруктозы и других токсических продуктов, повышение внутриклеточного осмотического давления и отек нейронов. Кроме того, гипергликемия с накоплением токсических метаболитов и конечных продуктов гликирования активирует синтез свободных радикалов и соответственно развитие окислительного стресса, который рассматривается как ведущая причина поздних осложнений СД, в том числе генерализованного поражения периферических нервов [12].
Снижение уровня факторов роста нервных стволов, наблюдаемое при ДПН, значительно ухудшает регенераторные возможности аксонов, что в свою очередь способствует прогрессированию аксональной дегенерации и сегментарной демиелинизации.
Сосудистая теория развития ДПН также рассматривается как одна из ведущих в патогенезе ДПН. В рамках данной теории прежде всего выделяют микроангиопатию, которая развивается вследствие гликирования эндотелиальных клеток. В результате поражается vasa nervorum и возникают нарушения эндоневральной циркуляции с последующим формированием перикапиллярного отека [8].
Кроме того, эндоневральная гипоксия, метаболические изменения и нарушение выработки вазоактивных агентов способствуют развитию ишемии нервного ствола. Как следствие, в стволах периферических нервов происходят дегенеративные и апоптотические изменения [13].
Как уже отмечалось, в последнее время значение придается наследственной и дизиммунной теориям развития ДПН [14, 15].
Чтобы выбор средств патогенетической терапии ДПН был адекватным, важно понимать патогенетические особенности возникновения боли, которая в данном случае обусловлена прямым поражением Аδ- и С-волокон, а также взаимодействием ноцицептивных и антиноцицептивных путей на различных уровнях нервной системы. Механизмы развития боли в такой ситуации включают спонтанную эктопическую активность поврежденных аксонов, сенситизацию болевых рецепторов, взаимодействие периферических сенсорных волокон и извращенную чувствительность к медиаторам. Существенную роль в формировании невропатической боли играют центральная сенситизация и недостаточность ингибирующих нисходящих влияний на задние рога спинного мозга, что рассматривается в качестве решающего фактора в формировании невропатической боли, в частности в развитии аллодинии и гиперпатии.
Выделяют следующие клинические формы ДПН: хроническую сенсомоторную полиневропатию (дистальная симметричная полинейропатия), острую сенсорную болевую невропатию, транзиторную гипергликемическую невропатию и другие формы, на долю которых приходится менее 5% [12].
Чаще встречается хроническая сенсомоторная полиневропатия, дебют которой в большинстве случаев отмечается в субклинической стадии в отсутствие симптомов. Данная форма ДПН нередко бывает единственным проявлением СД.
Неврологические нарушения и симптомы у пациентов с хронической сенсомоторной полиневропатией часто обнаруживаются случайно при скрининговом обследовании. Такая симптоматика носит непостоянный и умеренный характер, и ее проявления усиливаются к вечеру. К симптомам данной формы ДПН относят прежде всего онемение, или ощущение «немых ног» (со слов пациента), а также неустойчивость при стоянии и ходьбе, что является следствием нарушения проприоцепции. В свою очередь утрата проприоцепции способствует нарушению походки, последующему развитию стопы Шарко и падениям, риск которых при ДПН увеличивается в 15 раз [12].
Возникающая специфическая деформация стопы с ее высоким сводом и молоткообразной деформацией пальцев способствует развитию синдрома диабетической стопы.
Острая сенсорная болевая невропатия развивается на фоне декомпенсации СД или кетоацидоза. Данная форма ДПН отличается острой, усиливающейся в вечернее и ночное время нейропатической болью, гиперестезией и аллодинией. В отличие от хронической сенсомоторной полиневропатии при острой сенсорной невропатии нарушения чувствительности выражены весьма умеренно или не выражены вовсе.
Отличается также характер развития и течения этих двух наиболее распространенных форм ДПН. Для острой болевой невропатии характерно острое или подострое начало и достаточно быстрый регресс или даже купирование симптомов в течение года.
Роль тщательного клинического обследования при диагностике ДПН переоценить сложно. Как уже отмечалось, заболевание зачастую протекает бессимптомно и отсутствие симптоматики далеко не всегда означает отсутствие заболевания. Тщательное клиническое обследование предполагает использование скрининг-тестов, в частности исследования тактильной чувствительности с помощью монофиламента (Semmes – Weinstein), вибрационной чувствительности – с помощью градуированного камертона, температурной чувствительности – с помощью тестера термочувствительности кожи «Тип-терм». Целесообразно также применение различных шкал и опросников.
Для проведения точной диагностики используются различные электрофизиологические методы (электронейромиография (ЭНМГ), ультразвуковая допплерография, реовазография, тепловизионное исследование) [12].
Выделяют несколько форм болевой ДПН:
- острую болевую полневропатию Элленберга: болевые ощущения локализованы в дистальных отделах нижних конечностей и распределены симметрично;
- острую болевую полиневропатию тонких волокон вследствие нормализации углеводного обмена: болевые ощущения также локализованы в дистальных отделах нижних конечностей и распределены симметрично;
- проксимальную диабетическую невропатию (амиотрофию): болевые ощущения локализованы в области бедер и распределены асимметрично;
- торакоабдоминальную невропатию: болевые ощущения локализованы в области грудной клетки и живота и распределены асимметрично или носят опоясывающий характер;
- карпальный синдром (туннельные мононевропатии верхних конечностей): болевые ощущения локализованы в области кистей и распределены симметрично;
- хронический болевой синдром: болевые ощущения локализованы в дистальных отделах нижних конечностей и распределены симметрично.
Кроме того, выделяют кардиоваскулярный, гастроинтестинальный и урогенитальный варианты диабетической вегетативной невропатии.
Успех терапии пациентов с ДПН во многом обусловлен своевременным началом лечения, поскольку в ряде случаев заболевание быстро и неуклонно прогрессирует.
К основным методам терапии ДПН относятся коррекция модифицируемых факторов риска, патогенетическая и симптоматическая терапия.
Контроль течения СД (инсулинотерапия, использование помп, современные противодиабетические лекарственные средства) способствует достижению у большинства пациентов целевых значений уровня глюкозы в крови как натощак, так и после еды. При ведении пациентов с СД на первый план выходят поздние осложнения данного заболевания, в том числе ДПН [5].
Учитывая сказанное, необходимо отметить исключительную важность и актуальность применения патогенетической терапии ДПН.
Среди средств патогенетической терапии одним из наиболее востребованных препаратов является Берлитион (альфа-липоевая (тиоктовая) кислота). Дело в том, что нарушение метаболизма при СД характеризуется повышенным уровнем образования свободных радикалов при угнетении естественных антиоксидантных систем. В то же время Берлитион относится к препаратам, антиоксидантные свойства которых доказаны в ряде рандомизированных контролируемых исследований, а также при выполнении метаанализа (уровень доказательности А) [7, 16, 17].
Альфа-липоевая кислота представляет собой естественный коэнзим митохондриального мультиэнзимного комплекса, который катализирует окислительное декарбоксилирование альфа-кетокислот [18].
Альфа-липоевая кислота в организме восстанавливается до дигидролипоевой кислоты, которая и обеспечивает основные терапевтические эффекты Берлитиона.
Так, дигидролипоевая кислота служит своеобразной ловушкой для супероксида – основного свободного радикала. В свою очередь на фоне инактивации свободных радикалов уменьшается выраженность окислительного стресса.
Кроме того, Берлитион тормозит ингибирование NO-синтетазы и препятствует ухудшению кровотока по vasa nervorum, а следовательно, предупреждает ишемическое повреждение нервных волокон [12].
Альфа-липоевая кислота улучшает эндотелий-зависимые реакции сосудистой стенки, уменьшает активацию фактора транскрипции NF-kB, улучшает фильтрационную функцию почек и утилизацию глюкозы [19–21].
Таким образом, Берлитион (альфа-липоевую кислоту) можно рассматривать как препарат выбора патогенетической терапии ДПН.
Целью исследования стала оценка эффективности альфа-липоевой кислоты в целях терапии и реабилитации пациентов с ДПН. Проанализированы безопасность и эффективность пероральных и инъекционных форм Берлитиона (альфа-липоевой кислоты) в отношении влияния на боль при ДПН.
Материал и методы
В исследовании участвовали 47 пациентов с верифицированным диагнозом диабетической полиневропатии.
Критериями включения в исследование служили:
- подтвержденный диагноз СД 2-го типа;
- невропатическая боль (> 4 баллов по шкале оценки невропатической боли DN4) в нижних конечностях слабой или умеренной интенсивности (до 3 баллов включительно по цифровой рейтинговой шкале);
- изменения по данным ЭНМГ (снижение скорости распространения возбуждения (СРВ) по нервам нижних конечностей до 35 м/с и менее, увеличение дистальной латентности, полифазия и нарастание длительности М-ответов, повышение латентности и полифазия F-волн).
Критерии исключения:
- коморбидная патология, которая клинически могла проявляться осложнениями в виде полиневропатии с болевым синдромом (дефицит витамина В12, парапротеинемия, алкоголизм, заболевание почек, гипотиреоз, облитерирующее поражение периферических артерий);
- применение анальгетиков или препаратов, прием которых ассоциировался с поражением периферической нервной системы (нестероидные противовоспалительные препараты, антиконвульсанты, антидепрессанты, амиодарон, иммуносупрессоры, статины, метронидазол, химиотерапия).
Алгоритм дифференциальной диагностики обследуемых пациентов включал рутинное общесоматическое обследование: общие анализы крови и мочи, биохимический анализ крови, гликемический профиль, содержание гликированного гемоглобина, электрокардиограмму, рентгенографию органов грудной клетки, ультразвуковое исследование щитовидной железы, органов брюшной полости и почек, электрофорез белков сыворотки крови, ревматические пробы, а также по показаниям – магнитно-резонансную томографию головного и спинного мозга и сцинтиграфию костей скелета.
Результаты неврологического обследования валидизировались с помощью опросников и шкал: цифровой рейтинговой шкалы (ЦРШ), шкалы оценки невропатической боли (DN4), шкалы неврологических симптомов (NSS).
Кроме того, всем пациентам по стандартному протоколу проводили ЭНМГ, включавшую нейрографию моторных и сенсорных волокон nn. tibialis, suralis с двух сторон. При наличии соответствующих показаний исследовались и другие нервы (nn. peroneus, femoralis, facialis), проводились игольчатая электромиография и транскраниальная магнитная стимуляция.
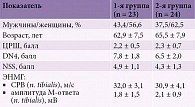
На основании результатов обследования все пациенты были разделены на две группы, сопоставимые по половозрастным характеристикам и выраженности клинических проявлений (интенсивность боли).
Первую группу составили 23 пациента, вторую – 24 пациента. Больным первой группы назначали внутривенные капельные инфузии Берлитиона 600 мг на 200 мл физиологического раствора ежедневно в течение 14 дней, после чего препарат применяли перорально в утренние часы за полчаса до еды в суточной дозе 600 мг на один прием в течение 16 дней. Пациенты второй группы в течение 30 дней получали Берлитион перорально в дозе 600 мг по аналогичной схеме.
Результаты оценивались в трех контрольных точках – на 15-е, 21-е и 30-е сутки от начала лечения путем проведения повторных клинических тестирований и ЭНМГ.
При статистическом анализе данных использовали программу STATISTICA 10.0. Достоверными считались различия при p < 0,05.
Результаты
В ходе обследования была установлена валидность групп сравнения по показателям пола, возраста, интенсивности боли (табл. 1).
Обращает на себя внимание тот факт, что у всех обследуемых определялась незначительная или умеренная выраженность клинических нарушений по шкале NSS. В неврологическом статусе двигательные и рефлекторные расстройства определялись крайне редко (исключительно в виде снижения ахилловых рефлексов) – лишь у двух (8,6%) пациентов первой группы и трех (12,5%) пациентов второй группы.
Нарушения в рефлекторной сфере не коррелировали с выраженностью изменений, выявленных при проведении ЭНМГ. При этом результаты, полученные при использовании данного метода обследования, свидетельствовали о более значимом снижении значений СРВ по сравнению с амплитудой дистального М-ответа, то есть превалировал демиелинизирующий характер повреждения нервных волокон над аксональным.
Отмечалась хорошая переносимость Берлитиона. Нежелательных реакций не зафиксировано, необходимость в отмене данного препарата отсутствовала. В то же время через две недели от начала лечения статистически значимая положительная динамика не зарегистрирована ни по одному анализируемому показателю.
При контрольном обследовании на 21-й день терапии определялись статистически значимые отличия по показателям интенсивности боли (ЦРШ) у пациентов первой группы (p < 0,05).
Кроме того, в обеих группах прослеживалась тенденция к улучшению параметров ЭНМГ в виде некоторого нарастания СРВ и амплитуды М-ответа, но эти изменения не достигали уровня статистически значимых. Статистически значимые изменения по шкале NSS через три недели терапии не выявлены.
К 30-му дню лечения статистически значимые изменения показателей интенсивности боли по сравнению с первоначальными значениями, но без достоверных межгрупповых различий зафиксированы в обеих группах (табл. 2).
Обращает на себя внимание индивидуальный характер выраженности ответов участников исследования на проводимое лечение. К 30-му дню терапии у пяти (21,7%) пациентов первой и четырех (16,7%) пациентов второй группы болевые ощущения не фиксировались вовсе. Однако эти изменения коррелировали исключительно с достоверной положительной динамикой показателей NSS. У обследуемых обеих групп с менее значимыми изменениями интенсивности боли либо не выявлялись подобные связи, либо определялись слабые связи только с изменениями показателей NSS. Статистически значимая динамика параметров ЭНМГ отмечалась у пациентов с регрессированием негативных чувствительных расстройств (гипестезия).
Обсуждение
Слабо выраженный болевой синдром при ДПН наблюдается при умеренной сопутствующей клинической симптоматике, как правило в чувствительной сфере. В основе подобного нарушения лежит смешанное поражение в основном по типу миелинопатии, хотя при ДПН, согласно ЭНМГ, могут выявляться признаки, соответствующие как аксонопатии (снижение амплитуды М-ответа), так и демиелинизации (легкое или умеренное снижение скорости проведения по нервам, увеличение дистальной латенции, изменение F-волн) [22]. Возможно снижение скорости проведения импульса по моторным и сенсорным нервам уже на ранней стадии развития невропатии, но затем в течение длительного периода скорость проведения остается стабильной, а признаки аксонопатии неуклонно нарастают. Необходимо также учитывать, что умеренное снижение скорости проведения импульса по двигательным волокнам может отражать не столько демиелинизацию, сколько значительную утрату крупных аксонов [22].
Согласно результатам исследования, в пользу демиелинизации говорит отсутствие корреляции между результатами ЭНМГ (СРВ по моторным проводникам) и клиническими изменениями в двигательной сфере. В то же время при аксонопатии двигательные нарушения были бы выражены значительно ярче.
Результаты исследования свидетельствуют также об отсутствии корреляции между динамикой интенсивности боли и изменениями параметров ЭНМГ.
Берлитион продемонстрировал эффективность у пациентов с ДПН. Эффективность ступенчатой терапии и эффективность пероральной формы Берлитиона сопоставимы, но в первом случае эффект наступает на неделю раньше.
В целях повышения эффективности патогенетической терапии Берлитионом необходимо его длительное применение (более месяца), что согласуется с результатами ряда других исследований. Так, показана эффективность Берлитиона в дозе от 600 до 1800 мг/сут при его использовании в течение 4–6 месяцев [7, 23]. Тем не менее результаты первого в истории исследования эффективности парентеральной формы альфа-липоевой кислоты (ALADIN), выполненного с соблюдением требований доказательной медицины, показали статистически значимый эффект уже через три недели от начала ее применения [24].
В другом известном исследовании Oral Pilot (ORPIL) Study, посвященном анализу эффективности пероральной формы альфа-липоевой кислоты, также зафиксирована статистически значимая эффективность Берлитиона уже через три недели после начала терапии [25].
Исследователи единодушно сходятся во мнении, что Берлитион эффективен у пациентов с ДПН. Что касается оптимальных сроков использования и наиболее эффективных доз Берлитиона, точки зрения несколько расходятся. В связи с этим дальнейшие исследования альфа-липоевой кислоты у пациентов с СД представляются интересными и весьма полезными с практической точки зрения.
Заключение
Патогенетическая терапия ДПН является важнейшим фактором, определяющим эффективность комплексного лечения пациентов, страдающих данным заболеванием. Препаратом выбора патогенетической терапии при данной патологии остается Берлитион (альфа-липоевая кислота), характеризующийся наиболее доказанной эффективностью и безопасностью. На основании результатов представленного и ряда других исследований Берлитион можно рекомендовать для широкого использования как в стационарной, так и в амбулаторной практике.
D.A. Iskra, PhD, Prof., V.V. Kovalchuk, PhD, Prof., E.R. Barantsevich, PhD, Prof.
Saint Petersburg State Pediatric Medical University
City Hospital № 38 named after N.A. Semashko, Saint Petersburg
Academician I.P. Pavlov First Saint Petersburg State Medical University
Contact person: Vitaly V. Kovalchuk, vikoval67@mail.ru
The article analyzes the features of etiology, risk factors, pathomorphological causes, pathogenesis mechanisms, main forms and clinical manifestations of diabetic polyneuropathy. Presented the results of the study of the comparative efficacy and safety of oral and injectable forms of Berlithion (alpha-lipoic acid) in patients with diabetic polyneuropathy. The results of therapy were evaluated using a digital rating scale, the DN4 neuropathic pain rating scale, and the NSS neurological symptom scale. In addition, all patients underwent electroneuromyography according to the standard protocol. Shown that the effectiveness of step therapy and the effectiveness of the oral form of Berlithion are comparable, but in the first case, the effect occurs a week earlier. The effectiveness of pathogenetic therapy with Berlithione is enhanced by its long-term use (over a month).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.