Диабетические полиневропатия и энцефалопатия: алгоритм ведения пациентов
- Аннотация
- Статья
- Ссылки
- English


Сахарный диабет (СД) – это группа метаболических заболеваний, характеризующихся хронической гипергликемией, являющейся результатом нарушения секреции инсулина, действия инсулина или обоих факторов. Хроническая гипергликемия при СД сопровождается повреждением, дисфункцией и недостаточностью различных органов, особенно глаз, почек, нервов, сердца и кровеносных сосудов. Число пациентов с СД увеличивается с каждым годом, и СД приобретает характер эпидемии неэпидемиологического заболевания.
В масштабном российском эпидемиологическом исследовании NATION диагноз СД был установлен в 5,4% случаев. При этом 54% пациентов с СД 2-го типа даже не знали о заболевании. Предиабет выявлен у 19,3% взрослого населения Российской Федерации [1].
Диабетическая полиневропатия (ДПН) представляет собой поражение периферических соматических и автономных нервов у пациентов с СД при исключении других причин полиневропатии [2]. ДПН – самое частое осложнение СД, требующее, согласно российскому исследованию ФОРСАЙТ-СД2, максимальных затрат [3]. Частота ДПН варьируется в широких пределах, что обусловлено применением в исследованиях различных методик. У большого количества пациентов ДПН остается недодиагностированной. Так, среди пациентов с СД 2-го типа о своем заболевании не знали 87%, с СД 1-го типа – 56% пациентов [3].
ДПН включает в себя несколько клинических форм [4], среди которых чаще встречаются хронические дистальная симметричная сенсорная/сенсорно-моторная и автономная ДПН. Классическая ДПН характеризуется чувствительными нарушениями в дистальных отделах ног в виде онемения, зябкости, чувства стянутости, реже – двигательных симптомов, таких как слабость и похудание мышц стоп, преимущественно разгибателей, судороги мышц голеней. При осмотре выявляются негативные чувствительные симптомы (снижение всех видов поверхностной чувствительности по типу «носков», вибрационной чувствительности, суставно-мышечного чувства), снижение или отсутствие ахилловых рефлексов, слабость и гипотрофия мышц стоп.
Болевая форма ДПН наблюдается гораздо реже, чем безболевая, – 15–25% всех пациентов с ДПН [5]. Однако именно эта форма ДПН приводит к развитию повышенной тревожности, депрессии, нарушению сна и значительному снижению качества жизни пациентов [6]. Хроническая болевая ДПН характеризуется невропатическими болями в стопах в виде покалывания, жжения, стреляющих, скручивающих болей, похожих на прохождение электрического тока, и позитивными чувствительными нарушениями в виде гипералгезии, аллодинии, дизестезии при неврологическом обследовании.
Поражение автономной нервной системы с формированием различных синдромов (кардиальный, гастроинтестинальный, урогенитальный) наблюдается уже на ранней стадии ДПН, но длительно протекает бессимптомно. Поэтому очень важно на этапе сбора жалоб и анамнеза активно спрашивать пациента о толерантности к физическим нагрузкам, тяжести в области эпигастрия после приема пищи, характере стула, нарушении мочеиспускания, у мужчин – об эректильной дисфункции. Распространенность диабетической автономной невропатии (ДАН) составляет от 2,5 до 50% и зависит от используемых диагностических критериев и методов, возраста пациентов и длительности СД [7]. Кардиальная автономная невропатия (КАН) – самая частая форма ДАН, при которой нарушается регуляция сердечной деятельности и тонуса сосудов в результате повреждения автономных нервных волокон, иннервирующих сердце и кровеносные сосуды. КАН относится к наиболее значимым факторам риска повышенной смертности от всех причин у пациентов с СД 1-го типа и независимым факторам риска смертности у пациентов с СД 2-го типа [6]. Факторами риска развития КАН являются длительность течения СД, неадекватный контроль уровня глюкозы в крови, гипертония, дислипидемия, ожирение, возраст, курение, наличие микрососудистых осложнений (ретинопатия, нефропатия, периферическая невропатия) [8]. Ранний симптом КАН – тахикардия покоя, развитие которой связано с повреждением парасимпатических волокон на фоне сохранных симпатических волокон. Еще одним частым симптомом КАН является так называемое денервированное сердце, когда физические нагрузки, глубокое дыхание, стресс, отдых, сон почти не влияют на частоту сердечного ритма. К поздним и наиболее инвалидизирующим пациентов проявлениям КАН относится ортостатическая гипотензия, которая характеризуется снижением систолического артериального давления более 20 мм рт. ст. или диастолического более 10 мм рт. ст. в течение трех минут после изменения положения тела (из горизонтального в вертикальное). Пациенты предъявляют жалобы на головокружение, потемнение в глазах, нечеткость зрения, общую слабость вплоть до развития обморочного состояния. К жизнеугрожающим состояниям относится безболевая ишемия миокарда, частота которой значительно выше у пациентов с КАН [9]. Гастроинтестинальная форма включает в себя гастропарез, атонию сфинктеров пищевода, безболевую диарею, запор, аноректальную дисфункцию.
Нарушение функции потовых желез проявляется сухостью кожи, гипо- и ангидрозом стоп, гипергидрозом верхней половины тела, особенно после приема пищи. Скрининг на выявление ДАН необходимо проводить всем пациентам с СД в момент постановки диагноза, а пациентам с СД 1-го типа – через пять лет от начала заболевания [7].
На этапе клинических проявлений установить диагноз дабетической полиневропатии не представляет труда. Однако крайне важна диагностика ДПН на более ранних, субклинических стадиях. Ранняя диагностика ДПН позволяет своевременно начать патогенетическую терапию, предотвратить прогрессирование болезни и сохранить периферические нервы. Для этого рекомендуется использовать инструментальные методы исследования. Золотым стандартом диагностики ДПН признана электронейромиография (ЭНМГ) – объективный, чувствительный, воспроизводимый и стандартизированный метод. Наиболее ранним ЭНМГ-признаком ДПН считается аксональное поражение икроножного нерва. Кроме того, при ДПН наблюдается снижение амплитуды М-ответа при стимуляции малоберцового нерва, незначительное уменьшение скорости проведения возбуждения (СРВ) по икроножному и малоберцовому нервам, увеличение минимальной латенции при исследовании F-волны по малоберцовому и большеберцовому нервам [10]. ЭНМГ-исследование также имеет большое значение при подозрении на тоннельную невропатию, особенно при наличии неврологических симптомов в верхних конечностях. В отсутствие клинических симптомов целесообразным представляется обследование пациентов с СД один раз в год.
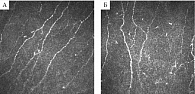
Следует отметить, что при проведении ЭНМГ оценивают функции только толстых миелинизированных нервных волокон (Аα- и Аβ-типы волокон). Между тем при ДПН на раннем этапе чаще поражаются тонкие мало- и немиелинизированные нервные волокна. В этом случае ЭНМГ-показатели будут в пределах нормальных значений. Поэтому для диагностики ранней ДПН целесообразно использовать методики, разработанные специально для диагностики невропатий тонких нервных волокон: количественное сенсорное тестирование (КСТ), биопсия кожи, конфокальная микроскопия роговицы (КМР). Метод КСТ основан на определении пороговых величин тепловой (С-волокна) и холодовой (Аδ-волокна) чувствительности, а также тепловой и холодовой боли (C-волокна). Данный метод признан чувствительным, неинвазивным, в то же время субъективным, зависящим от внимания и настроя пациента, его готовности к сотрудничеству. При биопсии кожи у пациентов с ДПН отмечается достоверное снижение плотности внутриэпидермальных нервных волокон. Однако данный метод инвазивный, в России используется преимущественно в научных работах и недоступен в рутинной неврологической практике. На сегодняшний день наиболее перспективным и информативным методом ранней диагностики ДПН считается КМР – быстрая, неинвазивная методика, которая на уровне, близком к морфологическому, позволяет визуализировать нервные волокна роговицы (НВР). Российские офтальмологи в НИИ глазных болезней разработали собственную методику анализа ДПН. Основные показатели КМР: показатель извитости НВР, который называется коэффициентом анизотропии (KΔL), показатель симметричности направленности НВР (Ksym).
В исследовании с участием 96 пациентов с ДПН при сопоставлении различных методов (ЭНМГ, КСТ, КМР) было выявлено достоверное уменьшение средних значений KΔL в группах пациентов с СД 1-го и 2-го типов по сравнению с аналогичными показателями в контрольной группе (рисунок). В группе пациентов с СД 1-го типа и субклинической стадией ДПН установлена корреляция между коэффициентами извитости нервов роговицы и амплитудами М-ответа малоберцового нерва, большеберцового нерва, резидуальной латентностью, СРВ малоберцового нерва. Значения Ksym коррелировали с порогом тепловой чувствительности при КСТ. Среди пациентов с СД 2-го типа и субклинической стадией ДПН коэффициент анизотропии (KΔL) коррелировал с СРВ малоберцового нерва, амплитудой М-ответа при стимуляции большеберцового нерва и резидуальной латентностью при стимуляции малоберцового нерва. На субклинической стадии ДПН обращает на себя внимание более выраженная частота изменений НВР по сравнению с результатами ЭНМГ и КСТ. Так, патологические изменения НВР имели место во всех случаях при СД 1-го типа и в 81% при СД 2-го типа [11]. Метод КМР включен в клинические рекомендации Минздрава России по ведению пациентов с СД [12].
Лечение ДПН включает:
- нормализацию уровня глюкозы в крови;
- патогенетическую терапию, направленную на основные звенья патогенеза ДПН;
- симптоматическую терапию (лечение невропатической боли, уменьшение проявлений ортостатической гипотензии).
Кроме того, значение имеют модификация образа жизни (отказ от вредных привычек, снижение массы тела, диетотерапия, умеренные физические нагрузки) и коррекция коморбидных состояний, таких как артериальная гипертензия, дислипидемия, ожирение, ишемическая болезнь сердца, облитерирующий эндартериит.
Нормогликемия, несомненно, является важным фактором лечения ДПН. Однако, исходя из результатов исследований влияния усиленного контроля СД на ДПН, больные СД 1-го и 2-го типа по-разному отвечают на хороший контроль гликемии. В отличие от СД 2-го типа при СД 1-го типа хороший контроль гликемии достоверно приводит к уменьшению риска развития ДПН [4, 13].
Патогенетическое лечение ДПН предусматривает использование препаратов, блокирующих основные пути повреждения периферических нервов. Ведущим патогенетическим механизмом, приводящим к повреждению периферических нервов, является окислительный стресс. В недавних исследованиях установлена зависимость между системными уровнями прооксидантных биомаркеров (миелопероксидаза, метилглиоксаль, супероксид-анион, внеклеточная супероксиддисмутаза 3) и частотой развития ДПН [14].
Таким образом, появились новые данные, подтверждающие, что более высокие уровни прооксидантных биомаркеров связаны с более высоким риском ДПН. Окислительный стресс, усиленное образование конечных продуктов гликирования, активация перекисного окисления липидов, индуцибельной NO-синтазы приводят к избыточному образованию свободных радикалов – молекул, обладающих повышенной способностью к взаимодействию с другими молекулами. Свободные радикалы нарушают целостность клеточных структур, прежде всего эндотелия, вызывая эндоневральную гипоксию и, как следствие, невропатию. Активность антиоксидантной системы организма (в частности, супероксиддисмутазы, каталазы, глютатиона) у пациентов с ДПН снижена. Преодолеть окислительный стресс помогают экзогенные антиоксиданты [15].
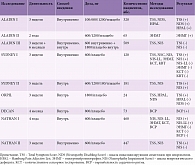
Первое место среди антиоксидантов и препаратов, назначаемых в качестве патогенетического лечения ДПН, занимает тиоктовая кислота (ТК). Высокая эффективность ТК доказана во многих двойных слепых плацебоконтролируемых исследованиях (табл. 1) [16–21]. У пациентов с болевой формой ДПН при внутривенном назначении ТК в течение трех недель достоверно уменьшается позитивная невропатическая симптоматика (боль, жжение, онемение и парестезии) по шкале TSS (Total Symptom Score). В исследованиях SYDNEY I и SYDNEY II, посвященных оценке эффективности внутривенной и таблетированной форм ТК, зафиксирована положительная динамика не только в отношении невропатической боли, но и в отношении объективных неврологических симптомов (чувствительные нарушения, изменение рефлексов, мышечная сила). Это свидетельствует об улучшении функции периферических нервов.
Четыре клинических исследования (ALADIN I, ALADIN III, SYDNEY, NATHAN II) эффективности внутривенного введения ТК в течение трех недель вошли в метаанализ. Согласно полученным результатам, cнижение выраженности симптоматики по шкале TSS более чем на 50% наблюдалось у 52,7% пациентов, получавших альфа-липоевую кислоту, и у 36,9% пациентов, принимавших плацебо (p < 0,05) [22].
В 2010 г. были опубликованы результаты совещания Торонтовской группы экспертов по ДПН, которые признали ТК единственным патогенетическим средством лечения ДПН с доказанной эффективностью и уровнем доказательности – класс А [7].
Берлитион (Берлин-Хеми/А. Менарини), содержащий ТК, зарекомендовал себя как препарат с доказанной эффективностью и хорошей переносимостью. При ДПН лечение должно быть двухэтапным:
- этап I: Берлитион 600 мг внутривенно капельно в течение 15 дней;
- этап II (поддерживающая терапия): Берлитион 600 мг (две таблетки по 300 мг) один раз в день в течение 2–6 месяцев.
Поскольку пища может снижать максимальную концентрацию альфа-липоевой кислоты в плазме и увеличивать время установления пика концентрации препарата в крови, таблетированную форму препарата рекомендуют принимать за 30 минут до еды.
Продолжительный прием Берлитиона оправдан так называемым болезнь-модифицирующим эффектом, который заключается в замедлении прогрессирования заболевания. Такой вывод сделан на основании результатов четырехлетнего наблюдения за пациентами с СД и ДПН, принимавшими ТК. Статистически значимые различия в исследуемой группе и группе плацебо были выявлены при оценке объективных неврологических симптомов по шкале NIS (Neuropathy Impairment Score): у пациентов, принимавших ТК, показатель мышечной силы был выше, чем у пациентов, получавших плацебо. В данном исследовании также продемонстрирован хороший профиль безопасности ТК при длительном применении [20].
При болевой форме ДПН, невропатическом болевом синдроме препаратами выбора являются прегабалин, габапентин, дулоксетин [4]. Но их назначение нередко ограничивается сопутствующими заболеваниями пациентов с СД, а также спектром нежелательных побочных явлений.
СД, будучи независимым фактором риска как острых сосудистых эпизодов, так и прогрессирующего снижения когнитивных функций, приводит к повреждению центральной нервной системы. Оба осложнения СД потенциально несут в себе угрозу жизни и способствуют снижению качества жизни пациентов. Например, пациенты с диабетической энцефалопатией (ДЭ) вследствие когнитивных нарушений не могут адекватно поддерживать уровень гликемии (следовать гипогликемической диете, вовремя принимать препараты, правильно рассчитать необходимую дозу инсулина), что приводит к ухудшению течения СД и прогрессированию его осложнений. Частота ДЭ варьируется в широких пределах. Скорее всего это связано с наличием у больных СД других сердечно-сосудистых факторов риска поражения головного мозга. Так, в исследовании D. Brunce и соавт. у 17,5% пожилых пациентов с СД 2-го типа наблюдалось снижение повседневной активности, у 11,3% – когнитивные нарушения [23].
Как и при ДПН, ведущим повреждающим фактором нейронов головного мозга является окислительный стресс вследствие гипергликемии, который нарушает структуру митохондриальной ДНК, активируя регенеративные полимеразы. В результате нарушается утилизация глюкозы и в клетках накапливаются промежуточные продукты обмена. Но гипергликемия – не единственный повреждающий механизм при ДЭ. Подтверждение тому – результаты исследования ACCORD-mind, которые показали отсутствие влияния интенсивной гипогликемической терапии на когнитивный дефицит [24].
К развитию когнитивных нарушений также приводят сосудистые изменения в виде утолщения стенок мелких артерий по типу липогиалиноза и атероматоза [25].
В последние годы активно обсуждается роль СД как пускового фактора нейродегенеративных процессов в головном мозге. Так, гиперинсулинемия способствует увеличению уровня бета-амилоида, образованию нейрофибриллярных клубочков и сенильных бляшек [26–28]. Обсуждается значимость гипогликемических эпизодов в развитии когнитивных нарушений, особенно у пациентов с СД 1-го типа.
В настоящее время доказано, что тяжелые гипогликемические состояния ассоциируются с развитием когнитивных нарушений, особенно при наличии других факторов риска [29]. Кроме того, у пациентов с СД, особенно в сочетании с другими сердечно-сосудистыми заболеваниями, отмечаются нарушение свертывающей системы крови, активация тромбоцитов, повышение способности тромбоцитов к агрегации.
К клиническим симптомам ДЭ относятся снижение памяти, замедление мыслительных процессов, трудности при запоминании новой информации. При нейропсихологическом исследовании выявляются нарушения слухоречевой и зрительной памяти, снижение концентрации внимания, замедление мышления и обработки информации, нарушение управляющих функций, снижение памяти на текущие события. У пациентов нередко имеют место эмоциональные нарушения в виде повышенной тревожности, эмоциональной лабильности, сниженного фона настроения [27, 28]. Как правило, выявляются легкие или умеренные когнитивные нарушения, редко развивающиеся до стадии деменции [28]. Перечень когнитивных функций, которые снижаются при СД 1-го и 2-го типа, представлен в таблице 2 [26].
При магнитно-резонансной томографии головного мозга у пациентов с ДЭ выявляемые изменения носят неспецифический характер: признаки церебрального поражения мелких сосудов в виде небольших очагов в белом веществе головного мозга, преимущественно перивентрикулярно, незначительное расширение субарахноидальных пространств, боковых желудочков и атрофия коры головного мозга [30].
Обратите внимание: ДЭ длительное время может протекать бессимптомно. Поэтому в целях раннего выявления заболевания и своевременного начала лечения всем пациентам с СД 1-го и 2-го типов ежегодно должны проводиться скрининговые тесты (mini-Сog, MоCA (Montreal Cognitive Assessment), Краткая шкала оценки психического статуса (КШОПС)).
Лечение ДЭ складывается из нескольких направлений:
- коррекция уровня глюкозы в крови;
- коррекция сопутствующих сердечно-сосудистых факторов риска;
- медикаментозная терапия (антиоксиданты, антиагреганты, сосудистые и ноотропные препараты);
- когнитивный тренинг.
Одним из препаратов с плейотропными эффектами, позволяющими воздействовать сразу на несколько звеньев патогенеза ДЭ, является дипиридамол (Курантил). Курантил улучшает микроциркуляцию головного мозга, оказывает антиагрегантный эффект, который связан с подавлением тромбоцитарной фосфодиэстеразы, ингибированием аденозиндезаминидазы и повышением концентрации аденозинмонофосфата и аденозина. Аденозин через А2-рецепторы активирует аденилатциклазу, оказывая антиагрегантный эффект. Дипиридамол улучшает эндотелиальную дисфункцию, оказывая вазодилатирующее действие, а также подавляет образование эндотелиальных клеток, выделяющих активные формы кислорода, то есть проявляет антиоксидантный эффект [31].
Эффективность Курантила при ДЭ продемонстрирована в недавнем исследовании с участием 708 пациентов с СД, перенесших ишемический инсульт. Пациенты были разделены на четыре группы. В первой группе назначали дипиридамол (Курантил) 75 мг три раза в сутки, во второй – ацетилсалициловую кислоту 100 мг/сут, в третьей – ацетилсалициловую кислоту и магния гидроксид (Кардиомагнил) 75 мг/сут, в четвертой – клопидогрел (Плавикс) 75 мг/сут. Для оценки когнитивных функций использовались шкалы МоСА и оценки психического статуса ММSЕ (Mini-Mental State Examination). Полученные результаты подтвердили достоверно значимое улучшение когнитивных функций, психоэмоционального статуса и качества жизни в группе пациентов, получавших дипиридамол (Курантил) [32].
СД служит независимым фактором риска развития ишемического инсульта. Ишемический инсульт у пациентов с СД ассоциируется с более тяжелым течением, более частым развитием отека головного мозга, более медленным восстановлением неврологических функций и более высоким процентом инвалидизации [30]. Постинсультные когнитивные нарушения у пациентов с СД регистрируются чаще, чем у пациентов с нормогликемией [30].
При СД преобладают атеротромботический и лакунарный патогенетические подтипы. Множественные лакунарные инсульты, часто протекающие бессимптомно, остаются недиагностированными, что приводит к отсутствию вторичной профилактики ишемического инсульта. Доказано, что у пациентов с СД, перенесших малые инсульты и транзиторные ишемические атаки, частота повторного ишемического инсульта выше, чем у пациентов с нормогликемией [33].
Вторичная профилактика ишемического инсульта у пациентов с СД включает:
- поддержание нормогликемии (коррекция образа жизни, гипогликемическая терапия);
- контроль артериального давления (целевой уровень артериального давления у пациентов с СД должен быть менее 130/80 мм рт. ст.);
- использование антиагрегантов;
- назначение гиполипидемической терапии при некардиоэмболическом варианте ишемического инсульта.
В качестве антиагрегантной терапии рекомендуется ацетилсалициловая кислота (АСК) от 75 до 325 мг/сут. На фоне применения АСК снижается риск повторного инфаркта миокарда, инсульта и сосудистой смерти у пациентов с СД [34].
Дипиридамол (Курантил) в отличие от АСК не оказывает повреждающего воздействия на слизистую оболочку желудочно-кишечного тракта, поэтому может быть рекомендован в качестве антиагрегантного средства при наличии противопоказаний к применению АСК.
В национальных рекомендациях по кардиоваскулярной профилактике 2017 г. комбинация дипиридамола и АСК признана предпочтительной у пациентов после некардиоэмболического инсульта или транзиторной ишемической атаки (уровень доказательности IА) [34].
Подтверждена эффективность комбинированного приема дипиридамола 200 мг два раза в день и АСК 25 мг два раза в день [35]. Предполагается, что именно дополнительные плейотропные эффекты (в частности, противовоспалительный и антиоксидантный) обусловливают преимущества дипиридамола при его добавлении к АСК в рамках вторичной профилактики инсульта [36].
С целью профилактики и лечения нарушений мозгового кровообращения дипиридамол 75 мг обычно назначают 3–6 раз в день. Максимальная суточная доза – 450 мг, в тяжелых случаях доза может быть увеличена до 600 мг/сут.
Раннее начало патогенетической терапии препаратом Берлитион позволяет сохранить целостность периферических соматических и автономных нервов, уменьшить повреждающее действие окислительного стресса на нейроны головного мозга, улучшить качество жизни пациентов и снизить нагрузку на сферу здравоохранения.
L.T. Akhmedzhanova, PhD, O.A. Solokha, PhD
I.M. Sechenov First Moscow State Medical University
Contact person: Luisa T. Akhmedzhanova, luiziana78@mail.ru
The prevalence of diabetes in the world has become the sort of an epidemic. In addition the number of patients with its complications increases. Diabetic polyneuropathy is one of the most common complications of diabetes. Hyperglycemia is also a risk factor for cognitive impairment and ischemic stroke. In the absence of adequate treatment, diabetic polyneuropathy and encephalopathy, as they progress, lead to the decrease in the quality and life expectancy of patients. In this regard, the role of timely diagnosis of these cases is difficult to overestimate. The article analyzes the clinical symptoms of neurological disorders of diabetes mellitus, as well as the current recommendations for the examination and treatment of patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.