Диагностическая и прогностическая роль экзосомальных микроРНК при колоректальном раке
- Аннотация
- Статья
- Ссылки
- English
Введение
В структуре заболеваемости злокачественными новообразованиями в 2020 г. среди мужского населения РФ удельный вес колоректального рака (КРР) (рак ободочной и прямой кишки, ректосигмоидного соединения и ануса) составил 12,6%, среди женского – 12,0%. Общий темп прироста с 2010 по 2020 г. в популяции достиг 47,8%. Ежегодно в мире регистрируется 1,9 млн случаев заболевания КРР. Смертность также остается высокой. По данным Всемирной организации здравоохранения, от КРР в 2020 г. умерли 935 173 пациента, в частности в РФ – 18 678 [1, 2].
Программы скрининга КРР в России на первом этапе предусматривают исследование кала на скрытую кровь и эндоскопическое исследование толстой кишки у пациентов группы высокого риска. Однако данный алгоритм имеет ряд существенных ограничений. Недостаточная чувствительность и специфичность исследования кала на скрытую кровь обусловливают выпадение из поля зрения врачей пациентов с предраковыми заболеваниями толстого кишечника или начальной стадией КРР. В то же время необходимость проведения инвазивной диагностики среди широкого круга пациентов создает дополнительную нагрузку на общую лечебную сеть, что требует поиска более специфичных и чувствительных маркеров заболевания [3, 4].
Использование РЭА и СА 19-9 в качестве молекулярных маркеров на этапе скрининга нецелесообразно: статистически значимые отличия от референсных значений имеют место лишь у пациентов с III–IV стадией заболевания [5].
Жидкостная биопсия – малоинвазивная методика, характеризующаяся низкой стоимостью и высокой эффективностью, применяется для обнаружения циркулирующих опухолевых клеток, субклеточных образований, белков, гликопротеинов, нуклеиновых кислот. Однако низкая чувствительность метода не позволяет использовать жидкостную биопсию на начальных стадиях заболевания [5].
Сказанное подтверждает необходимость разработки и внедрения новых, более эффективных и чувствительных методов скрининга КРР, а также оценки прогноза заболевания.
Роль внеклеточных нановезикул в межклеточном взаимодействии
После открытия системы везикулярного транспорта как основной транспортной системы в наших клетках экзосомы стали предметом активного изучения. Экзосомы представляют собой мембранные нановезикулы размером 30–200 нм, содержащие те же липиды, белки, нуклеиновые кислоты и гликопротеины, что и продуцирующие их клетки. Внеклеточные нановезикулы секретируются большинством типов клеток, в том числе клетками опухоли, и присутствуют практически во всех биологических жидкостях – слюне, плазме, сперме, ликворе, секрете бронхов, грудном молоке, моче, амниотической жидкости [6–11].
Состав экзосом обусловлен, с одной стороны, составом предшествующих им эндосом, включающих белки мембраны, белки главного комплекса гистосовместимости, интегрины, тетраспанины, рецепторы, с другой – РНК, ДНК, отдельными белками, поступающими в экзосомы посредством АТФ-зависимого направленного транспорта из клетки-донора.
Все белки в экзосомах можно разделить на две группы – неспецифичные и тканеспецифичные. Неспецифичные белки, например белки теплового шока HSC70, HSP90, тетраспанины, аннексины и флотилины, присутствуют практически во всех экзосомах. Тканеспецифичные белки зависят от принадлежности к тканям, клетки которых выработали ту или иную экзосому, в частности HER-2 для тканей рака молочной железы или МНС II для дендритных клеток и B-лимфоцитов.
Большинство белков экзосом можно также распределить на несколько групп по функциональному назначению: белки цитоскелета, белки комплекса гистосовместимости, белки сигнальной трансдукции, белки слияния и стыковки мембран, белки теплового шока. Чаще в экзосомах встречаются 25 белков, среди которых белок теплового шока 70кДА, СD9, CD 81, CD 63, альбумин, лактатдегидрогеназа А, синтеин, аннексин А5, альдолаза А, кофилин [12].
Секреция экзосом из клетки осуществляется при условии содержания в мембране эндосом церамидов. Только в этом случае возможно слияние с поверхностной мембраной донорской клетки, а не с лизосомой. Кроме того, ГТФазы семейства Rab регулируют выход экзосом во внеклеточное пространство [13, 14]. Установлено, что высокое содержание кальция и низкий уровень рН в межклеточном пространстве усиливают секрецию экзосом [15].
Функции экзосом включают горизонтальный перенос сигнальных молекул, межклеточное взаимодействие посредством передачи белков и РНК с помощью лиганд-рецепторного контакта, встраивания экзосомальной мембраны в клеточную, фагоцитоза экзосом клетками-реципиентами, иммуномодулирующее действие, индукцию ангиогенеза и ремоделирование стромы [16–21].
Экзосомы также имеют высокий терапевтический потенциал: их биомолекулярные особенности позволяют вести фундаментальные и клинические исследования по адресной доставке лекарственных препаратов в клетки-мишени, в том числе преодолевая гематоэнцефалический барьер.
Молекулярные и функциональные особенности экзосомальных микроРНК
Особый научный интерес сосредоточен на экзосомальных микроРНК – коротких одноцепочечных РНК, регулирующих экспрессию генов на посттранскрипционном уровне. По данным литературы, контроль проникновения микроРНК в экзосомы осуществляют белки hnRNPA2B1 и hnRNPA1, а церамид-зависимый механизм обеспечивает доставку экзосомальных микроРНК во внеклеточную среду. Японские исследователи подтвердили основополагающую роль церамид-зависимого механизма путем ингибирования нейтральной сфингомиелиназы II с последующим снижением секреции экзосом и экзосомальных микроРНК во внеклеточную среду [22].
Предметом научных дискуссий остаются способы поглощения клетками-реципиентами экзосом с находящимися в них микроРНК. Рассматриваются такие механизмы, как лиганд-рецепторное взаимодействие, встраивание экзосомальной мембраны в клеточную, фагоцитоз экзосом клетками-реципиентами [23, 24].
Доказана функциональная важность экзосомальных микроРНК при физиологических состояниях. Так, различные экзосомальные микроРНК стимулируют процессы пролиферации и миграции фибробластов, трансляции антигенов в антигенпрезентирующих клетках, регенерации аксонов периферических нервов, индуцируют процессы ангиогенеза, усиливают атеропротективные свойства гладкомышечных клеток [25–30].
Рассматривая патологические состояния, исследователи активно изучают роль экзосомальных микроРНК в возникновении и прогрессировании злокачественных опухолей. Установлено, что экзосомальные микроРНК влияют на рост опухоли, регулируя процессы инвазии, метастазирования и ангиогенеза, а также ее микроокружение посредством активации макрофагов и изменения внеклеточного матрикса [31–35].
Экзосомальные микроРНК – потенциальные биомаркеры колоректального рака
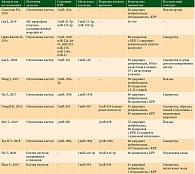
Неинвазивная лабораторная диагностика КРР является перспективной областью исследований. Первые результаты оценки уровня экзосомальных микроРНК представила группа японских ученых под руководством профессора H. Ogata-Kawata в 2014 г. Исследователи показали статистически значимое увеличение уровня семи подтипов микроРНК (miR-1229, miR-23a, let-7a, miR-223, miR-150, miR-1246, miR-21) в плазме крови пациентов с КРР в отличие от здоровых добровольцев [36].
Повышение экзосомальной miR-21 у пациентов с КРР III–IV стадии по сравнению с группой пациентов с I–II стадией подтвердила другая группа японских исследователей. Кроме того, при изучении профиля микроРНК и оценке показателей безрецидивной и общей выживаемости ученые обнаружили зависимость между высоким уровнем miR-21 и снижением продолжительности жизни. В то же время низкий уровень miR-21 коррелировал с увеличением общей выживаемости [37, 38].
В исследовании у 240 пациентов с КРР miR-203 была идентифицирована как прогностически неблагоприятный маркер течения заболевания, коррелировавший со снижением общей и безрецидивной выживаемости [39].
Как продемонстрировал сравнительный анализ диагностической значимости экзосомальных микроРНК у китайских пациентов с КРР in situ, включение в диагностическую панель комбинаций микроРНК увеличивает специфичность метода до 93–94% [40–44].
S. Zhao и соавт. в 2020 г. описали корреляцию высокой экспрессии miR-934 в плазме крови с наличием метастатических очагов КРР, локализующихся преимущественно в печени. Исследователи также охарактеризовали специфические молекулярные особенности miR-934. Молекула, активируя сигнальный путь PI3K/AKT и подавляя экспрессию гена PTEN, индуцирует поляризацию М2-макрофагов, которые способствуют формированию преметастатической ниши для клеток КРР [45]. Кроме того, miR-106b-5p запускает каскад реакций сигнального пути PI3Kγ/AKT/mTOR за счет прямого подавления экспрессии гена программируемой клеточной гибели 4-го типа на посттранскрипционном уровне, что способствует миграции, инвазии и метастазированию клеток КРР. Высокий уровень экспрессии miR-106b-5p в плазме крови ассоциируется с плохим прогнозом и низкими показателями общей и безрецидивной выживаемости [46].
Другой механизм влияния на развитие метастатических очагов имеет miR-25-3р, регулирующая экспрессию VEGFR-2 в эндотелиальных клетках, что способствует усилению проницаемости сосудов и неоангиогенезу. Так, в исследовании уровня miR-25-3р у 17 пациентов с КРР отмечалось ее резкое снижение на послеоперационном этапе. Исключение составили три пациента, у которых интраоперационно диагностировали метастатическое поражение печени [47].
Помимо диагностики и прогноза течения КРР экзосомальные микроРНК могут использоваться как предикторы ответа на стандартную химиотерапию по схеме FOLFOX. В качестве потенциального биомаркера развития химиорезистентности к оксалиплатину описана miR-208-b в группах химиорезистентных (n = 47) и химиочувствительных (n = 69) пациентов. Биомолекула стимулирует Т-регуляторные лимфоциты, которые в свою очередь тормозят фактор программируемой клеточной гибели 4-го типа, что приводит к росту опухоли и развитию пула химиорезистентных клеток [48]. Напротив, биомаркером химиочувствительности может служить miR-128-3p, способствующая накоплению оксалиплатина в опухолевых клетках и ингибирующая процесс эпителиально-мезенхимального перехода. Доказано, что низкий уровень miR-128-3p ассоциируется с худшим прогнозом у тех, кто получает терапию первой линии по поводу распространенного КРР [49].
Роль miR-93-5p, продуцируемой опухоль-ассоциированными фибробластами, в развитии радиорезистентности клеток КРР подтверждена X. Chen и соавт. (2020). Ученые обнаружили, что miR-93-5р обусловливает уход клеток опухоли от радиационно-индуцированного апоптоза посредством подавления ядерного фактора 3-альфа гепатоцитов и стимуляции трансформирующего фактора роста опухоли бета [50]. Изученные у больных КРР микроРНК представлены в таблице.
Использование микроРНК в качестве потенциального диагностического и прогностического маркера у пациентов с колоректальным раком имеет некоторые ограничения. Из-за отсутствия стандартного метода нормализации микроРНК в биологических средах интерпретация полученных результатов может быть затруднена. Кроме того, использование различных платформ для определения уровня экспрессии микроРНК приводит к низкой воспроизводимости результатов исследований, что требует внедрения точной платформы качественного и количественного профилирования микроРНК [33].
Одним из наиболее часто используемых методов идентификации микроРНК является количественная полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР). Данный метод характеризуется высокой чувствительностью и специфичностью, экономической доступностью, однако ряд исследователей отмечают высокий риск контаминации образцов на этапах амплификации [51].
В ряде случаев альтернативой ОТ-ПЦР может служить нозерн-блот-гибридизация, также относящаяся к количественным методам определения микроРНК. Тем не менее возможности данного метода существенно ограничивает необходимое количество искомой микроРНК в образцах. Не случайно выявление единичных биомолекул весьма затруднено [52].
Постепенно в клиническую практику внедряется высокоспецифичный метод секвенирования нового поколения, который, несмотря на высокую стоимость, способен выявлять даже единичные микроРНК в образцах [53].
Заключение
Экзосомальные микроРНК имеют высокий диагностический и прогностический потенциал, однако для их внедрения в качестве молекулярного маркера в клиническую практику необходима количественная и качественная стандартизация, с учетом которой будет создана точная диагностическая платформа.
M.S. Serbayeva, R.A. Zukov, PhD, Prof.
V.F. Voyno-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
Siberian Scientific and Clinical Center of the FMBA of Russia
Contact person: Margarita S. Serbayeva, serbaeva94@mail.ru
The problem of high morbidity and mortality from colorectal cancer does not cease to lose its relevance in both developed and developing countries. Existing screening and prognostic methods for assessing the course and prognosis of the disease are not sufficiently sensitive and specific. Exosomal microRNAs are considered as a possible biomarker, which have a high diagnostic and prognostic potential at the stages of the patient's initial visit, during complex treatment and during the follow-up period.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.