Трудности дифференциальной диагностики воспалительных заболеваний кишечника
- Аннотация
- Статья
- Ссылки
- English
Введение
Болезнь Крона (БК) и язвенный колит (ЯК) относятся к хроническим аутоиммунным воспалительным заболеваниям кишечника (ВЗК), имеющим волнообразный характер течения. Длительное время ВЗК были наиболее распространены среди лиц молодого возраста, однако со временем стало возрастать число заболеваний среди пожилых людей. Согласно данным мировой литературы, около 25–35% пациентов с ВЗК старше 60 лет, из них 15% – это пациенты с впервые установленным диагнозом позднее 60 лет и 20% – пациенты с ВЗК, диагностированным в молодом возрасте, перешедшие в статус пожилых пациентов [1, 2].
Известно, что БК может поражать любой участок желудочно-кишечного тракта от ротовой полости до перианальных областей, но зачастую затрагивает терминальный отдел подвздошной кишки. Пожилые пациенты с БК имеют нетипичные проявления болезни: характерна локализация БК в толстой кишке, реже – в терминальном отделе подвздошной кишки; клинически этих больных чаще беспокоят ректальные кровотечения, реже – боли в животе, лихорадка, снижение массы тела [3].
В связи с разнообразием клиники, коморбидностью, полипрагмазией у пациентов с ВЗК пожилого возраста необходимо помнить о дифференциальном диагнозе, в первую очередь со злокачественными новообразованиями, ишемическим колитом, колитом на фоне приема нестероидных противовоспалительных препаратов, клостридиальной инфекцией [4].
В течение первых 10 лет от дебюта БК у половины пациентов с БК в любом возрасте необходимо хирургическое лечение в связи с осложненным течением заболевания. Однако оперативное лечение не приводит к полному излечению от БК [5, 19].
Пожилые пациенты с ВЗК имеют более высокий риск хирургического вмешательства при постановке диагноза или вскоре после него, в то время как долгосрочная частота операций аналогична другим возрастным группам.
По данным клинических наблюдений в специализированных центрах и рандомизированных клинических исследований, спустя год после операции частота эндоскопического рецидива БК по шкале Rutgeerts достигает 75% [6].
Таким образом, пациентам с БК в зависимости от сочетания факторов риска, а также эффективности ранее проводившейся терапии показано назначение или продолжение длительной противорецидивной терапии через четыре недели после хирургического лечения [7].
Клиническое наблюдение
Больная Д., 70 лет, поступила в гастроэнтерологическое отделение Московского клинического научного центра (МКНЦ) им. А.С. Логинова в июне 2021 г.
Из анамнеза известно, что в феврале 2021 г. на фоне полного благополучия пациентка впервые отметила появление спастических болей в животе, а также учащение стула до трех раз в сутки. В марте 2021 г. амбулаторно по месту жительства в Клинико-диагностическом центре № 6 выполнена колоноскопия (КС) с осмотром ободочной кишки до нисходящего отдела, по данным которой выявлены дивертикулез толстой кишки, полиповидное образование сигмовидной кишки (тип 0–1р). В описании протокола эндоскопического исследования данных за воспалительные изменения слизистой оболочки толстой кишки не было. Однако в заключении патоморфологического исследования биоптатов толстой кишки получено следующее описание: очаговая гиперплазия слизистой оболочки толстой кишки с фокусами неоплазии тяжелой степени на фоне активного колита с косвенными признаками эрозирования. В связи с этим больная была направлена к онкологу по месту жительства для дообследования. Выполнена магнитно-резонансная томография органов брюшной полости – изменения сигмовидной кишки следует дифференцировать с крупным полипом и аденомой.
31 марта 2021 г. на фоне резкого ухудшения состояния – появления режущих болей в нижних отделах живота, учащения стула до 10 раз в сутки с примесью крови – бригадой скорой медицинской помощи больная была госпитализирована в хирургическое отделение Городской клинической больницы (ГКБ) им. В.В. Вересаева г. Москвы. По результатам проведенного обследования (компьютерная томография (КТ) органов брюшной полости с внутривенным контрастированием, КС) выявлены стриктуры поперечной и нисходящей ободочной кишки, эрозивный колит. Согласно медицинской документации, в отделении хирургии проводили консервативную терапию – без эффекта, в связи с чем 3 апреля 2021 г. проведено эндоскопическое стентирование поперечной и нисходящей ободочной кишки. При морфологическом исследовании биоптатов толстой кишки выявлен хронический эрозивный колит высокой степени активности. После эндоскопического стентирования ободочной кишки больная выписана на амбулаторное лечение под наблюдение онколога, хирурга, колопроктолога по месту жительства.
13 апреля 2021 г. амбулаторно в ГКБ № 62 по результатам колоноскопии картина соответствовала язвенному колиту, субтотальное поражение, высокой степени активности; эндоскопическая картина подозрительна в отношении новообразования ободочной кишки на фоне язвенного колита. При морфологическом исследовании выявлен хронический колит высокой степени активности; опухолевого роста не обнаружено.
Пациентке впервые назначена местная терапия свечами с месалазином 1 г в сутки с кратковременным положительным эффектом.
Однако 17 мая 2021 г. в связи сохраняющимся болевым синдромом пациентка самостоятельно обратилась в консультативно-диагностическое отделение МКНЦ им. А.С. Логинова, где была осмотрена колопроктологом и направлена на госпитализацию в гастроэнтерологическое отделение для уточнения диагноза и коррекции терапии.
По данным лабораторных исследований, в общем анализе крови отмечено снижение уровня гемоглобина (Нb) до 117 г/л, увеличение СОЭ до 68 мм/ч, повышение С-реактивного белка до 10 мг/л; в биохимическом анализе крови – снижение уровня железа до 7,2 ммоль/л, умеренная белково-энергетическая недостаточность (гипопротеинемия до 58 г/л и гипоальбуминемия до 33 г/л). Сданы анализы крови на онкомаркеры: отмечено повышение раково-эмбрионального антигена до 9 нг/мл (норма 0–5,0 Ед/мл), СА-19-9 до 37,3 Ед/мл (норма 0–30 Ед/мл).
По данным УЗИ органов брюшной полости и кишечника выявлены признаки функционирующих стентов ободочной кишки (поперечной-ободочной, нисходящей ободочной), умеренно выраженных воспалительных изменений стенки поперечно-ободочной и нисходящей ободочной кишки.
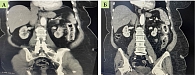
При КТ-энтерографии с внутривенным контрастированием в области установленных стентов отмечалось выраженное утолщение стенок толстой кишки, что соответствовало воспалительным изменениям (рис. 1).
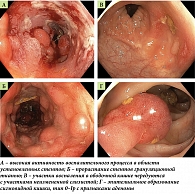
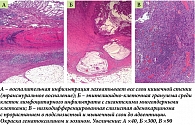
При КС эндоскоп проведен в купол слепой кишки, на осмотренных участках слизистой ободочной кишки признаки сегментарного активного воспаления с эрозированием, наиболее соответствующего болезни Крона, слизистая прямой кишки и терминального отдела подвздошной кишки не изменена, состояние после стентирования непокрытыми нитиноловыми стентами поперечной и нисходящей ободочной кишки с признаками изъязвления в области стентов, прорастание стентов грануляционной тканью с сохранением просвета кишки, эпителиальные образования слепой, восходящей и сигмовидной кишки с признаками аденом (рис. 2).
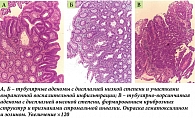
По результатам морфологического исследования биопсийного материала, взятого при КС, получены данные о хронических воспалительных изменениях стенок толстой кишки в пораженных отделах, а также диагностирована тубулярная аденома высокой степени активности с признаками стромальной инвазии, аденома с низкой степенью дисплазии. Однако дифференцировать воспалительное заболевание кишечника по данным гистологического исследования не представлялось возможным (рис. 3).
С учетом тяжелого течения заболевания, выявленной при морфологическом исследовании дисплазии проведен общебольничный консилиум в составе ведущих специалистов МКНЦ им. А.С. Логинова, сформулирован клинический диагноз: «Недифференцированный колит, впервые выявленный, тяжелой степени, высокой активности». Принято решение о проведении на первом этапе хирургического лечения.
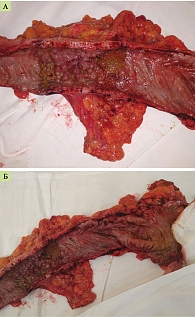
23 июня 2021 г. выполнено оперативное вмешательство в объеме субтотальной колэктомии с формированием концевой илеостомы. Интраоперационно: свободной жидкости в брюшной полости не выявлено. Печень, желудок, тонкая кишка гладкие, блестящие, без патологических изменений. Ободочная кишка отечная, местами дилатирована, истончена. В области нисходящей ободочной, а также поперечно-ободочной кишок визуализированы максимально уплотненные, отечные участки, в которых пальпаторно определяются металлические стенты. Терминальный отдел подвздошной кишки без признаков воспаления или отека (рис. 4).
По данным морфологического исследования операционного материала визуализированы участки трансмурального воспаления с формированием щелевидных язв и эпителиоидно-клеточных гранулем с гигантскими многоядерными клетками. Отмечалась также гиперплазия нейронов межмышечных нервных ганглиев и встречались участки пилорической метаплазии. Комплекс этих морфологических изменений позволил верифицировать у пациентки болезнь Крона. Кроме того, в операционном материале были выявлены гистологические признаки низкодифференцированной слизистой аденокарциномы с прорастанием в мышечный слой до адвентиции (рис. 5).
Таким образом, согласно результатам гистологического исследования операционного материала, впервые установлен диагноз: «Болезнь Крона в форме колита, впервые выявленная, тяжелой степени, высокой активности, осложненная формированием стриктур ободочной кишки от 04.2021». Операции: субтотальная колэктомия с формированием концевой илеостомы от 23.06.2021. Рак поперечной ободочной кишки рT2N0M0 G2.
Пациентка консультирована онкологом – полихимиотерапевтическое лечение в настоящее время не показано, рекомендовано наблюдение онколога по месту жительства.
В послеоперационном периоде была проведена терапия препаратами 5-аминосалициловой кислоты 4 г в сутки; антибактериальная терапия; коррекция водно-электролитных, метаболических нарушений; назначены препараты железа, превентивная антикоагулянтная терапия. Пациентка выписана под наблюдение онколога, гастроэнтеролога, хирурга по месту жительства. Рекомендовано контрольное обследование через 6 месяцев.
Обсуждение
Согласно мировым клиническим исследованиям, второй пик заболеваемости ВЗК приходится на пожилой возраст (60–74 года) [8].
С учетом нетипичного течения заболевания в пожилом возрасте, сопутствующих заболеваний, повышенного риска хирургических осложнений пациентам данной группы показано мультидисциплинарное ведение с участием специалистов: гастроэнтеролога, колопроктолога, нутрициолога, ревматолога, фтизиатра, кардиолога.
Все пациенты с ВЗК нуждаются в скрининге колоректального рака (КРР) [9]. Само начало ВЗК в пожилом возрасте не связано с дополнительным повышенным риском КРР, хотя время между началом ВЗК и диагнозом КРР у пожилых пациентов, по-видимому, короче. Таким образом, следует проводить скрининг КРР пациентов с ВЗК в пожилом возрасте как можно раньше. По результатам морфологического исследования биоптатов толстой кишки у пациентки Д. выявлена дисплазия низкой и высокой степени в нескольких фрагментах, лабораторно – незначительное повышение онкомаркеров, а также имелся высокий риск хирургических осложнений (перфорация) в связи с ранее установленными стентами. Таким образом, принято решение на первом этапе о проведении хирургического лечения с последующим гистологическим исследованием операционного материала для уточнения диагноза.
В ГКБ им. В.В. Вересаева при выявлении сужений в области поперечной и нисходящей ободочной кишки врачами принято решение об эндоскопической установке самораскрывающихся стентов. Однако с учетом наличия у пациентки воспалительного заболевания кишечника, согласно рекомендациям Европейской организации по изучению язвенного колита и болезни Крона (European Crohn's and Colitis Organization – ECCO), установка стентов нецелесообразна [10, 11]. Установка колоректального стента может быть произведена при злокачественных новообразованиях толстой кишки как с паллиативной целью, так и для предоперационной подготовки [12].
Согласно результатам гистологического исследования биоптатов слизистой оболочки толстой кишки, при КС дифференцировать ЯК и БК не представлялось возможным. По морфологическому исследованию операционного материала в связи с наличием участков трансмурального воспаления и формированием глубоких щелевидных язв и эпителиоидно-клеточных гранулем с гигантскими многоядерными клетками был выставлен диагноз «болезнь Крона в форме колита».
Данное клиническое наблюдение демонстрирует трудности дифференциальной диагностики осложненного течения БК толстой кишки у пожилого пациента. У каждого пациента с БК независимо от возраста необходимо учитывать риски послеоперационных рецидивов, к которым, по данным российских клинических рекомендаций, относятся: курение, пенетрирующий фенотип, перианальные поражения, предшествующие резекции кишки, резекция протяженного сегмента тонкой кишки (более 50 см), раннее начало заболевания [13, 14]. В зависимости от количества и сочетания факторов риска пациенты должны быть стратифицированы в группы риска. Больные, имеющие два и более факторов, относятся к группе высокого риска послеоперационного рецидива. У пациентки Д. определен низкий риск рецидива БК, однако по жизненным показаниям ей рекомендована длительная противорецидивная терапия.
Терапия, применяемая в более молодых возрастных группах, подходит и пожилым пациентам, но должное внимание необходимо уделять также побочным эффектам и лекарственным взаимодействиям. Сложности ведения пациентов пожилого возраста с ВЗК заключаются в коморбидности, полипрагмазии, ограничениях в возможности назначения длительной иммуносупрессивной терапии. Так, при назначении иммуносупрессоров из группы тиопуринов повышается риск развития онкологических заболеваний и панцитопении. По данным метаанализа А. Kandiel и соавт., риск лимфомы у пациентов с ВЗК, получавших азатиоприн и 6-меркаптопурин, был увеличен в четыре раза [15]. Иммуносупрессивная терапия, особенно в сочетании с другими лекарствами, и пожилой возраст связаны с повышенным риском оппортунистических инфекций, включая туберкулез [16, 17]. В многоцентровом клиническом исследовании пожилые пациенты имели более высокий риск инфекций, злокачественных новообразований и смертности по сравнению с молодой группой при использовании генно-инженерных биологических препаратов (ГИБП) из группы ингибиторов фактора некроза опухоли (ФНО) альфа – инфликсимаба и адалимумаба [18]. Таким образом, пациентке Д. в связи с пожилым возрастом, наличием в анамнезе онкологического заболевания (аденокарцинома толстой кишки) крайне нежелательно назначение иммуносупрессивной терапии тиопуринами, ГИБП из группы анти-ФНО-альфа.
В качестве противорецидивной терапии пациентке Д. наиболее предпочтительно применение ГИБП с благоприятным профилем безопасности – ингибитора ИЛ-12/ИЛ-23 (устекинумаба) или блокатора интегринов альфа-4-бета-7 (ведолизумаба) [20, 21].
Ведолизумаб – гуманизированное моноклональное антитело класса IgG-1, селективно блокирует взаимодействие α4-β7-интегрина с молекулами клеточной адгезии слизистой оболочки адрессином-1 (MAdCAM-1).
В отличие от ведолизумаба молекула устекинумаба имеет уникальный механизм действия класса ингибиторов ИЛ-12/23, обусловленный блокированием ключевых регуляторных цитокинов, обеспечивает эффективность системного и безопасность селективного биологического препарата [22]. Профиль безопасности устекинумаба в отношении риска возникновения инфекций, в том числе туберкулеза, и малигнизации сопоставим с плацебо и препаратами селективного механизма действия и остается благоприятным на протяжении длительного времени [23, 24].
При выборе между устекинумабом и ведолизумабом представляется важным отметить, что устекинумаб ингибирует путь активации как Th1-клеток, так и Th17-клеток, прерывая внутриклеточную и нижележащую передачу сигналов ИЛ-12 и ИЛ-23, и, как следствие, эффективен как при ранней болезни Крона, так и на поздних стадиях заболевания. Ведолизумаб ингибирует только путь активации Th1-клеток, поэтому может быть эффективен преимущественно в ранней фазе БК (6–10 недель) [25].
Следовательно, устекинумаб представляется более предпочтительным в данной клинической ситуации.
Заключение
Таким образом, приведенное клиническое наблюдение демонстрирует осложненное течение БК с поражением толстой кишки в пожилом возрасте. Необходимо помнить, что специфического маркера ВЗК не существует – диагноз устанавливается на основании анализа совокупности данных (клинических, эндоскопических, рентгенологических и морфологических). Своевременная диагностика ВЗК обеспечивает лучшие результаты лечения, снижает риск развития колоректального рака и хирургических осложнений.
N.A. Fadeeva, PhD, G.B. Artykova, A.Yu. Filimonov, D.S. Filina, N.S. Vidyaeva, S.M. Chudnykh, PhD, Prof, O.V. Knyazev, PhD, Prof., S.G. Khomeriki, PhD, Prof., K.A. Nikolskaya, PhD, D.S. Bordin, PhD, Prof., A.I. Parfenov, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Scientific Research Institute of Healthcare and Medical Management of the Moscow City Health Department
Ryzhikh National Medical Research Centre for Coloproctology
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver State Medical University
Contact person: Nina A. Fadeeva, chuevana@mail.ru
The clinical case of a complicated course of Crohn's disease (CD) in an elderly patient is presented. The article reflects thefeatures of the diagnosis, tactics of conservative and surgical treatment of CD. Timely diagnosis of colorectal cancer (CRC) in an elderly patient with CD also demonstrated.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.