Диагностика субклинического атеросклероза у больных с СПКЯ и возможности лечебного воздействия метформина
- Аннотация
- Статья
- Ссылки

При СПКЯ часто выявляются компоненты метаболического синдрома (МС) – абдоминальное ожирение, дислипидемия (ДЛП), инсулинорезистентность (ИР) и нарушения толерантности к глюкозе (НТГ). Подобные нарушения предполагают возрастание риска развития как сахарного диабета (СД) типа 2, так и кардиоваскулярных заболеваний, в частности, атеросклероза. Его диагностика основывается на биохимических показателях – нарушении соотношения липидов с транспортными белками и повышении маркеров системного воспаления, высокочувствительного С-реактивного белка (вчСРБ), интерлейкина-6 (ИЛ-6), фактора некроза опухоли-a (ФНО-a). Следует заметить, что частая ассоциация СПКЯ с ДЛП, ИР доказана большим числом научных исследований (1, 2, 3, 4), тогда как вопрос взаимосвязи синдрома с субклиническим воспалением остается дискуссионным (5, 6, 7, 8). Хотя при висцеральном ожирении и ИР, которые характерны для больных с СПКЯ, вполне логично предположить повышение уровня провоспалительных цитокинов. Воспаление сосудистой стенки способствует отложению липидов, дестабилизации атеросклеротической бляшки и развитию атеротромботических осложнений.
Доклиническая диагностика кардиосклероза возможна путем оценки морфофункционального состояния сосудистой стенки сонных артерий и определения толщины интима-медиа (ТИМ). Результаты, приведенные на страницах научных журналов, неоднозначны. Одни авторы указывают на увеличение ТИМ у женщин с СПКЯ в репродуктивном возрасте (9, 10), другие утверждают, что подобные изменения выявляются лишь после 45 лет (11, 12).
Принимая во внимание высокую частоту ГА, сопряженную с различными метаболическими нарушениями, с середины 90-х годов для лечения СПКЯ с успехом используются инсулиносенситайзеры (ИС), в частности, метформин (Глюкофаж). Эта группа препаратов позволяет корректировать эндокринно-метаболические нарушения, что способствует регуляции менструального цикла и восстановлению фертильности более чем у половины больных (1, 13). В последние годы появились публикации о положительном эффекте этих препаратов на факторы воспаления, в виде снижения уровня вчСРБ на 30% (L. Morin-Papunen), а по некоторым данным, в 3-4 раза (E.D. Kandarakis, I. Tarkun). Однако авторы расходятся во мнениях относительно механизмов воздействия бигуанидов на маркеры воспаления и функциональное состояние эндотелия (13, 14, 15). Относительно небольшое число работ по изучению маркеров атеросклероза у больных с СПКЯ и еще меньшее число исследований, посвященных влиянию на них гормональной и негормональной терапии, при сохраняющейся тенденции к росту и омоложению ССЗ дают основания к проведению научных исследований в этом направлении.
Целью исследования явилось изучение маркеров субклинического атеросклероза у больных с СПКЯ и оценка реакции на терапию ИС.
Материал и методы
В исследование были включены 59 женщин с СПКЯ в возрасте от 18 до 37 лет (средний возраст 23,3 ± 2,2 лет), с массой тела 61,9 ± 14,7 кг (средний ИМТ 24,9 ± 4,4 кг/м2). Избыточный вес имели 12 (20,3%) больных, ожирение I степени – 3 (5,1%), ожирение II степени – 3 (5,1%). Для всех больных были характерны нарушения менструального цикла, которые у 49 (83,1%) больных проявлялись олигоменореей, у 10 (16,9%) – вторичной аменореей. Во всех случаях отмечалось увеличение объема яичников (средний объем левого яичника составил 18,5 ± 3,3 см3, правого – 17,8 ± 2,6 см3). Диагностика СПКЯ проводилась согласно рекомендациям, предложенным в 2003 г. Объединенным конгрессом Европейского общества репродукции человека и Американского общества репродуктивной медицины (16).
Критериями исключения являлось отсутствие на момент исследования острого инфекционного процесса, отмена приема лекарственной терапии, в том числе гормональной, гипотензивной и гиполипидемической, в течение последних 3 месяцев. Группу контроля составили 20 здоровых женщин, подобранных по весу и возрасту (средний возраст 29,5 ± 3,3 лет, средняя масса тела 68,3 ± 3,9 кг), с регулярным менструальным циклом и отсутствием признаков ГА.
Протокол исследования включал динамическую оценку (исходно и через 6 месяцев терапии) антропометрических параметров (масса тела, ИМТ, ОТ, ОБ, ОТ/ОБ) и композиционного состава тела при помощи двухэнергетической рентеген-абсорбциометрии (ДРА) на аппарате фирмы «Lunar» с использованием программы «Total body» (США). На 2-4-й день самостоятельного или индуцированного менструального цикла радиоиммунными методами проводилось определение содержания гормонов в сыворотке крови: лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), тестостерон-эстрадиолсвязывающего глобулина (ТЭСГ), общего тестостерона (Т), эстрадиола (Е2), 17-оксипрогестерона (17-ОН), дегидроэпиандростерон сульфат (ДГЭА-С). Производился расчет индекса свободных андрогенов (ИСА) по формуле Т ´ 100/ТЭСГ. До и после терапии проводилась трансвагинальная эхография органов малого таза на аппарате фирмы «Aloka-SSD 650» (Япония). ГИ выявлялась на основе результатов перорального 2-часового ГТТ с 75 г глюкозной нагрузки. Уровни глюкозы и ИРИ определялись натощак, а также каждые 30 минут в течение последующих двух часов исследования. Количественная оценка гликемических и инсулиновых ответов на глюкозную нагрузку проводилась расчетным путем по величинам молярных площадей (S) под соответствующими секреторными кривыми, рассчитанными по трапециевидному правилу. О наличии ИР судили по индексам HOMA (глюкоза натощак (ммоль/л) ´ ИРИ натощак (мкЕД/мл)/22,5) и Caro (глюкоза натощак (ммоль/л) / ИРИ натощак (мкЕД/мл)). НТГ диагностировались согласно рекомендациям ADF от 2005 г. (17).
Липидный спектр крови оценивали по основным показателям, характеризующим обмен и транспорт липидов: общему холестерину (ХС), ТГ, ХС ЛПВП, ХС ЛПНП, ХС ЛПОНП, коэффициенту атерогенности (КА), уровню аполипопротеинов А1 и В (апоА1, апоВ), коэффициенту апоВ/апоА1, уровню ЛП(а). Кровь для исследования брали из локтевой вены натощак спустя 12 ч после приема пищи. При анализе данных использовали Европейские рекомендации по профилактике ССЗ в клинической практике от 2005 г. (18).
Сывороточная концентрация вчСРБ оценивалась методом ELISA с использованием сыворотки и реактивов CardioPhase hsCRP (Германия) в лаборатории экспериментальной биохимии ФГУ РКНПК Росмедтехнологий, уровни ИЛ-6 и ФНО-a – методом твердофазного ИФА с помощью коммерческих наборов ООО «Цитокин» (Санкт-Петербург) и «BD Biosciences Pharmingen» (USA) в лаборатории «Invitro» г. Москвы.
Измерение ТИМ общих сонных артерий и выявление атеросклеротических бляшек проводилось с помощью ультразвука высокого разрешения (12 МГц) аппаратом Vivid-7 GE Medical System на базе «Отдела новых методов исследования и диагностики» ФГУ РКНПК Росмедтехнологий.
Пациенткам основной группы после исходного обследования был проведен 6-месячный курс терапии препаратом Глюкофаж (Gkucophage 500, Nycomed, Норвегия) в суточной дозе 1500 мг, в непрерывном режиме.
Статистическая обработка полученных данных выполнена с помощью электронных таблиц Microsoft Excel и пакета прикладных программ Statistica for Windows версия 6, StatSoft Inc (США).
Результаты
Для диагностики начальных стадий атеросклероза у больных с СПКЯ изучалось состояние сосудистой стенки наружных, внутренних, общих сонных, подключичных артерий и брахицефального ствола, включающее измерение ТИМ.
Средняя ТИМ общей сонной артерии справа/слева у женщин с СПКЯ составила 0,51 ± 0,11/0,53 ± 0,16 мм и практически не отличалась от аналогичного показателя в группе контроля (0,50 ± 0,05/0,53 ± 0,06 мм). В 4 (6,8%) случаях было выявлено утолщение сосудистой стенки общей сонной артерии более 0,8 мм. Кроме изменений ТИМ выявлялись и локальные утолщения сосудистых стенок, характерные для начальных стадий образования атеросклеротических бляшек. Такой характер изменений был диагностирован у каждой четвертой больной (23,7%) с СПКЯ. Патологические зоны в стенках артерий представляли собой различные этапы формирования атеросклеротических бляшек: от локального утолщения стенки без нарушения структуры слоев до утолщения с уплотнением и отсутствием дифференциации на слои с признаками шероховатости внутреннего слоя. В ряде случаев имели место уже полностью сформированные атеромы, не стенозирующие сосуд. Подобные изменения локализовались преимущественно в области бифуркации общей сонной артерии. В группе контроля начальные атеросклеротические изменения были выявлены только у одной женщины, что достоверно реже, чем в основной группе (р < 0,05).
Корреляционный анализ позволил установить прямую взаимосвязь ТИМ с возрастом женщин как в группе с СПКЯ (r = 0,385), так и в группе контроля (r = 0,520), а также с ИМТ (r = 0,410) и ХС (r = 0,350) у больных с СПКЯ.
Полученные данные указывают на существенные изменения количественного и качественного состава липидов и липопротеидов у больных с СПКЯ по сравнению с группой контроля (р < 0,05). При отсутствии достоверных различий по средним уровням общего ХС было выявлено значимое увеличение средних значений атерогенных фракций липидов: ТГ – на 37,5%, ЛПОНП – на 22,2%, наряду с достоверным снижением антиатерогенных ЛПВП на 19,5% относительно аналогичных показателей группы контроля. Это повлекло за собой повышение КА в 1,5 раза в основной группе по сравнению с контрольной (р < 0,05). Параллельно выявлено повышение соотношения белковых компонентов – апопротеинов (апо) на треть в основном за счет возрастания концентрации апоВ. Определение сывороточного уровня ЛП(а) у больных с СПКЯ показало двукратное его повышение в сравнении с группой контроля (р < 0,05).
Частота ДЛП среди больных с СПКЯ составила 57,6%, в том числе изолированная гиперхолестеринемия (IIа тип) – 35,3%, гипоальфалипопротеидемия – 20,6% и гипертриглицеридемия (IV тип) – 3,4%. Проведение корреляционного анализа позволило выявить положительные корреляции ИМТ с ХС, ТГ, ЛПОНП, АпоВ и В/А1 (r = 0,321, r = 0,520, r = 0,468, r = 0,448, r = 0,484, р < 0,05) и отрицательные – с ЛПВП и АпоА1 (r = –0,395, r = –0,446, р < 0,05). Взаимосвязь яичниковых андрогенов и липидного обмена проявлялась наличием прямой зависимости между ИСА и уровнями ХС, ТГ, ЛПОНП (r = 0,305, r = 0,577, r = 0,585, р < 0,05) и обратной – с уровнем ХС ЛПВП (r = –0,369, р < 0,05). Менее тесная взаимосвязь определялась между липидами и концентрацией половых стероидных гормонов. Удалось выявить лишь отрицательную корреляцию ЛПВП с уровнями Т, Тсв., БдТ и А (r = –0,311, r = –0,369, r = –0,312, r = –0,389, р < 0,05) и положительную с уровнем Е2 (r = 0,307, р < 0,05).
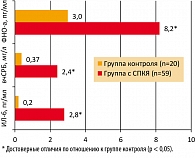
Согласно протоколу исследования, проведена оценка основных маркеров хронического воспаления. В клинической практике сывороточный уровень вчСРБ, превышающий 3,0 мг/л, рассматривается как признак хронического вялотекущего воспалительного процесса. Исходя из этих критериев, 20 (33,9%) пациенток имели субклиническое воспаление. Средний показатель вчСРБ у больных с СПКЯ примерно в 6 раз превышал таковой у здоровых женщин (рисунок 1). Повышенные значения ФНО-a (> 8,1 пг/мл) были обнаружены у 24 (40,7%) больных, средний показатель был выше контрольных значений примерно в 2,5 раза. Сывороточное содержание ИЛ-6 ни в одном случае, как в основной, так и в контрольной группе, не превышало референтных значений (> 4,1 пг/мл). Вместе с тем в группе больных с СПКЯ средний показатель оказался выше, чем в контрольной группе почти в десять раз.
Корреляционный анализ выявил прямую взаимосвязь вчСРБ, ИЛ-6, ФНО-a с общим количеством жировой ткани (r = 0,372, r = 0,402, r = 0,356) и ее содержанием в области туловища (r = 0,411, r = 0,426, r = 0,399), а также с уровнем ИРИ на фоне ГТТ (r = 0,354), ТГ (r = 0,344) и обратную – с ЛПВП (r = –0,493). В группе больных с повышенным уровнем Т выявлялась прямая зависимость вчСРБ от уровня ЛГ/ФСГ и Т (r = 0,324, r = 0,287, соответственно) и отрицательная – от уровня Е2 (r = –0,323).
Как уже указывалось, для коррекции эндокринно-метаболических нарушений больным был проведен 6-месячный курс терапии Глюкофажем. Установлено выраженное влияние на антропометрические показатели: масса тела больных в среднем снизилась на 3,2 ± 1,0 кг; ОТ, ОБ и ОТ/ОБ соответственно на 2,5 см (3%), 6,5 см (6,5%), 0,06 (7,4%). Достоверно уменьшились относительные показатели содержания общей массы жировой ткани (на 9,9% от исходных значений) во всех отделах, отмечалось более благоприятное ее перераспределение за счет уменьшения андроидного жира, что подтверждает достоверное понижение индекса A/G с 0,93 ± 0,05 до 0,89 ± 0,05.
Проведенное лечение оказывало положительное влияние на липидный спектр крови. Данные, представленные в таблице, свидетельствуют о том, что к концу 6-го месяца терапии достоверно снизилось среднее содержание общего ХС и повысилось содержание ХС ЛПВП, что ассоциировалось с уменьшением КА в 1,2 раза. Уровни ТГ и ХС ЛПОНП уменьшились соответственно на 19% и 31,6%. На фоне лечения на 13,3% снизился индекс АпоВ/АпоА1, как за счет повышения содержания АпоА1, так и снижения АпоВ. Была выявлена обратная корреляционная зависимость снижения уровня ХС от возраста пациенток (r = –0,326) и прямая – от степени коррекции уровня стимулированного ИРИ на фоне терапии (r = 0,463). Коррекция липидных показателей сопровождалась снижением частоты ДЛП в виде преимущественного уменьшения гиперхолестеринемии (на 32,4%).
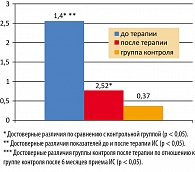
Выявлено положительное влияние Глюкофажа на маркеры хронического системного воспаления. Средний уровень вчСРБ понизился в 1,5 раза с 2,4 ± 0,9 до 1,8 ± 0,8 мг/л, но достоверные отличия от показателя группы контроля сохранялись (p < 0,05) (рисунок 2). Частота повышенных уровней вчСРБ существенно не изменилась (до лечения – 33,9%, после – 28,8%).
Одновременно наблюдалась положительная тенденция в сывороточных уровнях провоспалительных цитокинов. Так, несмотря на отсутствие достоверных различий в средних уровнях ФНО-a до и после лечения (с 8,2 до 2,7 пг/мл), число больных, имеющих повышенные значения данного показателя, снизилось с 24 (40,7%) до 18 (30,5%). Средние концентрации ИЛ-6 за время лечения Глюкофажем не изменились (2,8 ± 0,3 и 2,6 ± 0,4 пг/мл).
Шестимесячный курс ИС существенно не отразился на средних значениях ТИМ общих сонных артерий (после терапии средняя ТИМ составила 0,51 ± 0,12/0,52 ± 0,18 мм). Также не изменилось число больных, имеющих утолщение сосудистой стенки.
Обсуждение
Вопрос о факторах риска и частоте возникновения кардиоваскулярных заболеваний среди больных с СПКЯ не имеет однозначной трактовки, хотя в последние годы вектор научных исследований значительно сместился в сторону изучения взаимосвязи этих патологических состояний. Ведущая роль в развитии атеросклероза и формировании сердечно-сосудистых рисков традиционно отводится нарушениям метаболизма и транспорта липидов, которые, по мнению большинства авторов, характерны и для больных СПКЯ независимо от ИМТ (15, 19). Частота ДЛП среди больных с СПКЯ составила 57,6%, что соответствует данным большинства публикаций о высокой частоте липидных нарушений у этой категории больных. Как и следовало ожидать, в структуре ДЛП доминируют изолированная гиперхолестеринемия (35,3%), гипоальфалипопротеидемия (20,6%). Эти изменения в сочетании с ИР могут приводить к повышенной восприимчивости ЛПНП к перекисной модификации и последующему фагоцитозу макрофагами с образованием пенистых клеток – одному из ключевых моментов в патогенезе атеросклероза.
Данные корреляционного анализа указывают на то, что развитие ДЛП при СПКЯ сопряжено как с негативным воздействием андрогенов, так и с избыточным содержанием жировой ткани и ИР. Хотя имеются публикации, в которых не выявлено участие ГА в развитии нарушений метаболизма липидов при СПКЯ (4). Нам представляется интересной позиция E. Talbott (1998) и D. Cibula (2000) относительно риска развития ССЗ у женщин с СПКЯ. По их мнению, несмотря на возрастное «стирание» различий липидного профиля женщин с СПКЯ с ранее здоровыми пациентками вследствие развития ДЛП в пери- и постменопаузе, при СПКЯ наблюдается более длительное воздействие ДЛП на сосудистую стенку, которое может способствовать их большей подверженности ССЗ.
С современной точки зрения, значительная роль в патофизиологии атеросклеротического процесса и развитии кардиоваскулярных заболеваний отводится фактору воспаления (10, 12, 20, 21). Маркеры воспаления, такие как вчСРБ и ИЛ-6, рассматриваются в качестве предикторов ССЗ и СС катастроф (7, 15). Мы знакомы с публикациями, в которых приводятся данные о повышенном содержании вчСРБ и ИЛ-6 в сыворотке крови больных с СПКЯ, однако они, как правило, были выполнены на женщинах с ИР, ГИ и высокими ИМТ. В ряде работ, где были обследованы больные без ожирения и ГИ, не указывается на наличие достоверных различий по этим показателям и высказывается предположение о зависимости концентрации провоспалительных маркеров лишь от метаболических параметров. В нашей работе получены данные о значительном повышении маркеров воспаления (вчСРБ в 5-6 раз, ИЛ-6 – в 11 раз и ФНО-a – в 2 раза) в группе больных с СПКЯ относительно здоровых женщин. Превышение нормативных значений вчСРБ наблюдалось в 20 (33,9%) случаев, ФНО-a – в 24 (40,7%), тогда как показатели ИЛ-6 были в пределах референтных границ. Полученные в работе данные подтверждают тесную взаимосвязь вчСРБ, ИЛ-6, ФНО-a с общим количеством жировой ткани и ее содержанием в области туловища, в меньшей степени с уровнем Т и Е2. Провоспалительные цитокины могут повышать риск раннего развития атеросклероза посредством стимулирующего влияния на печеночный синтез холестерина, через механизмы воздействия на чувствительность к инсулину, стимуляцию липолиза в адипоцитах и целый ряд других путей.
Важным этапом диагностики атеросклероза является изучение морфофункционального состояния сосудистой стенки сонных артерий и определение ТИМ. Следует заметить, что исследования, в которых приводятся данные об увеличении ТИМ сонных артерий у больных с СПКЯ, чаще выполнены на выборках больных более старшей возрастной группы с повышенными значениями ИМТ (12). В исследовании, сопоставимом с нашим по возрасту и ИМТ больных, ни в одном случае авторами не выявлено повышенных значений ТИМ, хотя средние уровни данного показателя оказались более высокими при СПКЯ, чем в группе контроля. По результатам нашего исследования, достоверных различий по средним значениям ТИМ между основной и контрольной группой не обнаружено, у 6,8% больных диагностировано утолщение стенки общей сонной артерии. Увеличение ТИМ коррелирует с биохимическими маркерами атеросклероза (повышенными уровнями апоВ/А1, ЛП(а), вчСРБ, ФНО и пониженными уровнями ЛПВП), которые используются в качестве предикторов формирования атеросклеротического процесса. С нашей точки зрения, важным представляется тот факт, что, в отличие от группы здоровых женщин, у каждой четвертой (23,7%) больной с СПКЯ уже в молодом возрасте имеются локальные изменения сосудистой стенки, свидетельствующие о начальных этапах развития атеросклероза.
Принимая во внимание ассоциацию СПКЯ с факторами риска ССЗ, необходимо не только информировать больных о высокой вероятности развития этих заболеваний, но и проводить комплекс лечебно-профилактических мероприятий, направленных на их модификацию. Многочисленные данные о положительном эффекте ИС на эндокринно-метаболические параметры больных с СПКЯ и имеющиеся сведения об их возможном позитивном влиянии на факторы риска атеросклероза послужили основанием для назначения Глюкофажа – лекарственного средства из группы бигуанидов, использование которого, по разным данным, позволяет достичь регуляции менструального цикла у 50-75% больных (1). Данное исследование было сфокусировано на изучении воздействия препарата на традиционные факторы риска атеросклероза, маркеры воспаления и состояние ТИМ. После 6-месячного курса терапии масса тела больных снизилась в среднем на 3,5 ± 1,2 кг, отмечено более благоприятное распределение жировой ткани. Подобное влияние Глюкофажа нам известно (13, 22), хотя препарат и не предназначен для лечения ожирения. На фоне приема Глюкофажа отмечена положительная динамика липидных показателей, в большей степени проявляющаяся достоверным снижением уровня ХС, повышением ЛПВП и уменьшением апоА/апоВ, что в совокупности указывает на снижение атерогенного потенциала крови. Если подобное влияние Глюкофажа было вполне ожидаемым, поскольку ранее уже было продемонстрировано в большом числе исследований (13, 20), то выраженная положительная динамика маркеров хронического воспаления, отмеченная после 6 месяцев терапии, оказалась несколько неожиданной. Терапия Глюкофажем ассоциировалась со снижением маркеров воспаления, что может быть связано с уменьшением количества жировой ткани, степени выраженности ИР и ГА (23). После лечения существенно уменьшилось число больных с повышенными уровнями вчСРБ, ФНО-a и ИЛ-6. Хотя достоверных различий средних показателей за 6 месяцев лечения достичь и не удалось, отмечалась четкая тенденция к их нормализации. Можно полагать, что проведение более длительного курса терапии позволит получить более значимые результаты. Локальные утолщения стенок сосудов, как и ТИМ, не претерпели значительных изменений за время лечения. Это указывает на то, что процесс формирования атеросклеротических бляшек следует предупреждать на более ранних этапах. Для этого необходимо проводить адекватное обследование, позволяющее выявить больных, имеющих предикторы формирования атеросклероза.
Таким образом, СПКЯ характеризуется не только нарушениями репродуктивной системы, но и повышенным риском развития атеросклероза, о чем свидетельствует высокая частота ДЛП, повышение уровней вчСРБ и ФНО-a и формирование атеросклеротических бляшек, выявленное в каждом четвертом случае. Глюкофаж, наряду с коррекцией клинических проявлений СПКЯ, обладает антиатерогенным эффектом посредством положительного влияния на липидный спектр крови, массу тела и маркеры системного воспаления, что должно учитываться при выборе терапии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.