Дифференцированный подход к диагностике резистентного гиперактивного мочевого пузыря у женщин
- Аннотация
- Статья
- Ссылки
- English

Актуальность проблемы
В современной медицинской литературе все чаще встречается термин «резистентный гиперактивный мочевой пузырь» (ГМП). Это состояние характеризуется сохранением симптоматики после проведения лечения более чем двумя М-холиноблокаторами и тренировки мочевого пузыря дольше года [1]. При резистентном ГМП достаточно сложно подобрать адекватную терапию. Это, возможно, связано с недостаточной изученностью механизмов патогенеза данного симптомокомплекса, при котором важную роль играет персистенция инфекции в слизистой мочевого пузыря. Так, в пилотном исследовании, проведенном N. Rodhe и соавт., у 34% пациенток с резистентным ГМП была обнаружена бактериурия ≥ 103 КОЕ/мл [2]. Хроническое воспаление мочевого пузыря сопровождается инфильтрацией стенки мочевого пузыря мононуклеарами (макрофагами, лимфоцитами, тучными и плазматическими клетками), которая приводит к необратимым изменениям в его тканях: фиброзу, гиперактивности детрузора и гипералгезии [3].
Слизистая оболочка мочевого пузыря, постоянно подвергающаяся растяжению и сокращениям, покрыта уротелием, который содержит многочисленные рецепторы и уроплакины и выполняет защитную функцию [4, 5]. В структуре уротелия имеется слой гликозаминогликан-хондроитинсульфатов, гиалуроната натрия, гликопротеинов и муцинов для защиты от повреждающих факторов и предотвращения адгезии уропатогенов. Повреждение уротелия сопровождается кровоизлиянием и продукцией цитокинов, запускающих пролиферацию и активацию тучных клеток [6–9].
В последнее время как в отечественной, так и в зарубежной литературе большое внимание уделяется изучению цитокинов – биологически активных веществ белковой природы, выполняющих медиаторные функции в развитии ряда патологических процессов, в том числе воспаления. Некоторые цитокины, в частности интерлейкин (ИЛ) 1-бета, ИЛ-8, фактор некроза опухоли альфа, имеют доказанную провоспалительную активность. Повышение их концентрации в крови и биологических жидкостях является маркером воспалительного процесса. Так, ИЛ-8, секретируемый клетками мочевого пузыря и почек, играет важную роль в активации миграции нейтрофилов при внедрении уропатогенов [10, 11]. Пик экспрессии большинства цитокинов и хемокинов достигается примерно через 24 часа после внедрения уропатогена и возвращается к исходным показателям через две недели [11].
ИЛ-8 относится к СХС-хемокинам и является мощным хемотаксическим и активирующим фактором для нейтрофилов. Это самый ранний провоспалительный цитокин, продуцируемый многими клетками, включая моноциты, макрофаги, Т-клетки, нейтрофилы, фибробласты, эндотелиальные клетки, кератиноциты, гепатоциты, астроциты и хондроциты. Наряду с другими цитокинами ИЛ-8 участвует в процессах стимуляции и дегрануляции лейкоцитов, ангиогенезе, способствует миграции фагоцитов в очаг воспаления. Некоторые авторы акцентируют внимание на диагностическом значении ИЛ-8 при инфекциях урогенитального тракта [6, 8, 9, 11]. Повышение концентрации ИЛ-8 в моче может свидетельствовать не только о воспалении при хроническом цистите, но и о латентном воспалении у пациентов с резистентным ГМП. В алгоритм обследования пациенток с ГМП целесообразно включать определение уровня ИЛ-8 для выбора оптимальной и эффективной патогенетически обоснованной терапии [12].
Следует отметить, что появляется все больше данных, подтверждающих инфекционную этиологию резистентного ГМП. R.K. Khasriya и соавт. впервые установили, что внутриклеточная бактериальная колонизация может быть причиной ГМП [13], позже это подтвердили и другие исследователи.
В настоящее время в качестве биомаркера ГМП также предлагается рассматривать фактор роста нервов в моче (м-ФРН) – нейротрофический фактор, продуцируемый уротелием и гладкомышечными клетками [14–18]. Хроническое воспаление сопровождается повышением секреции м-ФРН у пациентов с ГМП и детрузорной гиперактивностью, приводящим к морфологическим изменениям в системе чувствительных и двигательных нейронов мочевого пузыря и, следовательно, к детрузорной гиперактивности [19–21]. Считается, что м-ФРН играет ключевую роль в корреляции между воспалением и болевой импульсацией, так как он продуцируется клетками уротелия, гладкомышечными и тучными клетками. При этом м-ФРН активирует их дегрануляцию и пролиферацию [14]. Повышенный уровень м-ФРН обнаружен при таких заболеваниях, как ГМП, интерстициальный цистит и простатит [10, 15–18]. Уровень м-ФРН может играть важную роль во взаимосвязи между субуротелиальными чувствительными волокнами и гиперчувствительностью детрузора [10, 15, 16]. Кроме того, м-ФРН также является медиатором в модуляции уротелиального ответа на воспаление и порога восприятия ургентности.
H.T. Liu и соавт. исследовали уровень ФРН в сыворотке крови и моче 34 пациенток, страдающих резистентным ГМП. Было выявлено значительное повышение уровня м-ФРН по сравнению с контрольной группой (n = 31). Не было обнаружено значимых различий в уровне м-ФРН среди женщин с ГМП, которые не отмечали непроизвольную утечку мочи вследствие императивного позыва, и среди тех, у кого заболевание сопровождалось императивным недержанием мочи. После трехмесячного курса лечения солифенацином уровень м-ФРН оставался стабильно высоким, вследствие чего авторы предположили, что резистентный ГМП может быть вызван хронической инфекцией [18].
Учитывая вышесказанное, нами было проведено исследование с целью изучения роли маркеров воспаления и пролиферации (ИЛ-8 и м-ФРН) в диагностике резистентного ГМП.
Материал и методы
В проспективное рандомизированное сравнительное открытое исследование было включено 79 пациенток: 32 женщины с подтвержденным диагнозом «резистентный ГМП» и 47 женщин с диагнозом «хронический неспецифический бактериальный цистит». С использованием таблицы случайных чисел была проведена блочная рандомизация, в результате которой пациентки были разделены на четыре группы.
В первую группу вошли 19 женщин с хроническим циститом. Им был проведен курс антибактериальной терапии с учетом чувствительности микроорганизма. В течение десяти дней семь (36,8%) пациенток получали левофлоксацин по 500 мг/сут внутрь, 11 (57,9%) – цефиксим по 400 мг/сут внутрь. Одна (5,3%) женщина в течение семи дней принимала фосфомицина трометамол 3 г внутрь однократно в сочетании с нитрофурантоином по 100 мг два раза в день (в связи с наличием микст-инфекции и разной чувствительности микроорганизмов). Далее им производились четыре внутрипузырные инстилляции гиалуроната натрия по одной процедуре в неделю.
Вторую группу составили 28 женщин с хроническим циститом, которым был проведен только десятидневный курс антибактериальной терапии с учетом чувствительности микроорганизма. 11 (39,3%) пациенток принимали левофлоксацин по 500 мг/сут внутрь и 16 (57,1%) – цефиксим по 400 мг/сут внутрь. Одна (3,6%) пациентка получала фосфомицина трометамол по 3 г внутрь дважды в сутки (в связи с резистентностью выделенного патогенного организма к цефалоспоринам).
Пациенткам третьей группы (17 женщин с резистентным ГМП) также сначала была проведена комплексная терапия антибактериальными препаратами в течение десяти дней. Семи (41,2%) пациенткам был назначен левофлоксацин по 500 мг/сут внутрь, десяти (58,8%) – цефиксим по 400 мг/сут внутрь. Далее они прошли курс из четырех внутрипузырных инстилляций гиалуроната натрия.
В четвертой группе 15 женщин с резистентным ГМП получали только десятидневный курс антибактериальной терапии с учетом чувствительности микроорганизма. Шесть (40%) пациенток принимали левофлоксацин по 500 мг/сут внутрь и девять (60%) пациенток – цефиксим по 400 мг/сут внутрь.
Пациенткам первой и третьей групп (n = 36) был назначен курс из четырех внутрипузырных введений раствора гиалуроната натрия по 50 мл один раз в неделю. После самостоятельного опорожнения мочевого пузыря и обработки наружных половых органов 0,2%-ным раствором Октенисепта проводили катетеризацию мочевого пузыря стерильным уретральным катетером, затем вводили раствор гиалуроната натрия. Пациенткам не рекомендовалось опорожнять мочевой пузырь в течение одного-двух часов для увеличения экспозиции препарата. Состояние пациенток оценивалось в динамике: исходно, через две недели (визит 2), шесть (визит 3) и 12 (визит 4) месяцев после лечения.
Для количественного определения концентрации м-ФРН и ИЛ-8 было отобрано 313 образцов мочи. Из них 80 образцов мочи пациенток контрольной группы, не имевших в анамнезе и на момент проведения исследования заболеваний урогенитального тракта и признаков инфекции мочевыводящих путей по данным экспресс-теста, а также образцы в исследуемых группах: 79 до начала терапии, 79 через две недели после лечения (второй визит) и 75 (4 пациентки выбыли) через 6 месяцев после лечения (третий визит). Забор мочи осуществлялся в стерильную пробирку объемом 10 мл, после чего полученные биообразцы на льду в течение 15–20 минут доставлялись в лабораторию. Образцы центрифугировались в течение десяти минут при 3000 об/мин и температуре 4 °С. Для хранения супернатанты разливали в пробирки типа Эппендорф по 1 мл, хранили до анализа при температуре -80 °С.
Для количественного определения м-ФРН использовали набор Human beta-NGF ELISA (RayBio, США), ИЛ-8 в моче – набор реагентов для иммуноферментного определения концентрации ИЛ-8 в сыворотке крови и моче («Вектор-Бест», Россия). Измерение оптической плотности в обоих случаях проводилось с помощью планшетного спектрофотометра Expert plus (Австрия).
При описании полученных результатов определяли среднее арифметическое (М), ошибку среднего (m), среднее квадратичное отклонение (σ), частоту встречаемости качественных признаков (%, доли единицы), асимметрию и эксцесс с их ошибками, моду, медиану, квантили и 10-й, 90-й перцентили. Показатели асимметрии и эксцесса позволили оценить характер распределения, в первую очередь соответствие норме.
Достоверность различий между группами по количественным признакам оценивали с помощью непараметрических критериев Краскала – Уоллиса и Манна – Уитни. Для определения различий между номинальными показателями (%) использовали критерий согласия Пирсона (хи-квадрат) и точный критерий Фишера для малых выборок. В случае последовательных измерений показателей мочи одного и того же пациента – критерии Фридмана и Т-критерий Вилкоксона для парных случаев, а также критерий Мак-Немара. Различия между сравниваемыми величинами признавались значимыми при р < 0,05. Учитывался эффект множественных сравнений.
Результаты
Концентрация ИЛ-8 в моче
Измерение концентрации ИЛ-8 в моче имеет диагностическое значение при инфекциях урогенитального тракта [4, 6, 7, 9]. Мониторинг содержания ИЛ-8 в моче позволяет оценить степень выраженности воспалительного процесса. Вследствие чего этот показатель был выбран для оценки эффективности проводимого лечения у пациенток с резистентным ГМП и хроническим циститом по сравнению со здоровыми женщинами и в динамике.
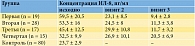
Было установлено, что у пациенток с хроническим циститом уровень ИЛ-8 в моче был в 2,4 раза выше, чем у пациенток контрольной группы, а у пациенток с резистентным ГМП в 1,7 раза (р < 0,05). Был сделан вывод о наличии и ведущей роли воспалительного компонента не только при хроническом цистите, но и при резистентном ГМП (табл. 1).
Статистически значимых различий между группами в результате проведения внутрипузырных инстилляций гиалуронатом натрия не выявлено. Отсутствие статистически значимых результатов в данном случае связано с небольшим количеством пациенток в группах.
Через две недели, а также через шесть месяцев после проведенной терапии у всех пациенток была повторно определена концентрация ИЛ-8 в моче (табл. 1). На момент второго и третьего визитов было выявлено статистически значимое снижение концентрации ИЛ-8 в моче пациенток исследуемых групп по сравнению с исходными данными.
Отмечена статистически значимая положительная динамика концентрации ИЛ-8 у пациенток с хроническим циститом, в то время как у пациенток с резистентным ГМП статистически значимой разницы не обнаружено, но наблюдалась тенденция к уменьшению уровня ИЛ-8. Данный факт может быть обусловлен недостаточностью проведенной антибактериальной терапии и терапии гиалуронатом натрия, снижением эффективности последнего с течением времени.
В первой группе концентрация ИЛ-8 в моче снизилась в шесть раз (с 59,5 ± 5 до 9,4 ± 2,8 пг/мл), во второй в 4,7 раза (с 53,3 ± 16 до 11,3 ± 3,8 пг/мл), в третьей в 3,9 раза (с 45,4 ± 12,5 до 11,7 ± 3,2 пг/мл) и в четвертой в 1,6 раза (с 32,5 ± 9,9 до 20,5 ± 6,9 пг/мл) (р < 0,01). Таким образом, в первой и третьей группах эффективность проведенной терапии оказалась статистически значимо выше, чем во второй и четвертой. Такие результаты, вероятно, связаны с проведением курса терапии гиалуронатом натрия, способствующей восстановлению поврежденного слоя уротелия.
При проведении корреляционного анализа также была обнаружена слабая прямая зависимость между концентрацией ИЛ-8 и количеством лейкоцитов в моче (r = 0,25, p < 0,05). Было отмечено: концентрация ИЛ-8 увеличивается также при повышении лейкоцитов в моче и наличии более одного полового партнера, что еще раз подтверждает инфекционно-воспалительный генез заболеваний.
Концентрация м-ФРН
Для ГМП характерно увеличение уровня ФРН в ткани мочевого пузыря и в образцах мочи, поэтому определение уровня м-ФРН может рассматриваться в качестве значимого биомаркера для диагностики и мониторирования прогрессирования ГМП. В многочисленных исследованиях также обсуждается использование показателей м-ФРН в качестве маркера воспаления.
В данном исследовании средние значения м-ФРН были нормированы на концентрацию креатинина в моче. Формула: м-ФРНн = м-ФРН : креатинин.
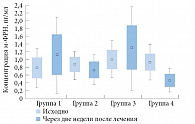
При оценке полученных данных установлено, что концентрация м-ФРН до лечения в группах пациенток статистически значимо не различалась (табл. 2), что может подтверждать наше предположение о роли воспалительной реакции как при резистентном ГМП, так и при хроническом цистите. Отсутствие различий данного биомаркера, возможно, свидетельствует об одинаковой степени выраженности процесса в тканях при указанных состояниях.
Сравнительный анализ уровня м-ФРН после лечения в исследуемых группах также не выявил статистически значимых различий.
При этом в первой и третьей группах была отмечена тенденция к увеличению экспрессии м-ФРН, в остальных группах – наоборот, к уменьшению. В некоторых исследованиях показано, что экспрессия м-ФРН увеличивается при воспалительных заболеваниях, при которых м-ФРН может играть роль ингибитора воспалительного процесса [22]. Однако при сравнительной суммарной оценке динамики изменения концентрации м-ФРН статистически значимых различий между группами не выявлено (рисунок).
При проведении корреляционного анализа Спирмена была обнаружена слабая прямая зависимость между концентрацией м-ФРН и длительностью заболевания (r = 0,27, p < 0,05), а также умеренная прямая зависимость между концентрацией м-ФРН и количеством рецидивов в год после лечения (r = 0,34, p < 0,05). Таким образом, чем длительнее период заболевания, тем выше концентрация м-ФРН и тем больше количество рецидивов.
Обсуждение
По нашему мнению, целесообразным является включение определения концентрации ИЛ-8 в моче в перечень обследования пациенток. По результатам проведенного исследования, в исследуемых группах уровень ИЛ-8 в моче был в два раза выше, чем в контрольной группе. Это позволило нам сделать вывод о ведущей роли воспалительного компонента не только при хроническом цистите, но и при резистентном ГМП.
В многочисленных исследованиях обсуждается м-ФРН в качестве маркера воспаления [15–18]. При анализе собственных результатов относительно концентрации м-ФРН до лечения в группах пациенток значимых различий не отмечалось, что может подтверждать наше предположение о роли воспалительной реакции при резистентном ГМП, как и при хроническом цистите. Можно также констатировать: чем длительнее период заболевания, тем выше концентрация м-ФРН и тем больше количество рецидивов после проведенного лечения. Таким образом, определение уровня м-ФРН можно рассматривать как значимый биомаркер для диагностики и мониторирования прогрессирования ГМП, а также прогнозирования эффективности лечения хронического цистита.
При сравнительной оценке концентрации ИЛ-8 до и после лечения в группах с хроническим циститом была отмечена статистически значимая положительная динамика. Несмотря на то что у пациенток с резистентным ГМП также наблюдалась тенденция к уменьшению уровня ИЛ-8, статистически значимой разницы не зафиксировано. Данный факт может быть обусловлен недостаточностью курсов антибактериальной терапии и терапии гиалуронатом натрия, снижением эффективности последнего с течением времени.
В группах пациенток, которым проводилась комбинированная терапия, эффективность лечения оказалась статистически значимо выше, что, вероятно, обусловлено проведением курса терапии гиалуронатом натрия, который восстанавливает поврежденный слой уротелия.
Однако при анализе изменения концентрации м-ФРН в первой и третьей группах, в комплекс терапии которых входили четыре внутрипузырные инстилляции гиалуроната натрия, обнаружена тенденция к увеличению экспрессии м-ФРН, во второй и четвертой группах (без назначения инстилляций гиалуроновой кислоты) – к уменьшению. В некоторых исследованиях показано, что экспрессия м-ФРН увеличивается при воспалительных заболеваниях, при которых м-ФРН играет роль ингибитора воспаления [22].
Таким образом, включение внутрипузырных инстилляций гиалуроната натрия в комплексную терапию хронического цистита и резистентного ГМП значительно повышает эффективность лечения. Комбинированная терапия должна проводиться поэтапно и быть патогенетически обоснованной. Первый этап – десятидневный курс антибактериальной терапии. Выбор антибиотика осуществляется согласно чувствительности выделенного микроорганизма по данным культурального исследования мочи и наличия урогенитальной инфекции при исследовании отделяемого уретры методом полимеразной цепной реакции. Второй этап – курс внутрипузырных введений раствора гиалуроната натрия по 50 мл раз в неделю (от четырех до пяти введений). В связи с тем что данная терапия недостаточно купирует некоторые симптомы резистентного ГМП (ургентность, количество мочеиспусканий), необходимо использовать дополнительные методы лечения на следующих этапах: длительный прием М-холиноблокаторов, нейростимуляция, тренировка мочевого пузыря и мышц тазового дна и др.
Вывод
Определение маркеров воспаления и пролиферации (ИЛ-8 и м-ФРН) может быть рекомендовано для использования в качестве биомаркеров для диагностики и мониторирования прогрессирования резистентного ГМП, а также прогнозирования эффективности терапии как хронического цистита, так и резистентного ГМП.
На начальном этапе ведения пациенток и с резистентным ГМП, и с хроническим циститом необходимо проведение патогенетически обоснованной комбинированной терапии, состоящей из десятидневного курса антибактериальной терапии и четырех-пяти внутрипузырных инстилляций гиалуроната натрия.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.