Динамика клинико-нейрофизиологических показателей при диабетической полиневропатии на фоне метаболической терапии
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведен анализ результатов лечения 50 пациентов с сахарным диабетом второго типа и ДПН, которые были распределены на две группы: основную (n = 30) и контрольную (n = 20). Всем пациентам проводилась базисная сахароснижающая терапия. Кроме того, пациенты основной группы получали комбинированный метаболический препарат, содержащий никотинамид, кокарбоксилазу, цианокобаламин и трифосаденина динатрия тригидрат, внутримышечно по 2 мл один раз в сутки. Курс терапии составил 18 инъекций, продолжительность наблюдения – девять недель. Выраженность неврологических нарушений оценивалась с использованием Общей оценки симптомов невропатии (Total Symptom Score – TSS), Шкалы невропатических симптомов (Neuropathy Symptom Score – NSS), Шкалы невропатического дисфункционального счета (Neuropathy Disability Score – NDS), Визуальной аналоговой шкалы (ВАШ). Кроме того, для оценки состояния периферического нейромоторного аппарата проводили стимуляционную электронейромиографию до и после лечения.
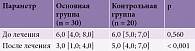
Результаты и их обсуждение. В основной группе после девятой инъекции выраженность симптоматики ДПН снизилась у 43,3 ± 17,7% пациентов, а после 18-й инъекции – у 86,6 ± 12,2%. Уменьшился уровень болевого синдрома по ВАШ (р < 0,001). Кроме того, отмечалось статистически значимое улучшение состояния больных по данным TSS (р < 0,001), NSS (р = 0,004), NDS (р = 0,0001). На девятой неделе наблюдения регистрировались статистически значимые электронейромиографические изменения: снижение латентного периода (р = 0,096, р = 0,047), увеличение амплитуды (р = 0,065, р = 0,059) и скорости распространения возбуждения по n. peroneus (р = 0,020). Был определен уровень фактора роста эндотелия сосудов в сыворотке крови больных обеих групп в динамике. Достоверных изменений данного показателя на фоне проводимой терапии не зафиксировано.
Материал и методы. Проведен анализ результатов лечения 50 пациентов с сахарным диабетом второго типа и ДПН, которые были распределены на две группы: основную (n = 30) и контрольную (n = 20). Всем пациентам проводилась базисная сахароснижающая терапия. Кроме того, пациенты основной группы получали комбинированный метаболический препарат, содержащий никотинамид, кокарбоксилазу, цианокобаламин и трифосаденина динатрия тригидрат, внутримышечно по 2 мл один раз в сутки. Курс терапии составил 18 инъекций, продолжительность наблюдения – девять недель. Выраженность неврологических нарушений оценивалась с использованием Общей оценки симптомов невропатии (Total Symptom Score – TSS), Шкалы невропатических симптомов (Neuropathy Symptom Score – NSS), Шкалы невропатического дисфункционального счета (Neuropathy Disability Score – NDS), Визуальной аналоговой шкалы (ВАШ). Кроме того, для оценки состояния периферического нейромоторного аппарата проводили стимуляционную электронейромиографию до и после лечения.
Результаты и их обсуждение. В основной группе после девятой инъекции выраженность симптоматики ДПН снизилась у 43,3 ± 17,7% пациентов, а после 18-й инъекции – у 86,6 ± 12,2%. Уменьшился уровень болевого синдрома по ВАШ (р < 0,001). Кроме того, отмечалось статистически значимое улучшение состояния больных по данным TSS (р < 0,001), NSS (р = 0,004), NDS (р = 0,0001). На девятой неделе наблюдения регистрировались статистически значимые электронейромиографические изменения: снижение латентного периода (р = 0,096, р = 0,047), увеличение амплитуды (р = 0,065, р = 0,059) и скорости распространения возбуждения по n. peroneus (р = 0,020). Был определен уровень фактора роста эндотелия сосудов в сыворотке крови больных обеих групп в динамике. Достоверных изменений данного показателя на фоне проводимой терапии не зафиксировано.




Введение
В настоящее время во всем мире отмечается неуклонный рост заболеваемости сахарным диабетом (СД), что обусловлено увеличением численности населения и его постарением. По экспертной оценке Международной федерации диабета, в 2015 г. СД страдали уже 415 млн человек. Согласно предварительным прогнозам, к 2030 г. число пациентов с диагностированным СД во всем мире составит 520 млн, а к 2040 г. вырастет до 642 млн [1].
Особая социальная значимость СД второго типа связана с его поздними осложнениями, в частности невропатией. Диабетическая полиневропатия (ДПН) – комплекс клинических и субклинических синдромов, которые характеризуются диффузным или очаговым поражением периферических нервных волокон и/или волокон автономной нервной системы в результате СД. Это самое частое осложнение СД, которое встречается у 15–100% пациентов (в зависимости от методов диагностики) [2].
Наиболее распространена дистальная симметричная полиневропатия, которая развивается у 1/3 пациентов с СД. Заболевание сопровождается невропатическим болевым синдромом и приводит к снижению качества жизни [3].
В патогенезе ДПН главными звеньями считаются микроангиопатия и тканевая гипоксия, активизация полиолового шунта, дефицит миоинозитола, гликирование белков и окислительный стресс, дефицит эндотелиального релаксирующего фактора, дефицит альфа-липоевой кислоты [4, 5], а также витамина В12, который приводит к нарушению обмена гомоцистеина [6, 7]. Повышенный уровень гомоцистеина рассматривается как предиктор ДПН у больных СД второго типа. Y. Feng и соавт. [8] установили, что гипергомоцистеинемия выявлялась только у пациентов с поздними осложнениями СД, в то время как у людей без микроциркуляторных нарушений уровень гомоцистеина не отличался от нормы. Эти данные указывают на необходимость применения при СД второго типа витамина В12 (цианокобаламина).
Микроваскулярные нарушения, обусловливающие развитие ДПН при СД второго типа, напрямую связывают с недостатком витамина В1 (тиамина). Биологически активная форма тиамина – кокарбоксилаза, кофермент пируватдекарбоксилазы, альфа-кетоглутаратдегидрогеназы и транскетолазы, участвующих в окислительном и неокислительном декарбоксилировании альфа-кетокислот (пировиноградной и альфа-кетоглутаровой) и обмене альфа-кетосахаров. Кокарбоксилаза защищает эндотелий сосудов в условиях гипергликемии [9].
В последние годы большое значение придают новому патогенетическому механизму ДПН – активации поли(АДФ-рибоза)-полимеразы (Poly (ADP-Ribose) Polymerase – PARP). PARP – суперсемейство ферментов, катализирующих поли-АДФ-рибозилирование. Наиболее известен фермент PARP1, участвующий в репарации повреждений дезоксирибонуклеиновой кислоты и ремоделировании хроматина за счет поли-АДФ-рибозилирования гистонов. PARP1 препятствует запуску процесса апоптоза, а каспазы инактивируют PARP1, предотвращая ее репарацию. Семейство PARP вовлечено также в процессы повреждения нервных тканей при окислительном стрессе в условиях гипергликемии, в частности через расщепление никотинамидадениндинуклеотида, образование свободных никотинамида и АДФ-рибозы, которые присоединяются к ядерным и внеядерным (например, митохондриальным) белкам. Активация PARP приводит к снижению уровня никотинамидадениндинуклеотида, истощению резервов энергии, ингибированию гликолиза, нарушению транскрипции генов и в итоге к некрозу клеток. Именно поэтому применение ингибиторов PARР1 рассматривается как дополнительный метод лечения больных с ДПН. Никотинамид (витамин РР) является ингибитором PARP1 и обладает антиоксидантным действием [10].
Одной из характерных особенностей ангиогенеза считается способность макрофагов мигрировать в необходимом направлении, определяемом градиентом концентрации фактора роста эндотелия сосудов (Vascular Endothelial Growth Factor – VEGF). VEGF – мультифункциональный цитокин, который представляет собой гомодимерный гликопротеин с молекулярной массой 45 кДа, содержащий 26 аминокислот. Экспрессируется VEGF гладкомышечными клетками сосудов, макрофагами и опухолевыми клетками. VEGF повышает сосудистую проницаемость, стимулирует образование новых кровеносных и лимфатических сосудов. В исследовании J. Waltenberger (2001) показано, что при СД способность макрофагов к направленной миграции нарушается, вследствие чего нарушается процесс новообразования кровеносных сосудов [11].
М.С. Мичурова и соавт. установили, что у больных СД второго типа снижено исходное количество эндотелиальных прогениторных клеток, а также имеет место задержка пикового повышения данного показателя по сравнению с людьми без нарушения углеводного обмена [12].
По данным экспериментальной работы O.Z. Lerman и соавт., у мышей с индуцированным СД фибробласты, которые отвечают за заживление ран, экспрессируют VEGF в семь раз хуже, чем фибробласты у здоровых особей. Под воздействием гипоксии экспрессия VEGF не увеличивается, следствием чего становятся плохое заживление ран при СД и более затяжной период выздоровления при ишемических повреждениях. Таким образом, повышение VEGF скорее связано с процессом атеросклероза, однако СД, способствуя прогрессированию атеросклероза, также влияет на уровень VEGF [13].
Лечение ДПН должно быть комплексным и предусматривать использование лекарственных средств, повышающих ремиелинизацию, снижающих метаболические нарушения функции нерва и влияющих на разнообразные звенья патогенеза [14–16]. В связи с этим при ДПН целесообразно применять многокомпонентные лекарственные средства, содержащие такие действующие вещества, как никотинамид, кокарбоксилаза, цианокобаламин и трифосаденина динатрия тригидрат [10].
Никотинамид – компонент ферментов кодегидразы I и II, принимающих участие в окислительно-восстановительных процессах. Кодегидраза II задействована также в переносе фосфата. В отличие от никотиновой кислоты никотинамид не оказывает значительного вазодилатационного действия, поэтому не вызывает гиперемии кожи и ощущения прилива крови к голове.
Кокарбоксилаза входит в состав фермента карбоксилазы, катализирующей карбоксилирование и декарбоксилирование альфа-кетокислот, способствует образованию ацетил-кофермента А, регулирует метаболизм углеводов, улучшает трофические процессы в нервной ткани.
Цианокобаламин (витамин В12) – комплексное соединение, имеющее в основе цикл коррина и содержащее координационно-связанный ион кобальта. Цианокобаламин играет важную роль в обмене аминокислот и синтезе ацетилхолина, а также образовании миелиновой оболочки нервного волокна. Как известно, высокие дозы цианокобаламина улучшают проведение возбуждения по периферическим нервам и их структурно-функциональную регенерацию.
Трифосаденина динатрия тригидрат – производное аденозина, стимулирует метаболические процессы, препятствует преждевременному окислению компонентов препарата. Кроме того, усиливает синтез пуринергических соединений, принимающих активное участие в функционировании антиноцицептивной системы, что определяет его анальгетический эффект.
Лекарственное средство, содержащее никотинамид, кокарбоксилазу, цианокобаламин и трифосаденина динатрия тригидрат, выпускается в виде лиофилизата для приготовления раствора для внутримышечного введения, что обеспечивает более высокую биодоступность его компонентов и скорость их включения в метаболические процессы, снижает вероятность развития синдрома мальабсорбции [17]. Синергизм компонентов препарата обеспечивает быстрый клинический эффект и совместимость с основными антидиабетическими лекарственными средствами [18]. Эффективность и безопасность этого метаболического лекарственного препарата в лечении пациентов с ДПН были продемонстрированы в ряде клинических исследований [19–25].
Цель исследования
Оценить влияние комбинированного метаболического препарата на динамику клинико-нейрофизиологических показателей у пациентов с ДПН на фоне сахарного диабета второго типа.
Материал и методы
В 2017 г. проведено клиническое исследование на базе дорожной клинической больницы на станции Красноярск ОАО «РЖД» и городской поликлиники № 7 Красноярска [26]. В исследовании приняли участие 50 пациентов с СД второго типа, осложненным ДПН. Пациенты были распределены на две группы – основную (n = 30) и контрольную (n = 20). У пациентов основной группы лечение было дополнено лекарственным препаратом, содержащим никотинамид, кокарбоксилазу, цианокобаламин и трифосаденина динатрия тригидрат, по следующей схеме: внутримышечно по 2 мл один раз в сутки на протяжении девяти дней, а затем – на 12, 15, 18, 21, 24, 27, 30, 33 и 36-й дни. Курс терапии составил 18 инъекций, продолжительность наблюдения – девять недель. Дизайн исследования предполагал четыре визита. Первый визит – подписание информированного согласия и включение в исследование, второй – после девятой инъекции препарата, третий – после 18-й инъекции, четвертый – на девятой неделе наблюдения.
Критериями исключения из исследования были имеющиеся у пациентов при поступлении:
- противопоказания к применению лекарственного препарата, содержащего никотинамид, кокарбоксилазу, цианокобаламин и трифосаденина динатрия тригидрат, согласно инструкции;
- тяжелая сопутствующая соматическая патология;
- гиперкоагуляция;
- воспалительные заболевания легких;
- коллагенозы;
- тяжелая почечная и печеночная недостаточность;
- беременность;
- лактация;
- нестабильное течение СД второго типа.
Проводился анализ медицинской документации всех пациентов, их жалоб. Пациенты прошли стандартное терапевтическое обследование по общепринятой методике, включая вычисление индекса массы тела (ИМТ) по формуле Кетле: ИМТ = масса тела (кг)/рост (м2).
Пациентам выполнялись лабораторные исследования: клинический, биохимический анализ крови, клинический анализ мочи, анализ суточной мочи на белок, определение концентрации глюкозы в крови и уровня гликозилированного гемоглобина.
Определение уровня VEGF проводили путем твердофазного иммуноферментного анализа по стандартному протоколу с использованием набора Human VEGF Quantikine ELISA на спектрофотометре Thermo Scientific Multiskan FC (ThermoFisher Scientific Inc., Финляндия). Диапазон измерения 62,5–4000 пг/мл (0,0625–4 нг/мл). Чувствительность 20 пг/мл (0,02 нг/мл).
Во время всех визитов регистрировалось неврологическое состояние больных с использованием Общей оценки симптомов невропатии (Total Symptom Score – TSS), Шкалы невропатических симптомов (Neuropathy Symptom Score – NSS), Шкалы невропатического дисфункционального счета (Neuropathy Disability Score – NDS), Визуальной аналоговой шкалы (ВАШ). TSS в клинической практике, как правило, применяется для оценки степени ДПН по интенсивности наиболее часто встречающихся жалоб. NDS считается лучшей шкалой для определения риска возникновения синдрома диабетической стопы (чем больше сумма баллов, тем выше риск) [27]. Сумма баллов по NDS соответствует тяжести сенсомоторных нарушений, где 0–4 балла – норма, 5–13 баллов – умеренная полиневропатия, 14–28 баллов – выраженная полиневропатия [28].
С целью изучения состояния периферического нейромоторного аппарата пациентам выполняли стимуляционную электронейромиографию с анализом проведения по моторным волокнам периферических нервов на четырехканальном электромиографе Нейро-МВП-4 (Россия) с помощью поверхностных отводящих и стимулирующих электродов. Оценивали состояние моторных волокон малоберцового нерва. Анализировали амплитуду моторного ответа (М-ответ), скорость распространения возбуждения, дистальную латентность. За норму принимались:
- амплитуда М-ответа малоберцового нерва – не менее 3 мВ;
- скорость распространения возбуждения по моторным волокнам периферических нервов нижних конечностей – не ниже 40 м/с;
- дистальная латентность для малоберцового нерва – 4 м/с [29].
Полученные данные статистически обрабатывали с помощью программного пакета IBM SPSS Statistics 19. Точность распределения количественных признаков оценивали с помощью W-теста Шапиро – Уилка. Все количественные данные не подчинялись закону нормального распределения. В связи с этим они представлены в виде медианы, а также первого и третьего квартилей. Статистическую значимость различий между двумя группами по количественным признакам определяли с помощью U-критерия Манна – Уитни, а по номинальным признакам – критерия хи-квадрат. Для оценки связи между количественными признаками использовался коэффициент корреляции Спирмена. Полученные результаты считались статистически значимыми при уровне менее 0,05 (р < 0,05).
Результаты и их обсуждение
Все пациенты, включенные в исследование, имели клинические проявления ДПН (табл. 1). В основной группе на фоне терапии выраженность симптомов ДПН после девятой инъекции снизилась у 43,3 ± 17,7% пациентов, а после 18-й инъекции – у 86,6 ± 12,2%. Кроме того, после курса лечения у пациентов основной группы статистически значимо уменьшилась выраженность боли по ВАШ (р < 0,001) (табл. 2).
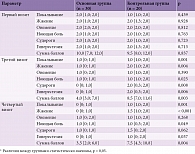
Анализ динамики невропатической симптоматики по TSS показал, что у пациентов, получавших комбинированный препарат, к четвертому визиту отмечалось статистически значимое улучшение (табл. 3). Статистически значимая положительная динамика в основной группе после 18 инъекций препарата (третий визит) и на девятой неделе наблюдения (четвертый визит) также выявлена и по NSS (табл. 4).
На первом визите средний балл по NDS в основной группе составил 16,5 [12,9; 22,0], в контрольной группе – 16,8 [13,3; 21,8], что соответствует выраженной степени невропатии. На фоне метаболической терапии на девятой неделе наблюдения средний балл по NDS статистически значимо уменьшился до 12,0 [10,0; 18,5] (р < 0,0001), что соответствовало умеренной степени невропатии. В контрольной группе, несмотря на проводимую базисную сахароснижающую терапию, у пациентов имела место выраженная степень невропатии – 13,5 [9,9; 19,3] (табл. 5).
По результатам проведенной электронейромиографии, у пациентов обеих групп регистрировались признаки аксонального поражения, что обнаруживалось значимым уменьшением амплитуды М-ответа при умеренном снижении скорости распространения возбуждения, а также увеличением латентности при проведении нервного импульса по ходу малоберцового нерва. У пациентов основной группы на четвертом визите регистрировалось статистически значимое снижение латентного периода (р = 0,096, р = 0,047), а также увеличение амплитуды (р = 0,065, р = 0,059) и скорости распространения возбуждения по n. peroneus (р = 0,020). В динамике при электронейромиографии у 85,40 ± 16,44% пациентов основной группы на девятой неделе наблюдения отмечалось уменьшение клинических (субъективных) проявлений ДПН, таких как судороги, онемения, боли в икроножных мышцах, чувство жжения стоп по ночам и парестезии (табл. 6).
Выявленная способность к восстановлению нервных волокон и улучшению нервной проводимости на девятой неделе наблюдения у пациентов основной группы позволяет предположить положительный эффект компонентов изучаемого метаболического препарата.
При корреляционном анализе результатов электронейромиографии установлена отрицательная связь между амплитудой М-ответа n. peroneus и длительностью СД второго типа (r = -0,4001, p = 0,004), интенсивностью боли по ВАШ (r = -0,392, p = 0,004), уровнем HbA1c (r = -0,2796, p = 0,0492), а также суммой баллов по TSS (r = -0,3918, p = 0,004), NSS (r = -0,3566, p = 0,011), NDS (r = -0,4047, p = 0,003). Сумма баллов по NSS и TSS была обратно пропорциональна показателям скорости распространения возбуждения по n. peroneus: r = -0,3254 (p = 0,021) и r = -0,3383 (p = 0,016) соответственно.
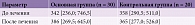
Был определен уровень VEGF в сыворотке крови больных обеих групп в динамике (табл. 7). Статистически значимых изменений данного показателя на фоне проводимой терапии не зафиксировано, но выявлена достоверная обратная связь этого показателя с длительностью СД второго типа (r = -0,246, р = 0,022), возрастом пациентов (r = -0,218, р = 0,042) и уровнем липопротеинов низкой плотности (r = -0,274, р = 0,01).
В ходе исследования не зафиксировано ни одного случая возникновения побочных реакций при применении изучаемого метаболического средства.
Заключение
По результатам сравнительного анализа клинико-электрофизиологических показателей на фоне приема препарата, содержащего никотинамид, кокарбоксилазу, цианокобаламин и трифосаденина динатрия тригидрат, отмечалась статистически значимая положительная динамика по TSS, NSS, NDS и ВАШ. По данным электронейромиографии, у пациентов основной группы на девятой неделе наблюдалось уменьшение выраженности клинических (субъективных) проявлений ДПН. Статистически значимых изменений уровня VEGF не зафиксировано ни в одной из групп, но выявлена достоверная обратная зависимость этого показателя с длительностью заболевания СД второго типа. Выполненный сравнительный анализ статистически достоверно доказал эффективность изучаемого метаболического препарата, имеющего высокий профиль безопасности, в комбинированной терапии ДПН у пациентов с СД второго типа.
I.N. Pashkova, T.V. Potupchik, PhD, I.V. Gatskikh, PhD, A.N. Narkevich, PhD, M.M. Petrova, MD, PhD, Prof., O.F. Veselova, PhD
Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University
Contact person: Tatyana V. Potupchik, potupchik_tatyana@mail.ru
Purpose: studying the dynamics of clinical and neurophysiological indicators during a combined metabolic therapy to patients with diabetic polyneuropathy (DPN) secondary to type 2 diabetes.
Material and methods. Treatment and examination results of 50 patients with type 2 diabetes and DPN were analyzed. Patients have been divided into two groups – a main one (n = 30) and a control one (n = 20). All of the patients have been receiving a basis therapy for low the sugar level, moreover the main group patients have been receiving the cyanocobalamin, niacinamide, cocarboxylase and triphosadenine disodium trihydrate for DPN treatment by injections 2 ml into a muscle once a day. The treatment course included 18 injections and examination time was 9 weeks. The status of dynamics of patients’ neurological disorders was evaluated with Total Symptom Score (TSS), Neuropathy Symptom Score (NSS), Neuropathy Disability Score (NDS), Visual Analogue Scale (VAS). And also stimulation electromyography was performed for evaluation peripheral neuromuscular disturbances before and after the treatment.
Results. Reducing DPN symptoms was registered during the combined metabolic therapy after 9th injection in 43.3 ± 17.7% patients and statistically significant improvement by VAS was registered after 18th injection in 86.6 ± 12.2% patients inversely to control group (p < 0.001). Furthermore a statistically significant improvement was registered during the evaluating score by TSS (р < 0.001), NSS (р = 0.004), NDS (р = 0.0001).
Subsequent to the results of stimulation electromyography of the main group patients statistically significant reducing latent period (p = 0.096, p = 0.047) was registered at the time of 4th visit, and amplitude (р = 0.065, р = 0.059) and nerve conduction velocity in n. peroneus (p = 0.020) improvements were registered either.
The level of vascular endothelial growth factor was evaluated in patients’ blood serum from both groups in dynamics. There weren’t registered reliable changes of this measure during performed therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.