Динамика течения цирроза печени у пациента с острой печеночной недостаточностью на фоне хронической
- Аннотация
- Статья
- Ссылки
- English
![Таблица 1. Оценка органной недостаточности по шкале CLIF-C OF (по [6])](/upload/resize_cache/iblock/232/195_350_1/Taraki1.jpg)
![Алгоритм для использования прогностических шкал EASL-CLIF Consortium у пациентов с ОПН на фоне хронической и без нее (по [7])](/upload/resize_cache/iblock/224/195_350_1/Taraki2.jpg)

Введение
Цирроз печени (ЦП) – это прогрессирующее хроническое заболевание, характеризующееся развитием диффузного фиброза ее паренхимы, серьезным нарушением внутрипеченочного венозного кровотока, портальной гипертензией (ПГ) и печеночной недостаточностью. Течение ЦП характеризуется двумя периодами. Компенсированный цирроз определяется этапом между его началом и первым осложнением. У большинства пациентов в течение этого относительно длительного периода симптомы отсутствуют или минимальные, но с повышением давления в портальной вене и развитием печеночно-клеточной недостаточности постепенно прогрессируют. Декомпенсированный цирроз определяется периодом после появления асцита, инфекции, кровотечения из варикозных вен пищевода и желудка, нарастанием явлений печеночной энцефалопатии (ПЭ), которые являются причинами госпитализации [1].
В последние годы все большее внимание уделяется развитию острой печеночной недостаточности (ОПН) на фоне хронической – состоянию, при котором у пациентов с ЦП возникает отказ от одной до шести систем органов с чрезвычайно высокой 28-дневной летальностью. Данный термин введен еще в начале 2000-х гг. R. Jalan и R. Williams и обозначается в англоязычной литературе как acute-on-chronic liver failure (ACLF) [2].
По данным большого проспективного обсервационного исследования CANONIC Европейской ассоциации по изучению печени (European Association for the Study of the Liver – EASL), 23% пациентов, госпитализированных в стационары с ЦП, уже имеют ОПН на фоне хронической, а у 11% синдром развивается в период госпитализации [3]. Триггерами данного состояния зачастую выступают бактериальные инфекции, активный прием алкоголя в течение предшествующих трех месяцев, вирусы гепатитов, состоявшееся желудочно-кишечное кровотечение (ЖКК), парацентез без контроля и возмещения альбумина, гепатотоксические препараты, оперативные вмешательства и др. Однако у 43,6% пациентов провоцирующий фактор не удается выявить [4]. Установлено, что больные c двумя и более идентифицированными триггерами имеют более высокий риск 90-дневной летальности, чем пациенты с единственным или невыясненным провоцирующим фактором [5]. Органную недостаточность предлагают определять по упрощенной шкале CLIF-C OF (Chronic Liver Failure – Consortium Organ Failure score), основанной на оценке дисфункции шести систем органов (печеночной, почечной, церебральной, коагуляции, сосудистой, дыхательной). Исходя из значений данной шкалы, выделяют две группы пациентов с ЦП: с наличием ОПН на фоне хронической и с острой декомпенсацией (ОД) (табл. 1) [6].
Дальнейшая оценка прогноза осуществляется по шкалам CLIF-C ACLF (Chronic Liver Failure – Consortium Acute-on-chronic Liver Failure score) для пациентов с ОПН на фоне хронической и CLIF-C AD (Chronic Liver Failure – Consortium Acute Decompensation) – у больных с ОД соответственно. Пациенты с ОД со значениями CLIF-C AD менее 45 баллов составляют группу низкого риска (90-дневная летальность – 1,8%); для них возможен вариант наблюдения и лечения в амбулаторных условиях. В то же время больные с показателями CLIF-C AD более 60 составляют группу высокого риска (90-дневная летальность – 31,3%) и им рекомендуются госпитализация и активные диагностические и лечебные мероприятия (рисунок) [7].
В качестве иллюстрации приводим описание клинического случая ОПН на фоне хронической и ее динамики у пациента с декомпенсированным ЦП.
Клиническое наблюдение
Пациент Б. 43 лет, экономист, в феврале 2024 г. был экстренно госпитализирован в гастроэнтерологическое отделение многопрофильного стационара в связи с нарастающей желтухой, увеличением живота в объеме, умеренно выраженной общей слабостью. В анамнезе систематическое употребление крепких алкогольных напитков (виски, коньяк) в гепатотоксичных дозах в течение 12 лет. Последняя алкоголизация – за месяц до поступления в стационар. Диагноз ЦП алкогольной этиологии установлен в 2020 г., когда впервые отметил увеличение живота в объеме.
При осмотре состояние тяжелой степени. Температура тела – 36,7 °C. Тип телосложения – астенический. Рост – 180 см, масса тела – 75 кг. Индекс массы тела – 23 кг/м2. Пациент заторможен, на заданные вопросы отвечает с задержкой, тест связи чисел (ТСЧ) выполнен за 135 с (норма < 40 c). Тяжесть течения ПЭ по шкале West Haven – I–II степень. Кожные покровы желтушной окраски, умеренной влажности, «малые печеночные знаки» – телеангиоэктазии на коже в области плеч и грудной клетки, гинекомастия, пальмарная эритема; атрофия мышц верхнего плечевого пояса, отмечаются симметричные отеки голеней и стоп. Лимфатические узлы не пальпируются. Дыхание в легких везикулярное, число дыхательных движений – 17 в минуту, SpO2 – 97%. Ритм сердца правильный с частотой сердечных сокращений 82 уд/мин, тоны сердца ясные, артериальное давление 100 и 70 мм рт. ст. на обеих руках. Язык влажный, обложен белым налетом. Живот округлой формы, увеличен вследствие асцита, не напряжен, при пальпации чувствителен в правом подреберье. Печень и селезенка пальпации не доступны из-за асцита. Окружность живота – 110 см. Стул регулярный, оформленный, коричневый без патологических примесей. Симптом поколачивания по поясничной области отрицательный с обеих сторон. Мочеиспускание свободное, безболезненное, диурез снижен (750 мл/сут).
В связи с тяжестью состояния пациент помещен в палату интенсивной терапии на базе гастроэнтерологического отделения, где осуществлялся почасовой мониторинг витальных функций.
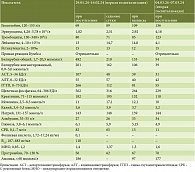
В первые два часа пребывания в стационаре проведены клинико-лабораторные исследования. Основные показания клинико-лабораторных данных представлены в табл. 2.
По данным клинического анализа крови, выявлены анемия смешанной этиологии: фолиеводефицитная, В12-дефицитная тяжелой степени, тромбоцитопения средней степени тяжести и лейкоцитоз со сдвигом лейкоцитарной формулы влево с повышением маркеров воспаления.
В биохимическом анализе крови отмечались гипербилирубинемия преимущественно вследствие неконъюгированной фракции, ретикулоцитоз, коэффициент де Ритиса 2,2, что не исключало синдром Зиве при отсутствии данных за ЖКК и отрицательную прямую пробу Кумбса. Выявлены незначительная гипертрансаминаземия и синдром холестаза, азотемия и водно-электролитные нарушения в виде гиперкалиемии, снижение белково-синтетической функции печени в виде гипоальбуминемии, гипокоагуляция (табл. 2).
Для уточнения степени выраженности ПЭ проведено определение аммиака в капиллярной крови – 186 мкмоль/л (норма < 60 мкмоль/л).
Оценка органной недостаточности проводилась по шкале CLIF-C OF и составила 10; установлена печеночная и почечная недостаточность – ACLF 2 (табл. 3). Оценка летальности произведена по шкале CLIF-C ACLF и составила 46, что свидетельствует о 20%-м риске смерти в течение одного месяца [8].
В связи с нарастанием явлений ПЭ для исключения спонтанного бактериального перитонита (СБП) проведен диагностический парацентез. При цитологическом исследовании пунктата асцитической жидкости выявлен ее культуронегативный нейтрофильный характер (полиморфноядерных лейкоцитов – до 1250 кл/мкл; отсутствует рост микроорганизмов).
При компьютерной томографии органов грудной клетки данных за очаговые и инфильтративные изменения в легких не получено.
С целью выявления ПГ проведены ультразвуковое исследование органов брюшной полости, эзофагогастродуоденоскопия, по данным которых выявлены варикозно расширенные вены пищевода (ВРВП) первой степени, свободная жидкость в брюшной полости, увеличение диаметра воротной вены до 15 мм, селезеночной вены – 10 мм, спленомегалия.
Состояние расценено как ОПН на фоне хронической (ACLF 2) у пациента с алкогольным гепатитом тяжелого течения, холестатический вариант (DF – 43) на фоне ЦП класса С по Чайлду – Пью (12 баллов), MELD (Model for End-Stage Liver Disease) – 30 баллов. Осложнения: ПГ: ВРВП первой степени, спленомегалия, асцит второй степени, печеночно-клеточная недостаточность: ПЭ типа С, персистирующая, второй степени; желтуха; гипоальбуминемия; гипокоагуляция. Спонтанный бактериальный перитонит. Гепаторенальный синдром. Водно-электролитные нарушения. Анемия смешанной этиологии (фолиеводефицитная + В12-дефицитная) легкой степени тяжести.
Пациенту была проведена комплексная терапия. В связи с выраженностью мезенхимально-воспалительного синдрома обсуждался вопрос о назначении глюкокортикостероидной (ГКС) терапии. По данным расчета дискриминантной функции по Maddrey DF – 43, что определило назначение ГКС (преднизолон в дозе 40 мг/сут), гастропротективной терапии (омепразол 40 мг/сут). Также была проведена антибактериальная (метронидазол, ципрофлоксацин), инфузионная, диуретическая терапия (фуросемид, спиронолактон), коррекция анемии (гемотрансфузии, фолиевая кислота, цианокобаламин), гипокоагуляции (трансфузии криопреципитата, свежезамороженной плазмы), гипоальбуминемии (трансфузии 20%-го раствора альбумина).
На седьмые сутки была достигнута стабилизация состояния: адекватный диурез, регресс отечно-асцитического синдрома, явлений ПЭ, улучшение клинико-лабораторных показателей (табл. 3). Ввиду того что индекс Lille составил 0,026, прием ГКС (преднизолон 40 мг/сут) продолжен в течение месяца с последующим постепенным снижением дозы.
Пациент был выписан с улучшением на 18-е сутки с рекомендациями лекарственной терапии на амбулаторном этапе: ГКС, гастропротекторы (эзомепразол 40 мг/сут), диуретики (спиронолактон 200 мг/сут, фуросемид 40 мг/сут через день), гипоаммониемические препараты (орнитин 15 г/сут), препараты нутритивной поддержки, соблюдение низкосолевой диеты и полной абстиненции.
Спустя три недели пациент повторно госпитализирован в гастроэнтерологическое отделение с эпизодом дезориентации, инверсией цикла сна и бодрствования. При сборе анамнеза установлено, что пациент бесконтрольно принимал повышенные дозы диуретиков.
При осмотре состояние средней степени тяжести, отмечено усиление проявлений ПЭ. Лабораторные данные представлены в табл. 2. ТСЧ – 180 с, аммиак капиллярной крови – 177 мкмоль/л (норма < 60 мкмоль/л).
Оценку органной недостаточности проводили по шкале CLIF-C OF – 7, ACLF – 0.
При расчете CLIF-C AD составила 43, что позволяет отнести пациента к группе низкого риска (летальность в течение одного месяца – 1%) и возможности наблюдения и лечения в амбулаторных условиях.
Состояние было расценено как декомпенсация ЦП, характеризующаяся нарастанием ПЭ. На фоне гипоаммониемической терапии, включающей орнитин-аспартат, лактулозу, удалось повторно достичь ее регресса. Через три дня пребывания в стационере пациент был выписан под амбулаторное наблюдение гастроэнтеролога. В динамике через месяц повторных эпизодов дезориентации и других проявлений ПЭ не наблюдалось.
Обсуждение
В клинической практике врача-гастроэнтеролога у пациента с декомпенсированным ЦП нередко наблюдается формирование полиорганной недостаточности. В приведенном нами клиническом случае события развивались иным образом. В период первой госпитализации состояние пациента расценено как ОПН на фоне хронической. Тяжесть заболевания была обусловлена полиорганной недостаточностью (печеночной, почечной) на фоне системного воспаления. В ходе обследования выявлены два провоцирующих фактора – алкоголь и инфекция, проявившаяся СБП, что повышало риски краткосрочной летальности. Однако с помощью своевременной многокомпонентной терапии, направленной на борьбу с органной дисфункцией, удалось достигнуть улучшения состояния пациента.
Причиной второй госпитализации явилась декомпенсация ЦП (CLIF-C AD – 43), проявившаяся в виде нарастания явлений ПЭ. Ввиду того что на фоне проводимой терапии удалось получить регресс энцефалопатии, пациент был выписан с рекомендациями продолжить лечение амбулаторно.
Одним из самых частых осложнений и причин декомпенсации у трети пациентов с ЦП является ПЭ. Затраты, связанные с ПЭ, значительны (11,6 млрд долларов США) [9] и перевешивают иные осложнения, приводящие к декомпенсации ЦП и других хронических заболеваний.
Отношение к целесообразности определения аммиака у пациентов с ПЭ у мировых сообществ по изучению печени различается. Так, Российское общество по изучению печени считает оправданным измерение аммиака с целью (в случаях) дифференциальной диагностики неясной энцефалопатии [10]; Азиатско-Тихоокеанская ассоциация связывает степень прогрессирования ПЭ, тяжесть и смертность от ОПН на фоне хронической с уровнем аммиака крови. Содержание аммиака > 170 мкмоль/л у пациентов с ACLF было ассоциировано с низкой выживаемостью (25%) [9].
Однако, несмотря на то, что показатели аммиака при определении его в капиллярной крови могут быть ниже, чем в венозной, Китайская ассоциация по изучению печени (The Chinese Society of Hepatology – CSH) признает этот метод измерения в качестве альтернативного у пациентов с ЦП, а его преимущества, такие как малоинвазивность, быстрота и удобство выполнения, делают его ценным скрининговым инструментом в клинической практике [11]. ПЭ у пациента в период обеих госпитализаций послужила причиной назначения гипоаммониемической терапии, а повышенные уровни аммиака в капиллярной крови выступили потенциальным предиктором повторной госпитализации.
Заключение
Своевременное выявление и устранение провоцирующих факторов острой печеночной недостаточности на фоне хронической снижают риск развития и прогрессирования полиорганной недостаточности.
Приведенный клинический случай демонстрирует необходимость оценки органной дисфункции у пациентов с ЦП по шкале CLIF-C OF для определения прогноза, маршрутизации, рационального выбора интенсивности и объема терапевтических стратегий на ранних этапах.
Несмотря на то что гипераммониемия является одним из патогенетических звеньев ЦП, определение уровня аммиака как маркера ПЭ в качестве скринингового метода требует дальнейшего исследования. Исследование аммиака имеет важное клиническое значение не только для определения тяжести ПЭ, но и может служить предиктором прогноза и выделения пациентов высокого риска.
B.М. Taraki, I.G. Adamova, M.S. Kurbanova, H. Azizulla, I.G. Fedorov, PhD, L.Yu. Ilchenko, PhD, Prof., I.G. Nikitin, PhD, Prof.
N.I. Pirogov Russian National Research Medical University
V.M. Buyanov Moscow State Clinical Hospital
Shumakov National Medical Research Center of Transplantology and Artificial Organs
Contact person: Breshna M. Taraki, breshna98@mail.ru
The main reason for hospitalization of patients with liver cirrhosis (LC) is acute decompensation (AD), characterized by ascites, increasing of hepatic encephalopathy (HE), gastrointestinal bleeding, and infection. Acute-on-chronic liver failure (ACLF) is a condition in which patients with LC develop failure of 1 to 6 organ systems with extremely high 28-day mortality. To determine the prognosis, select the intensity and volume of therapy, it is recommended to assess organ dysfunction using the CLIF-C OF (Chronic Liver Failure-Consortium Organ Failure score) scale as soon as possible. The aim of the article is to describe a clinical case of ACLF and its dynamics in a patient with decompensated LC (our observation presents two episodes of LC decompensation). During the first decompensation of LC, the triggers were infection and alcohol, and the condition was regarded as ACLF 2 (hepatic and renal failure were established), CLIF-C OF – 10, the risk of death within 1 month – 20%. Complex therapy led to regression of organ dysfunction. Repeated hospitalization was caused by increasing HE with an episode of disorientation due to inadequate intake of diuretics. The ammonia level in capillary blood is 177 µmol/L. The patient's condition was regarded as AD of LC (CLIF-C OF – 7).
The assessment of the risk of death according to the CLIF-C AD (Chronic Liver Failure – Consortium Acute decompensation) scale was 43, which allowed the patient to be assigned to the low-risk group. The analysis of the dynamics of decompensated LC confirms the need to identify provoking factors for the development of AD or ACLF, assess organ dysfunction to determine the prognosis, routing, and rational choice of therapy. Ammonia testing is of great clinical importance for characterizing the severity of HE and can serve as a predictor of a high risk of death.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.