Длительная комбинированная таргетная терапия метастатической меланомы кожи
- Аннотация
- Статья
- Ссылки
- English
Введение
Меланома представляет собой злокачественную опухоль, обычно развивающуюся из клеток, образующих пигмент меланин [1, 2]. Это одна из наиболее агрессивных и непредсказуемых неоплазий, метастазирующих как лимфогенно, так и гематогенно фактически во все органы и ткани.
Несмотря на то что на долю меланомы приходится около 1% диагностированных злокачественных новообразований, она является причиной большинства летальных исходов, обусловленных опухолями кожи. До недавнего времени эффективных вариантов лечения пациентов с распространенной меланомой кожи было немного. Исторически ответ на обычную химиотерапию и иммуномодулирующую терапию (интерлейкин 2 или интерферон-альфа) составлял 5–19% [2]. Новые терапевтические опции включают методы, направленные на генетические мутации в клетках опухоли [3, 4].
Меланома относится к опухолям с высокой мутационной нагрузкой. В большинстве случаев имеют место мутации, связанные с митоген-активируемой протеинкиназой (сигнальный путь MAPK) [4], участвующей в процессах роста, пролиферации и выживания опухолевых клеток. Онкогенную активацию сигнального пути MAPK запускают несколько механизмов. Наиболее распространенный из них – конститутивная активация киназы BRAF. Данная мутация встречается примерно в 40–60% случаев [5].
BRAF кодирует цитоплазматическую серин-треониновую киназу. Более 97% мутаций BRAF локализованы в кодоне 600. Наиболее частая мутация (до 90% случаев) вызвана трансверсией T → A на нуклеотиде 1799 (T1799A), что приводит к замене валина (V) на глутаминовую кислоту (E) в кодоне 600. Менее распространенными считаются замены азотистых оснований: тимина V600K – около 8–20%, аргинина V600R – 1%, лейцина V600M – 0,3%, аспарагиновой кислоты V600D – 0,1% [6].
Меланома с мутацией BRAF имеет отличительные клинические признаки и характеризуется более агрессивным течением по сравнению с меланомой дикого типа (WT) BRAF. Пациенты с мутацией BRAF обычно моложе, чаще имеют гистологический тип поверхностно-распространяющейся либо узловой меланомы, возникающей на анатомических областях без хронического солнечного излучения. Кроме того, опухоли-мутанты BRAF более склонны к метастазированию в головной мозг, чем опухоли BRAF WT. BRAF-мутация при меланоме также ассоциируется с более низкой общей выживаемостью (ОВ) пациентов [7].
Идентификация BRAF-мутации привела к разработке вемурафениба и дабрафениба, селективных ингибиторов BRAF-киназы с акитивирущими мутациями в кодоне V600, а также траметиниба и кобиметиниба – ингибиторов киназы MEK [8]. Комбинированная терапия с ингибиторами BRAF и MEK (например, дабрафениб + траметиниб, вемурафениб + кобиметиниб) способствовала значительному увеличению ОВ и выживаемости без прогрессирования (ВБП) у больных меланомой с BRAF-мутацией V600. Результаты трехлетнего контрольного анализа были представлены в двух рандомизированных исследованиях фазы III, в которых сравнивали эффективность комбинаций «дабрафениб + траметиниб», «дабрафениб + плацебо» (COMBI-d) и монотерапии вемурафенибом (COMBI-v) у пациентов с BRAF-мутацией V600 [8, 9]. В исследовании COMBI-d трехлетние ОВ и ВБП в группе «дабрафениб + траметиниб» составили 44 и 22%, в группе «дабрафениб + плацебо» – 32 и 12% соответственно. В исследовании COMBI-v трехлетние ОВ и ВБП в группе «дабрафениб + траметиниб» составили 45 и 24%, в группе «дабрафениб + плацебо» – 31 и 10% соответственно. Профиль безопасности длительной комбинированной терапии был аналогичен таковому в предыдущих работах [8–10].
На текущий момент имеются пятилетние данные рандомизированных исследований комбинированной терапии ингибиторами BRAF и MEK при неоперабельной и метастатической меланоме с наличием мутации в гене BRAF V600E/K. В общей сложности 563 пациента (211 участников исследования COMBI-d и 352 участника исследования COMBI-v) были случайным образом распределены на группы «дабрафениб + траметиниб». Четырехлетняя ВБП составила 21% (95% доверительный интервал (ДИ) 17–24), пятилетняя – 19% (95% ДИ 15–22). Четырехлетняя ОВ достигла 37% (95% ДИ 33–42), пятилетняя – 34% (95% ДИ от 30 до 38). В многомерном анализе исходные факторы (например, количество метастатических очагов и уровень лактатдегидрогеназы) были напрямую связаны с ВБП и ОВ [11].
Показано, что комбинированная терапия ингибиторами BRAF и MEK ассоциируется со значительным долгосрочным эффектом. Поэтому определение статуса мутации BRAF должно быть приоритетом для клинициста [12].
Клинический случай
Пациентка В., 46 лет, находилась под наблюдением в Красноярском краевом клиническом онкологическом диспансере им. А.И. Крыжановского с июля 2015 г. Больная обратилась с жалобами на наличие в области левого бедра пигментного невуса в течение четырех лет. Последние шесть месяцев отмечались рост образования, изменение цвета невуса – угольно-черный, появление асимметричной формы. В анамнезе пациентки хронический вирусный гепатит C, минимальная степень биохимической активности.
В дневном хирургическом стационаре 28 июля 2015 г. выполнена операция – широкое иссечение опухоли кожи левого бедра. Гистологическое исследование: пигментная меланома, без изъязвления, толщина опухоли по Бреслоу до 2 мм, удалена в пределах здоровых тканей. Диагностирована пигментная меланома кожи левого бедра, стадия IB (T2aN0M0). В соответствии с клиническими рекомендациями, с учетом стадии опухолевого процесса пациентке рекомендовано динамическое наблюдение.
На контрольном визите в мае 2017 г. появились жалобы на наличие пальпируемого лимфоузла в паховой области слева. Ультразвуковое исследование (УЗИ) паховых лимфоузлов от 22 мая 2017 г. показало несколько (не менее пяти-шести) увеличенных лимфоузлов гетерогенной структуры с недифференцированным средостением. Размер наибольшего из них 38 × 15 × 25 мм.
30 мая 2017 г. выполнена паховая лимфаденэктомия слева. Гистологическое исследование: метастазы пигментной меланомы кожи в пяти лимфоузлах из восьми. От адъювантной иммунотерапии интерфероном альфа-2b пациентка отказалась, выбрав динамическое наблюдение.
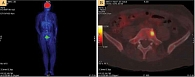
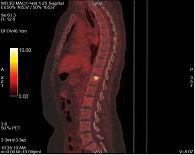
В августе 2017 г. при очередном обследовании зафиксировано прогрессирование опухолевого процесса: боль и отек левой конечности, опухоль в левой подвздошной области. При осмотре в левой подвздошной области выявлена опухоль до 5,0 см, левая нижняя конечность отечна (в пахово-подвздошной области слева деревянистой плотности). Позитронно-эмиссионная томография/компьютерная томография (ПЭТ-КТ) от 10 августа 2017 г. (рис. 1А): на серии томограмм всего тела участок очагового накопления фтордезоксиглюкозы (ФДГ) в левой половине позвонка L5 сцинтиграфическим размером 1,0 см (SUVmax = 8,74) без явных патологических структурных изменений на КТ (рис. 1Б). В левой паховой области на фоне послеоперационных изменений в мягких тканях отмечается участок повышенного накопления ФДГ линейной формы сцинтиграфическим размером до 1,6 см (SUVmax = 6,48). Увеличенных метаболически активных лимфоузлов не обнаружено. Назначена терапия интерфероном альфа-2b 6 млн МЕ подкожно три раза в неделю в течение трех месяцев и терапия бисфосфонатами (золедроновая кислота) 4 мг внутривенно капельно один раз в 28 дней № 3.
Осмотр в ноябре 2018 г.: жалобы на слабость и утомляемость 2-й степени, головокружение 2-й степени, повышение температуры тела до 38 °C, тошноту, отечность бедра. Status localis: в левой подвздошной области опухолевидное образование до 10 см, левая нижняя конечность резко отечна. УЗИ мягких тканей паховой области слева от 12 ноября 2017 г.: множественные образования пониженной эхогенности гетерогенной структуры с неровными нечеткими контурами, максимальным размером 21 × 16 × 11 мм.
Результаты ПЦР-исследования (полимеразная цепная реакция), проведенного в августе 2017 г.: при изучении образца ДНК выявлена активирующая мутация в 15-м экзоне гена BRAF типа V600E, что означает чувствительность меланомы к таргетным препаратам.
Заключение врачебной комиссии от 17 ноября 2017 г.: показана комбинированная таргетная терапия ингибиторами BRAF и MEK. Начало лечения – 1 декабря 2017 г.: траметиниб 2,0 мг один раз в день, дабрафениб 150 мг два раза в день.
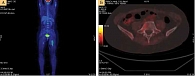
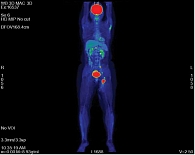
Переносимость терапии была удовлетворительной. Нежелательные явления невыраженные: слабость 1-й степени, сухость во рту 1-й степени, пирексия до 37,5 °C. При контрольном осмотре после третьего курса таргетной терапии клинически зафиксировано улучшение состояния: уменьшение болевого синдрома, снижение отечности нижней конечности. ПЭТ-КТ от 6 марта 2018 г.: на серии томограмм всего тела участков патологического гиперметаболизма ФДГ не выявлено (рис. 2А). Отмечается участок перестройки структуры остеосклеротического характера в левой половине тела L5 без проводимой терапии (рис. 2Б).
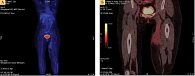
С 1 декабря 2017 г. по 3 декабря 2018 г. пациентка получала комбинированную таргетную терапию – 11 курсов. Запланированный 12-й курс отменен из-за развития нежелательного явления 2-й степени – гепатотоксичности. Контрольная ПЭТ-КТ от 10 января 2019 г.: неоднородное уплотнение мягких тканей по внутренней поверхности левого бедра с диффузно-очаговым накоплением ФДГ (рис. 3А) и признаками лимфостаза конечности, подозрение на рецидив (рис. 3Б).
С 24 января 2019 г. врачебной комиссией принято решение продолжить комбинированную таргетную терапию ингибиторами BRAF и MEK.
В апреле 2019 г. после 14-го курса таргетной терапии пациентке выполнено иссечение опухоли мягких тканей послеоперационного рубца левого бедра. Гистологическое исследование: эпителиоидно-клеточная меланома. Контрольная ПЭТ-КТ от 25 июня 2019 г.: неоднородное уплотнение мягких тканей по внутренней поверхности левого бедра диффузно-очагового характера без накопления ФДГ (рис. 4А и Б) и признаки лимфостаза конечности. Учитывая отсутствие признаков прогрессирования, врачебная комиссия рекомендовала динамическое наблюдение (контрольный осмотр через три месяца).
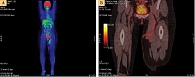
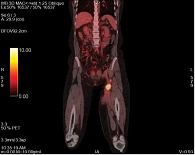
При осмотре в ноябре 2019 г. вновь появились жалобы на образование в паховой области слева, боль в позвоночнике (для купирования болевого синдрома пациентка принимала нестероидные противовоспалительные препараты), отек левой нижней конечности. При проведении ПЭТ-КТ от 25 октября 2019 г. выявлены очаги метаболической активности радиофармпрепарата в образованиях подкожной клетчатки по передней поверхности трети левого бедра, а также в аналогичных по структуре образованиях в области левой паховой связки, гиподенсивном образовании большой поясничной мышцы слева, в теле позвонка Th12 (рис. 5) секундарного генеза (рис. 6). В паховой области слева с участком гипометаболизма в центре образования определяется зона распада SUVmax 20,30, диаметр 35 мм (рис. 7), а также в аналогичных по структуре образованиях: первое расположено выше SUVmax 6,48, диаметр 11 мм, второе и третье – в области паховой связки SUVmax 5,65 и 2,31, диаметр 11 и 7 мм (по сравнению с ПЭТ/КТ от 10 января 2019 г. динамика явно отрицательная). Врачебная комиссия краевого онкологического диспансера рекомендовала возобновить с 6 ноября 2019 г. комбинированную таргетную терапию ингибиторами BRAF и MEK (траметиниб 2,0 мг один раз в день, дабрафениб 150 мг два раза в день).
В январе 2020 г. зарегистрировано бессимптомное множественное метастатическое поражение головного мозга, прекращена таргетная терапия. 10 января начат курс иммунотерапии моноклональным антителом пембролизумабом 10 мг/кг внутривенно каждые две недели. После третьего курса лечение остановлено из-за развития тяжелого нежелательного явления 3-й степени – гепатита, сопровождавшегося явлениями печеночно-клеточной недостаточности и паренхиматозной желтухи, статус больной по ECOG 4.
Впоследствии специальное противоопухолевое лечение не проводилось. Пациентка получала симптоматическое лечение по месту жительства.
На протяжении всего периода болезни, до января 2020 г., больная была социально и профессионально активна. В марте 2020 г. в результате прогрессирования меланомы кожи пациентка скончалась. С момента начала комбинированной терапии до момента смерти прошло 38 месяцев.
Заключение
В представленном клиническом случае на фоне проведенного лечения продолжительность жизни увеличилась на три года. При этом пациентка сохраняла профессиональную и социальную активность.
Ye.N. Yeremina, D.V. Gavrilyuk, PhD, R.A. Zukov, PhD, Prof.
V.F. Voino-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Cancer Center
Contact person: Yekaterina N. Yeremina, eremina.catia2010@yandex.ru
The development of malignant diseases new methods of treatment, improvement of their effectiveness and safety is one of modern medicine urgent tasks. In addition to the radical method of treating melanoma, targeted therapy is of great importance. The article presents a clinical case of a long-term follow-up of a patient with recurrent skin melanoma after surgical treatment who received combined targeted therapy with BRAF and MEK inhibitors. After 14 courses of targeted therapy, there was a complete regression of metastases with subsequent stable dynamics. 38 months passed from the start of combination therapy to the time of death. This clinical case demonstrates the potential of targeted therapy in increasing the duration and quality of life of patients with the skin metastatic melanoma.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.