Эффективность анти-PD-1-терапии в комбинированном лечении метастатической меланомы кожи
- Аннотация
- Статья
- Ссылки
- English


Введение
Меланома – злокачественная опухоль, возникающая из трансформированных меланоцитов (пигментпродуцирующие клетки), которые имеют нейроэктодермальное происхождение и в процессе эмбриогенеза мигрируют из нервного гребешка в эпидермис и другие сайты, включая менингеальные, слизистые оболочки и сетчатку глаза. Меланома может развиваться в любой ткани, где в норме присутствуют меланоциты, однако кожная локализация остается наиболее распространенной – до 90% всех случаев заболевания.
Меланома отличается клинико‑морфологической гетерогенностью и пластичностью. Клинико‑морфологическая гетерогенность меланомы проявляется в различной локализации опухолей в фазе опухолевой прогрессии и сопряжена с определенными молекулярно‑генетическими нарушениями.
Наиболее часто в меланоме кожи выявляют мутации генов BRAF (50%) или NRAS (20%), реже обнаруживают мутации генов NF1, RAC1, KIT. В ряде случаев клиническая картина заболевания обусловлена метастазами без выявленного первичного очага. Иногда локализацию первичной меланомы невозможно установить из‑за регрессии опухоли, вплоть до ее полного исчезновения [1–3].
Численность контингента больных меланомой кожи в России за период 2010–2020 гг. увеличилась с 46,6 до 69,1 человека на 100 тыс. населения. В этот период на 6,1% увеличилась доля больных, состоявших на учете в онкологических учреждениях России пять лет и более с момента установления диагноза злокачественного новообразования. Существенно – на 17,2% – возрос удельный вес больных с меланомой кожи, выявленных активно, от числа больных с впервые в жизни установленным диагнозом данного злокачественного новообразования.
Удельный вес меланомы, выявленной впервые в I–II стадии, увеличился на 11,0%, что свидетельствует о повышении эффективности мероприятий вторичной профилактики. В то же время регистрируется уменьшение на 7,9% удельного веса меланомы, выявленной в III стадии. Благодаря такой положительной динамике летальность больных в течение года с момента установления диагноза меланомы снизилась практически на 5,0% за отчетный период. В связи с преобладанием локальных стадий меланомы доля только хирургического радикального лечения в 2020 г. отмечается на уровне 87,5%. Из них 9,9% пациентов с меланомой кожи продолжат лечение, что согласуется с аналогичным стабильным показателем больных, выявленных с IV стадией заболевания (около 10,0%). Среди всего спектра опухолей кожных покровов наибольшую опасность представляет именно метастатическая, или неоперабельная, меланома, которая нередко эволюционирует по пути диссеминации и генерализации процесса с неблагоприятным исходом. Данный контингент больных меланомой кожи, как правило, подлежит комбинированному или комплексному лечению (12,5% из числа впервые выявленных случаев), включая современную таргетную и иммунотерапию [4].
В современной иммунотерапии меланомы кожи выделяют разные подходы и используют методы усиления презентации антигена, воздействия на кинетику иммунных процессов, устранения иммуносупрессирующих факторов, воздействия на опухоль с последующей активацией/индукцией иммунного ответа, клеточную и гуморальную адаптивную терапию, а также модуляцию активности иммунологического синапса. Именно ниволумаб является ингибитором тормозных сигналов (immune checkpoint inhibitors) и участвует в модуляции активности иммунологического синапса [5].
Ниволумаб (МКА-блокатор PD1) является человеческим моноклональным антителом, которое блокирует взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами (PD-L1 и PD-L2). Ниволумаб представляет собой иммуноглобулин G4 (IgG4), его приблизительная молекулярная масса составляет 146 кДа. PD-1-рецептор является негативным регулятором активности Т-клеток. Связывание PD-1 с лигандами PD-L1 и PD-L2, которые способны экспрессироваться клетками опухолей или иными клетками микроокружения опухолей, приводит к ингибированию пролиферации Т-клеток и секреции цитокинов [6–8]. Кроме того, уменьшение «ДНК-комет» мононуклеарных клеток у больных меланомой, получающих терапию ниволумабом, может свидетельствовать об ослаблении воздействия прогенотоксического пресса или же более эффективной репарации повреждений ДНК [9].
В исследовании CheckMate 066 у пациентов без BRAF-мутации ниволумаб продемонстрировал убедительное преимущество перед дакарбазином по основным критериям эффективности – частоте объективного ответа (ЧОО), медиане выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ), которые составили 42,9%, 5,1 и 37,5 месяца. Аналогичные показатели в группе дакарбазина оказались значительно ниже: 14,4%, 2,2 и 11,2 месяца соответственно. Показатели трехлетней ОВ у пациентов, получавших ниволумаб и дакарбазин, достигли 51,2 и 21,6% соответственно. Частота полного ответа составила 19%, частичный ответ наблюдался у 23,8% пациентов. При использовании дакарбазина ЧОО составила 14,4% с медианой длительности шесть месяцев, причем только 1,4% пациентов достигли полного ответа. Исходный уровень качества жизни на фоне применения ниволумаба сохранялся длительный период. При этом качество жизни пациентов, получавших дакарбазин, ухудшалось намного раньше [10–12].
Для лечения пациентов с метастатической и нерезектабельной меланомой кожи (IIIC/D нерезектабельная – IV стадия) в первой линии рекомендуется использовать комбинацию ингибиторов BRAF и МЕК, либо комбинированное лечение МКА-блокаторами PD-1 и МКА, блокирующими тормозные сигналы каскада CTLA4 (МКА-блокаторы CTLA4), либо монотерапию МКА-блокаторами PD1.
У пациентов с метастатической меланомой, не имеющих симптомов заболевания, предпочтительным вариантом лечения следует считать монотерапию МКА-блокаторами PD-1 или комбинированное лечение МКА-блокаторами PD-1 и МКА-блокаторами CTLA4 в следующем режиме: ниволумаб 1 мг/кг в/в капельно + ипилимумаб 3 мг/кг в/в капельно один раз в три недели (суммарно четыре введения) или ниволумаб 3 мг/кг в/в капельно + ипилимумаб 1 мг/кг в/капельно один раз в три недели (суммарно четыре введения), затем ниволумаб 3 мг/кг каждые две недели в/в капельно, или ниволумаб 240 мг каждые две недели в/в капельно, или ниволумаб 480 мг в/в каждые четыре недели 12 месяцев [13–17].
По результатам исследования III фазы CheckMate 067, эффективность комбинации этих препаратов значительно превосходит монотерапию ипилимумабом. При 60-месячном периоде наблюдения пятилетняя общая выживаемость составила 52% при использовании комбинации, 44% – при монотерапии ниволумабом и 26% – при монотерапии ипилимумабом. Доля пациентов, которые через пять лет наблюдения еще не перешли на вторую линию терапии, достигла 74% в группе комбинации ниволумаба и ипилимумаба, 58% – в группе ниволумаба и 45% – в группе ипилимумаба. Пятилетние показатели ВБП на фоне применения комбинации препаратов, ниволумаба и ипилимумаба в монорежимах составили 36, 29 и 8% соответственно. При использовании комбинированного режима медиана ВБП достигла 11,5 месяца, риск прогрессирования и смерти снизился на 21% по сравнению с ниволумабом и на 58% по сравнению с ипилимумабом. Кривая ВБП, равно как и кривая ОВ, вышла на плато. Частота нежелательных явлений 3-й степени и выше на фоне комбинированного лечения составила 59%, на фоне монотерапии ниволумабом – 23%, ипилимумабом – 28%.
Профиль токсичности у ниволумаба значительно лучше, чем у ипилимумаба: только у 14% пациентов развились иммуноопосредованные нежелательные явления 3–4-й степени против 46%, что значительно реже приводило к отмене лечения (4 и 30% соответственно). Наибольший процент нежелательных побочных явлений 3-й или 4-й степени отмечался со стороны желудочно-кишечного тракта (15%). В то же время в группе ниволумаба частота развития гастроинтестинальной токсичности составила 4%, в группе ипилимумаба – 12%. При использовании комбинации препаратов чаще регистрировались такие побочные явления, как диарея, усталость, зуд и сыпь (45, 38, 36 и 30% соответственно) [18].
Развитие нежелательных явлений на фоне применения иммуноонкологических препаратов тесно связано с подавлением процессов, обычно отвечающих за торможение аутоагрессии иммунной системы. Аутоиммунное воспаление возникает в различных органах-мишенях: коже, желудочно-кишечном тракте, печени, почках, гипофизе, щитовидной железе, легких, органах зрения, нервной системе. Наиболее частыми осложнениями терапии анти-PD-1-моноклональными антителами являются слабость, кожная токсичность в виде сыпи и зуда, кашель, диарея, снижение аппетита, обстипация, артралгия. При использовании препаратов этой группы в 1–5% случаев развиваются пневмониты.
Осложнения 1–2-й степени, за исключением иммуноопосредованных пневмонитов, не требуют прекращения иммунотерапии и отмены системных глюкокортикостероидов. При осложнениях 2-й степени на фоне проводимой симптоматической терапии в отсутствие улучшения в течение 7–10 дней принимается решение о назначении преднизолона в дозе 1 мг/кг веса пациента до купирования нежелательных явлений или уменьшения степени их тяжести до легкой. При осложнениях выраженной степени терапия приостанавливается или прекращается, назначаются высокие дозы преднизолона (1–2 мг/кг веса пациента) [19].
При наличии признаков прогрессирования заболевания на фоне применения ингибиторов BRAF либо комбинации BRAF- и МЕК-ингибиторов или появления признаков непереносимости такой терапии при сохранении удовлетворительного общего состояния пациента (ECOG 0–2) и при ожидаемой продолжительности жизни более трех месяцев рекомендуется перевести пациента на терапию МКА-блокаторами PD-1 или комбинацию МКА-блокаторов PD-1 и CTLA-4. Монотерапия МКА-блокаторами PD-1 и комбинированная терапия МКА-блокаторами PD-1 и CTLA-4 демонстрируют сходные результаты у пациентов с меланомой, резистентной к ИПК BRAF и MEK. Однако комбинированная терапия МКА-блокаторами PD-1 и CTLA-4 может быть связана с более высокой частотой нежелательных явлений по сравнению с монотерапией.
Также продолжение монотерапии МКА-блокаторами PD-1 возможно у пациентов при изолированном прогрессировании единичных метастазов меланомы с возможностью их хирургического удаления или проведения стереотаксической радиохирургии на прогрессирующие очаги (олигопрогрессирование). У пациентов с мутацией в гене c-Kit и ожидаемой продолжительностью жизни более трех месяцев в качестве терапии первой или последующих линий или на фоне прогрессирования при лечении иматинибом рекомендована монотерапия МКА-блокаторами PD-1 или комбинацией МКА-блокаторов CTLA-4 и PD-1. У пациентов без мутаций в генах BRAF и c-Kit при сохранении удовлетворительного общего состояния пациента (ECOG 0–2) и при ожидаемой продолжительности жизни более трех месяцев рекомендуется терапия комбинацией МКА-блокаторов PD-1 и CTLA-4 или монотерапия МКА-блокаторами PD-1. Ниволумаб рекомендуется назначать в постоянном режиме до наступления прогрессирования или непереносимости с интервалом введения две или четыре недели в зависимости от режима дозирования. Начинать лечение этим иммунопрепаратом нужно не позднее трех месяцев после завершения хирургического этапа [20, 21].
Применение иммуноонкологических препаратов (анти-CTLA-4, анти-PD-1) при метастатической меланоме способствовало значимому увеличению выживаемости и улучшению качества жизни пациентов. Комбинация таргетной и иммунотерапии у пациентов с нерезектабельной/метастатической меланомой позволяет добиться быстрого ответа за счет таргетной терапии, более длительного ответа за счет иммунотерапии, преодолеть резистентность к отдельным видам препаратов.
Синергичный потенцирующий эффект такой терапии показан в исследованиях IMspire-150, Combi-I и Keynote-022, где проведена оценка эффективности ингибиторов BRAF и MEK в комбинации с анти-PD-L1/анти-PD-1-антителами при нерезектабельной или метастатической меланоме [22]. Согласно регистру клинических исследований, сейчас проводится международное многоцентровое клиническое исследование III фазы по изучению эффективности комбинации ниволумаба и препарата NTRK-214 (иммунотерапия) в сравнении с ниволумабом у ранее не леченных пациентов с нерезектабельной или метастатической меланомой кожи [23].
Клинический случай
Пациент Ш., 75 лет, находится на диспансерном наблюдении в Красноярском краевом клиническом онкологическом диспансере им. А.И. Крыжановского (КККОД) с ноября 2015 г., когда в условиях дневного хирургического стационара было выполнено широкое иссечение пигментной язвы с последующим морфологическим подтверждением диагноза: меланома кожи спины IIС стадии T4bN0M0 (BRAF-отрицательная). На момент хирургического этапа лечения, по данным ультразвукового исследования (УЗИ), клинических признаков и измененных регионарных лимфоузлов, а также признаков генерализации процесса не выявлено.
При очередном диспансерном осмотре 09.02.2016 в левой подмышечной области при пальпации был выявлен увеличенный плотноэластический лимфоузел диаметром до 10 мм. В отделении онкомаммологической хирургии КККОД 12.02.2016 произведена операция – расширенная подмышечная лимфаденэктомия слева. Плановый гистологический ответ № 4939/55: метастазы пигментной меланомы в пяти из 17 удаленных лимфоузлов. В плане комбинированного лечения больному был назначен интерферон альфа-2b по 3 млн МЕ п/к через день на три месяца с последующим продлением этой иммунотерапии на срок до одного года. Проведение длительной интерферонотерапии позволило добиться безрецидивного периода до 3,5 лет.
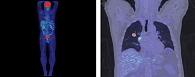
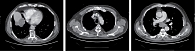
Однако в феврале 2019 г. на осмотре в поликлинике КККОД появилось новообразование в мягких тканях живота и подозрение на метастазы в легкие. Пунктат образования брюшной стенки № 1968: определяются кровь, обрывки жировой клетчатки, сгустки бесструктурных масс. При проведении компьютерной томографии (КТ) грудной клетки 29.03.2019 выявлены солитарный метастаз в правое легкое диаметром 20 мм и один увеличенный бронхопульмональный узел. По данным позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ), в S3 правого легкого и правом бронхопульмональном лимфоузле определяется радиоизотопная активность, метаболическая активность радиофармацевтического препарата в образовании нисходящего отдела ободочной кишки (полипоз (?), нео (?)) (рис. 1).
В марте 2019 г. выполнена эндоскопическая полипэктомия сигмовидной кишки на 300 мм, плановый гистологический ответ № 4254: морфологическая картина тубуловорсинчатой аденомы с легкой дисплазией эпителия. Сопутствующая патология: ишемическая болезнь сердца, транзиторная атриовентрикулярная блокада 3-й степени, полная блокада правой ножки пучка Гиса, электрокардиостимулятор (01.2018): постоянная эндокардиальная секвенциальная стимуляция в режиме DDDR, гипертоническая болезнь 2-й степени, риск 3, сахарный диабет 2-го типа (НbА1с 7%), облитерирующий атеросклероз артерий нижних конечностей.
В отделении онкоторакальной хирургии КККОД 17.04.2019 произведена торакотомия справа, интраоперационно в S1 определяется плотная бугристая опухоль до 25 мм в диаметре, увеличенные до 20 мм бронхопульмональные лимфоузлы. Учитывая глубокое расположение опухоли, выполнить резекцию невозможно, выполнены расширенная верхняя лобэктомия, лимфаденэктомия средостения. Плановый гистологический ответ № 5973: в срезах легкого определяется инвазивный рост опухоли, представленной крупными полиморфными эпителиоподобными клетками с формированием солидных и альвеолярных структур, единичные клетки опухоли содержат гранулы пигмента коричневого цвета. В одном бронхопульмональном лимфоузле метастазы опухоли. Морфологическая картина злокачественной эпителиальной опухоли, наиболее вероятно меланомы. Иммуногистохимическое исследование № 172: опухолевыми клетками диффузно интенсивно цитоплазматически экспрессирован HMB 45, Tyrosinase; PCK опухолевыми клетками не экспрессирован. Иммуноморфологическая картина характерна для метастаза меланомы в легкое.
Решением врачебного консилиума (ВК) КККОД от 17.05.2019 рекомендована лекарственная терапия, которая началась 30.05.2019 в дневном стационаре с противоопухолевой лекарственной терапии – ниволумаб по 240 мг один раз в день в/в капельно. До 03.01.2020 проводились повторные введения ниволумаба в прежней дозировке каждые две недели.
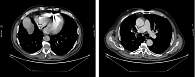
По результатам КТ органов грудной клетки от 26.07.2019, над куполом диафрагмы справа определяется объемное образование с четкими контурами, накапливающее контрастное вещество, размерами 28 × 62 × 18 мм, вероятно исходящее из плевры. Увеличения лимфоузлов бронхопульмональной группы и средостения нет (рис. 2).
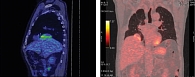
ПЭТ-КТ от 21.08.2019: метаболически активное образование по диафрагмальной плевре справа размерами 50 × 28 × 24 мм (рис. 3).
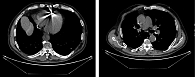
Повторная КТ органов грудной клетки от 24.10.2019: объемное образование диафрагмальной плевры справа без отрицательной динамики (рис. 4).
При проведении УЗИ мочевого пузыря 01.11.2019 выявлено внутриполостное образование: по правой стенке в просвет пристеночное образование 32 × 25 × 24 мм с гиперэхогенным контуром. Биопсия опухоли (гистологическое заключение № B 219-17563): в препарате мелкие фрагменты опухолевой ткани переходно-клеточного рака 1-й степени клеточной анаплазии. В отделении онкоурологической хирургии КККОД 12.12.2019 выполнена трансуретральная резекция опухоли на правой боковой стенке мочевого пузыря типа «цветной капусты» размерами 30 × 35 × 30 мм с контактной кровоточивостью. После получения планового гистологического подтверждения (№ 19328) переходно-клеточного рака установлен диагноз: рак мочевого пузыря I стадии T1N0M0G2. Решением ВК КККОД рекомендована внутрипузырная химиотерапия – митомицин 40 мг один раз в неделю № 6.
С учетом достаточно выраженной палитры синтропии и нейтропии коморбидного фона решением ВК КККОД с 17.01.2020 рекомендовано продолжить монотерапию ниволумабом в дозе 480 мг один раз в день в/в капельно один раз в четыре недели с контролем КТ брюшной полости один раз в шесть месяцев.
Во время диспансерного осмотра 01.03.2021 появилось образование мягких тканей задней грудной стенки, возможно вторичного характера. 04.03.2021 выполнено иссечение опухоли кожи спины. При морфологическом исследовании присланного фрагмента кожи в дерме определяются скопление плазматических клеток, большое количество гистиоцитов, множество гигантских многоядерных клеток, очаги отложения холестерина с очагом некроза, преимущественно по периферии лимфоплазмоцитарная инфильтрация, что соответствует гранулематозному воспалению (гигантоклеточная «репаративная» гранулема).
Фиброколоноскопия от 18.05.2021: полипоз сигмовидной кишки тип 0-Is, в сигмовидной кишке определяются полипы 5–12 мм в диаметре на широком и умеренном основании с розовой верхушкой, полип сигмовидной кишки, тип 0-Isp, susp. Malignae (?), на 400 мм от ануса определяется полип до 10 мм в диаметре, с эрозивной, рыхлой верхушкой. Биопсия (гистологическое заключение № B221-6819 от 21.05.2021): морфологическая картина тубулярно-папиллярной аденомы толстой кишки с умеренной дисплазией.
КТ-картина объемного образования диафрагмальной плевры справа без отрицательной динамики от 28.09.2021 (рис. 5).
Таким образом, на фоне консолидирующей иммунотерапии с ее моделированием путем увеличения дозы и изменения кратности введения ниволумаба была достигнута стабилизация метастатического процесса меланомы в течение 24 месяцев.
На диспансерном осмотре 20.01.2022 КТ органов грудной и брюшной полости показала отрицательную динамику: в средостении появились конгломераты бифуркационных лимфоузлов до 38 мм в поперечнике с неоднородным накоплением контрастного вещества, ранее не увеличенные; отмечается единичный паратрахеальный лимфоузел справа до 13 мм, ранее не увеличенный; над куполом диафрагмы справа сохраняется объемное образование с четкими контурами, неоднородно накапливающее контрастное вещество, размерами 68 × 43 мм, динамика отрицательная (рис. 6).
КТ от 21.02.2022: отмечается появление новых увеличенных лимфоузлов паратрахеальной группы справа до 16 мм по короткой оси, немногочисленные увеличенные надключичные лимфоузлы справа до 13 мм по короткой оси (ранее не определялись) (рис. 7).
На ВК КККОД 25.02.2022 рекомендовано начать вторую линию противоопухолевой терапии: дакарбазин 1000 мг/м2 в первый день, цикл 28 дней, три курса с оценкой динамики.
При обсуждении возможных вариантов третьей линии терапии в случае прогрессирования опухолевого процесса представляется целесообразной реиндукция комбинацией МКА-блокаторов PD1 и CTLA4 или монотерапия МКА-блокатором CTLA4.
Обсуждение
В онкогематологии обычно используют принцип этапности лекарственного лечения: после подготовительного этапа идет индукционная фаза терапии с последующим переходом к этапу консолидации и интенсификации химиотерапии. Важным этапом такого системного лечения является реиндукция для максимального снижения вероятности процедива/рецидива и риска прогрессирования заболевания. Чередование интенсивных курсов лекарственной терапии со стандартными по дозировке курсами, с одной стороны, помогает усилить консолидацию очагов опухолевого роста, с другой – способствует восстановлению организма при длительном лечении на фоне стабилизации злокачественного процесса. Кроме того, это позволяет снизить риск развития лекарственной резистентности при системной терапии злокачественных новообразований.
В данном клиническом наблюдении можно проследить похожие параллели и этапность лекарственного лечения метастатической меланомы кожи. Адъювантная профилактическая интерферонотерапия позволила достигнуть трехлетнего безрецидивного периода. Рецидив заболевания потребовал интенсификации системного лечения с переходом к иммунотерапии ниволумабом в комбинации с хирургическим лечением, что позволило добиться достаточно длительной стабилизации заболевания. Выбор режима цитотоксической химиотерапии во второй линии при очевидном прогрессировании метастатической меланомы связан, с одной стороны, с формированием резистентности к ниволумабу и, весьма вероятно, к его аналогам (пембролизумабу, пролголимабу), с другой стороны, с попыткой преодоления этой резистентности резкой сменой механизмов повреждения опухолевых клеток, а также повторной интенсификацией системного лечения.
Заключение
В представленном клиническом случае при выраженной коморбидности пациента было отдано предпочтение консолидирующей монотерапии ниволумабом и достигнута стабилизация метастатического процесса меланомы кожи спины в течение 32 месяцев без явного прогрессирования. С момента манифестации резектабельной меланомы кожи в данном клиническом случае продолжительность жизни пациента составила 75 месяцев на момент курации. Повторное достижение стабилизации прогрессирования опухолевого процесса путем интенсификации системной химиотерапии создает условия для проведения последующей иммунотерапии комбинацией МКА-блокаторов PD1 и CTLA4 или монотерапии МКА-блокатором CTLA4, что позволит оценить эффективность реиндукции иммунотерапии метастатической меланомы на фоне достаточно выраженной синтропии и нейтропии коморбидности пациента.
D.V. Gavrilyuk, PhD, I.P. Safontsev, PhD, I.L. Obraz, R.A. Zukov, PhD, Prof.
V.F. Voyno-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
Federal Siberian Scientific and Clinical Center
Contact person: Dmitry V. Gavrilyuk, gavrilukdv@mail.ru
Targeted and immunotherapy is important in the treatment of metastatic melanoma of the skin. The article presents a clinical case of a long-term follow-up of a patient with recurrent metastatic melanoma of the skin who received drug therapy using the anti-PD-1 drug nivolumab. The described clinical case demonstrates the possibilities of nivolumab monotherapy to increase the median survival and improve the quality of life of patients with metastatic melanoma of the skin, including discussion of the possibility of reinduction of immunotherapy against a pronounced comorbid background.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.