Доказательная база эффективности пробиотиков у детей
- Аннотация
- Статья
- Ссылки

Пробиотики – лекарственные средства и биологически активные добавки, содержащие штаммы представителей нормальной микрофлоры, которые благоприятно влияют на организм. Пробиотические штаммы бактерий также могут входить в состав продуктов питания [1, 2].
Пробиотики: история и современность
Впервые о функциональной роли бактерий в процессе пищеварения высказался Л. Пастер около 150 лет назад. Изучая «болезни вина», он установил, что брожение является результатом деятельности микроорганизмов и что вид брожения связан с определенными бактериями. Это открытие позволило Л. Пастеру предположить, что бродильные процессы в кишечнике человека и животных тоже обусловлены бактериями [3].
Серьезное изучение роли микрофлоры в организме человека началось в начале прошлого века в Институте Пастера и связано с именем великого русского ученого И.И. Мечникова, лауреата Нобелевской премии за открытия в области иммунитета. Мечников предложил концепцию взаимоотношений человека и его микрофлоры и высказал идею о том, что можно модифицировать микрофлору кишечника, заменяя вредные микробы полезными. Он обратил внимание на то, что, по результатам переписи населения в Европе, в Болгарии, особенно в сельской местности, число долгожителей оказалось намного больше, чем в других странах, и связал это с особенностями диеты, а именно с употреблением большого количества традиционного кисломолочного продукта – «болгарского кислого молока» (йогурта) [1, 3]. В 1905 г. болгарский врач С. Григоров выделил две бактерии, вызывающие ферментацию в «болгарском кислом молоке»: палочковидную (Lactobacillus bulgaricus) и сферическую (Streptococcus thermophilus). На основе этих бактерий И.И. Мечников создал первый пробиотик – знаменитую «мечниковскую простоквашу» – и предложил ее использование в лечебных целях [4].
В эти же годы французский педиатр А. Тиссье, также работавший в Институте Пастера, обнаружил закономерность: у детей с диареей в стуле было снижено количество Y-образных бактерий (названных бифидобактериями), тогда как у здоровых детей уровень этих бактерий был высоким. Было высказано предположение о том, что бифидобактерии играют роль в защите от кишечных инфекций, и предложено использовать их в лечебных целях при диарее [1, 2].
Большой вклад в изучение кишечной микрофлоры человека внес немецкий ученый А. Ниссле. Именно он предложил термин «дисбактериоз». В 1917 г. А. Ниссле выделил и стал использовать в лечебных целях непатогенный штамм Escherichia coli с антагонистическими свойствами в отношении возбудителей кишечных инфекций. В то время это имело особую актуальность, поскольку еще не были открыты антибиотики [2].
В 1923 г. французский микробиолог А. Булар, работая в Индокитае, обратил внимание на то, что местные жители при диарее с успехом используют кожуру ряда тропических фруктов. Проведя исследования, он выделил из кожуры фруктов дрожжи рода сахарных грибков (Saccharomyces boulardii). В последующем лиофилизат этих дрожжей стали использовать в качестве средства для лечения диареи.
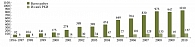
В дальнейшем научный интерес к микрофлоре человека и пробиотикам на несколько десятилетий снизился ввиду того, что многие научные теории относительно микрофлоры организма не нашли своего практического подтверждения, а также в связи с появлением эффективных антибактериальных средств для лечения кишечных инфекций. Однако в последнее десятилетие отмечается значительное увеличение научного интереса к пробиотикам [5]. Об этом наглядно свидетельствует анализ публикаций в базе данных Medline (рис.): если за период с 1954 по 1997 г. было опубликовано менее 100 работ, касающихся пробиотиков, то только за 2009 г. их число было в 10 раз больше, при этом существенную долю составляют рандомизированные контролируемые исследования (РКИ).
Согласно современным данным, пробиотики можно разделить на четыре группы: лактобактерии, бифидобактерии, прочие кисломолочные бактерии (энтерококки, стрептококки и др.) и различные не кисломолочные микроорганизмы (кишечная палочка, бациллы, дрожжи и др.) [6]. Пробиотики способны оказывать многофакторное воздействие на систему пищеварения и организм в целом посредством иммунологических и неиммунологических механизмов (табл.).
В настоящее время имеется серьезная доказательная база по эффективности пробиотиков в лечении и профилактике инфекционных заболеваний желудочно-кишечного тракта (ЖКТ) и некоторых аллергических заболеваний у детей. Кроме того, имеются отдельные исследования, свидетельствующие в пользу эффективности пробиотиков при других состояниях: респираторных инфекциях, воспалительных заболеваниях кишечника и ряде других. Однако оценка эффективности пробиотических средств серьезно затруднена в связи с их гетерогенностью и отсутствием единых протоколов исследования. Существуют значимые различия в эффективности отдельных пробиотиков, остаются нерешенными вопросы об оптимальных дозах пробиотиков, целесообразности использования их комбинаций, что требует проведения дальнейших клинических исследований.
Пробиотики в лечении и профилактике заболеваний ЖКТ у детей
На сегодняшний день имеются существенные доказательства необходимости применения пробиотиков у недоношенных новорожденных с целью профилактики некротизирующего энтероколита. Представленный в начале 2008 г. Кокрановский систематический обзор показал, что при назначении энтеральных пробиотиков уменьшается риск развития тяжелого некротизирующего энтероколита и летальности у недоношенных детей. Однако, по данным обзора, требовались дополнительные исследования для определения эффективности и безопасности пробиотиков у новорожденных с очень низкой массой тела (менее 1500 г) [7]. И уже в конце 2008 г. были представлены результаты мультицентрового рандомизированного контролируемого исследования перорального применения комбинированного пробиотика (B. bifidum и L. acidophilus) у новорожденных с очень низкой массой тела с целью профилактики некротизирующего энтероколита. Исследование включало 434 ребенка в 7 отделениях интенсивной терапии для новорожденных в Тайване. Результаты исследования показали, что в группе детей, получавших пробиотик, энтероколит наблюдался в 3,5 раза реже, а летальность была в 5 раз меньше [8].
В научной литературе представлено большое число работ, посвященных эффективности и безопасности применения различных пробиотиков в качестве средства для лечения и профилактики острых кишечных инфекций. Результаты Кокрановского систематического обзора говорят о том, что при инфекционной диарее у детей и взрослых помимо проведения регидратации целесообразно назначать пробиотики, поскольку на фоне их применения уменьшается риск сохранения диареи к третьему дню лечения и снижается длительность диареи на 30,5 ч [9].
По данным метаанализа 18 исследований, использование различных пробиотиков ведет к сокращению длительности острой диареи у детей младше 5 лет приблизительно на сутки [10].
В другой метаанализ было включено только 9 исследований, касавшихся применения пробиотиков рода Lactobacillus у детей с острой инфекционной диареей. Установлено, что использование таких пробиотиков ведет к уменьшению продолжительности диареи на 0,7 дня и снижает число дефекаций на 1,6 ко второму дню лечения. Авторы подчеркивают также высокую безопасность лекарственных средств на основе пробиотиков рода Lactobacillus у детей [11]. Таким образом, в настоящее время имеются серьезные доказательства целесообразности применения пробиотиков как средств для лечения острых кишечных инфекций у детей.
Данные научной литературы последних лет свидетельствуют о пользе включения пробиотиков в комплексную терапию поражений системы пищеварения, ассоциированных с Helicobacter pylori (H. pylori). Установлено, что отдельные виды Lactobacillus и Bifidobacterium обладают in vitro бактерицидным эффектом в отношении H. pylori, продуцируя бактериоцины или органические кислоты, и препятствуют адгезии H. pylori к эпителиальным клеткам. Эти защитные эффекты пробиотиков подтверждены в экспериментальных исследованиях на животных. Результаты клинических исследований у детей и взрослых показали, что пробиотики, как правило, обычно не уничтожают H. pylori, но уменьшают степень колонизации в желудке и при использовании совместно с антибактериальной терапией могут усиливать эрадикацию H. pylori. Пробиотики, обладая антиоксидантными и противовоспалительными свойствами, также могут стабилизировать барьерную функцию желудка и уменьшать выраженность воспалительных изменений слизистой оболочки.
В современной концепции, принятой вторым Маастрихтским соглашением в 2000 г., пробиотики рассмотрены как потенциальное средство лечения инфекции, вызванной H. pylori, и ассоциированного с ней воспаления желудка. Кроме того, пробиотики способны уменьшать нежелательные явления при антибактериальной терапии [12]. Проведенное несколько лет назад мультицентровое рандомизированное двойное слепое исследование у детей с гастритом показало, что добавление к стандартной трехкомпонентной терапии молочного продукта с L. casei достоверно увеличивало эрадикацию H. pylori: на 27,1% для всех пациентов, включенных в исследование (intention to treat – ITT-анализ), и на 30,3% для пациентов, закончивших исследование согласно протоколу (per-protocol – PP-анализ) [13].
Большинство научных исследований по применению пробиотиков посвящено их использованию для профилактики и лечения антибиотикоассоциированной диареи, поскольку одной из ее причин является подавление нормальной микрофлоры кишечника, что создает благоприятные условия для размножения патогенных и условно-патогенных микроорганизмов, а также ведет к метаболическим нарушениям. Представленный в 2007 г. Кокрановский систематический обзор был посвящен применению пробиотиков для профилактики антибиотикоассоциированной диареи у детей. Результаты обзора свидетельствуют о том, что применение пробиотиков перспективно для профилактики антибиотикоассоциированной диареи у детей, но необходимы дальнейшие исследования, поскольку до настоящего времени не установлено, какие пробиотики целесообразно использовать у детей в зависимости от возраста, и не определена оптимальная длительность терапии. Наибольшее число подтверждений эффективности предотвращения антибиотикоассоциированной диареи у детей в настоящее время имеется для L. rhamnosus GG, L. sporogens и S. boulardii. Также было установлено, что пробиотики безопасны для профилактики антибиотикоассоциированной диареи у детей [14].
Пробиотики в лечении и профилактике аллергических заболеваний у детей
Одной из возможных причин роста количества аллергических заболеваний может являться нарушение микрофлоры кишечника. Представленный в 2007 г. Кокрановский систематический обзор был посвящен применению пробиотиков для профилактики аллергических заболеваний и пищевой гиперсенсибилизации у детей раннего возраста. По результатам анализа установлен профилактический эффект пробиотиков для атопического дерматита. Наибольшее число подтверждений эффективности было для Lactobacillus rhamnosus GG. Но в связи с существенной гетерогенностью проанализированных исследований требуется дальнейшее изучение данного вопроса [15].
Представленный метаанализ исследований применения пробиотиков для лечения и профилактики атопического дерматита у детей показал, что из девяти рандомизированных плацебоконтролируемых исследований с комплексной оценкой поражения кожи по индексу SCORAD достоверный лечебный эффект пробиотиков был установлен в семи работах. Однако в двух из них эффект наблюдался только у детей с IgE-ассоциированным атопическим дерматитом, а в одной – только у детей с пищевой аллергией. В двух из трех рандомизированных плацебоконтролируемых исследованиях был установлен профилактический эффект пробиотиков в отношении атопического дерматита у грудных детей с высоким риском атопии [16].
Представленный в 2008 г. мета-анализ исследований у детей и взрослых показал, что пробиотики достоверно уменьшают симптомы аллергического ринита и снижают потребность в медикаментозной терапии. Однако требуется проведение более качественных исследований по этой проблеме [17].
Эффективность различных пробиотических штаммов в коррекции дисбиотических расстройств у детей
Пробиотическими штаммами с подтвержденной на сегодня эффективностью, прежде всего у детей раннего возраста, являются Bifidobacterium lactis ВB-12, Lactobacillus rhamnosus GG и Streptococcus thermophilus.
Имеются экспериментальные данные, что Bifidobacterium lactis ВB-12 обладает способностью колонизировать кишечник ребенка с первых дней жизни [18]. Также показано, что прием Bifidobacterium lactis ВB-12 достоверно увеличивает уровень продукции IgA в кишечнике у детей раннего возраста [19]. А в двойном слепом плацебоконтролируемом рандомизированном исследовании у недоношенных детей был установлено, что назначение Bifidobacterium lactis ВB-12 достоверно увеличивало уровень бифидофлоры в фекалиях, при этом снижая уровень бактерий семейства кишечных и клостридий [20].
В 2009 г. было выполнено лабораторное сравнительное исследование четырех пробиотиков: B. lactis ВB-12, Escherichia coli EMO, L. casei и S. boulardii. Было показано, что in vitro только B. lactis ВB-12 и L. casei синтезируют вещества с антимикробными свойствами и подавляют рост патогенных бактерий. Гидрофобные свойства клеточной стенки присущи B. lactis ВB-12 и E. coli EMO, что является предиктором адгезивных свойств и высокой способности колонизировать кишечник. Также было установлено, что Bifidobacterium lactis ВB-12 стимулируют выработку секреторного IgA у лабораторных животных (на одном уровне с E. coli EMO, но в меньшей степени, чем S. boulardii) [21].В научной литературе представлены результаты рандомизированного контролируемого исследования перорального применения комбинированного пробиотика (B. infantis, S. thermophilus и B. lactis ВB-12) у новорожденных с очень низкой массой тела с целью профилактики некротизирующего энтероколита. Результаты исследования показали, что в группе детей, получавших пробиотик, энтероколит развивался в 4,1 раза реже, при этом летальные случаи наблюдались только в контрольной группе [22].
Вскармливание материнским молоком является «золотым стандартом» питания ребенка первого года жизни. Естественное вскармливание обладает целым рядом принципиальных преимуществ по сравнению с искусственным. В частности, олигосахариды женского молока обладают выраженным пребиотическим эффектом – они стимулируют рост бифидобактерий в толстой кишке, что ведет к торможению развития патогенной и условно-патогенной флоры. Грудное молоко также способствует выработке у ребенка секреторного IgA. Эти факторы играют важную роль в том, что дети, получающие материнское молоко, меньше подвержены кишечным и респираторным инфекциям. Важнейшим преимуществом естественного вскармливания является снижение риска развития аллергии [23].
Однако по разным причинам дети первого года жизни часто находятся на искусственном вскармливании. В качестве одного из способов, уменьшающих в определенной степени недостатки искусственного вскармливания, рассматривается добавление пробиотиков в молочную смесь или дополнительное назначение пробиотиков. В научной литературе представлен ряд работ, показавших целесообразность использования для искусственного вскармливания детей молочных смесей с добавлением Bifidobacterium lactis ВB-12 (отдельно или в комбинации с другими пробиотиками). Так, еще 15 лет назад в доказательном исследовании было установлено, что у новорожденных детей, получающих молочную смесь с Bifidobacterium lactis ВB-12, количество бифидобактерий соответствует уровню их у детей, находящихся на естественном вскармливании, и существенно выше, чем у детей, получающих стандартную смесь [24].
У детей первых месяцев жизни, получавших молочные смеси только с B. lactis ВB-12 или дополнительно с S. thermophilus, отмечались более высокие темпы физического развития [25]. Также показано, что длительное использование молочной смеси с B. lactis ВB-12 и S. thermophilus у детей первых двух лет жизни имеет высокий профиль безопасности, а кроме того, достоверно снижает частоту развития кишечной колики и потребность в применении антибиотиков [26].
В 1994 г. в двойном слепом плацебоконтролируемом рандомизированном исследовании, одном из первых доказательных исследований относительно пробиотиков, было показано, что использование молочной смеси с добавлением B. lactis ВB-12 и S. thermophilus в питании госпитализированных детей в возрасте от 5 до 24 месяцев достоверно уменьшает риск развития диареи (с 31% до 7%) и частоту выделения ротавируса (с 39% до 10%) [27]. Позднее в многоцентровом двойном слепом плацебоконтролируемом рандомизированном исследовании у детей в возрасте до 8 месяцев, находящихся на искусственном вскармливании (с возраста менее 2 месяцев), было показано, что использование молочной смеси с B. lactis ВB-12 достоверно в 1,4 раза снижает число эпизодов диареи и несколько уменьшает ее длительность [28]. Также в двойном слепом плацебоконтролируемом рандомизированном исследовании был рассмотрен эффект профилактического применения молочных смесей с пробиотиками L. reuteri и B. lactis ВB-12 здоровыми детьми в возрасте от 4 до 10 месяцев, находящимися по решению родителей на искусственном вскармливании и посещающими детский сад. Установлено, что частота эпизодов диареи и их длительность, а также частота эпизодов повышения температуры по различным причинам были достоверно ниже в группах получавших пробиотики по сравнению с группой плацебо. Эти же авторы в последующем исследовании показали высокий профиль безопасности молочных смесей с указанными пробиотиками [29, 30].
В двойном слепом плацебоконтролируемом рандомизированном исследовании у детей грудного возраста, находящихся на искусственном вскармливании (с возраста менее 2 месяцев), было установлено достоверное положительное влияние назначения комбинированного пробиотика, содержащего B. lactis ВB-12 и L. rhamnosus GG, на частоту респираторных инфекций. В группе детей, получавших молочную смесь с пробиотиком, более чем в 2 раза реже развивался острый средний отит, почти в 3 раза реже требовалось назначение антибиотиков и наблюдались повторные респираторные инфекции. Ранее этими же авторами было установлено, что на фоне применения данного пробиотика ускоряется формирование иммунной системы у детей [31, 32].
В научной литературе имеются данные, что пробиотики, содержащие Bifidobacterium lactis ВB-12, уменьшают вероятность развития антибиотикоассоциированной диареи. По данным метаанализа 6 доказательных исследований, применение пробиотиков предотвращает развитие антибиотикоассоциированной диареи у 1 из 7 детей. Наибольшим эффектом при этом обладают пробиотики на основе L. rhamnosus GG, S. boulardii, а также комбинированный пробиотик, содержащий B. lactis ВB-12 и S. thermophilus [33].
В двойном слепом плацебоконтролируемом рандомизированном исследовании показано, что применение смеси на основе гидролизатов сывороточных белков с добавлением B. lactis ВB-12 или L. rhamnosus GG у детей первых месяцев жизни ведет к достоверно более выраженному эффекту по индексу SCORAD по сравнению с применением смеси на основе гидролизатов сывороточных белков без пробиотиков [34]. Еще в одном доказательном исследовании установлено, что на фоне использования Bifidobacterium lactis ВB-12 у детей первых месяцев жизни уменьшаются проявления атопического дерматита [35]. А в недавнем двойном слепом плацебоконтролируемом рандомизированном исследовании было показано, что применение комбинированного пробиотика, содержащего L. acidophilus и B. lactis ВB-12, у детей с поллинозом ведет к некоторому уменьшению выраженности и длительности симптомов ринита, а также достоверно снижает число эозинофилов в слизистой оболочке носа [36].
Таким образом, на сегодня в научной литературе имеется наибольшее количество доказательных данных об эффективности пробиотических штаммов B. lactis ВB-12, S. thermophilus и L. rhamnosus GG при различных заболеваниях ЖКТ, аллергических заболеваниях и ряде других состояний у детей, прежде всего раннего возраста.
В 2009 г. на отечественном фармацевтическом рынке была зарегистрирована новая биологически активная добавка к пище для профилактики и лечения дисбиоза кишечника у детей с первых дней жизни – Бифиформ Бэби («Ферросан А/С» (Дания), свидетельство о государственной регистрации Бифиформ Бэби № RU.77.99.11.003.E.000122.08.10 от 02.08.2010). В состав 1 дозы входят: Bifidobacterium lactis ВB-12 109 КОЕ, Streptococcus thermophilus TH-4 108 КОЕ. Дневная доза составляет 0,5 г препарата в виде суспензии. Важной особенностью этого препарата является то, что он разрешен к применению у детей с самого рождения и выпускается в жидкой форме во флаконах с пипеткой-дозатором. Необходимо отметить, что на сегодня это единственный препарат, разрешенный к применению у детей с такого раннего возраста, со специальной формой выпуска.
Имеющиеся научные данные позволяют рекомендовать пробиотик Бифиформ Бэби для новорожденных и грудных детей, в том числе с отягощенным перинатальным анамнезом, недоношенным, а также для детей, находящихся на искусственном вскармливании, для профилактики развития нарушений микробиоценоза кишечника и их коррекции [37, 38].
В 2010 г. в России зарегистрировано лекарственное средство для детей 3–12 лет, содержащее L. rhamnosus GG 109 КОЕ, B. lactis ВB-12 109 КОЕ и витамины группы В, под названием Бифиформ Кидс («Ферросан А/С» (Дания), регистрационное удостоверение № ЛСР-009020/10 от 31.08.2010). Препарат выпускается в виде жевательных таблеток с апельсиново-малиновым вкусом специально для детей. Учитывая имеющиеся научные данные об эффективности пробиотических штаммов, вошедших в состав препарата Бифиформ Кидс, он показан детям старше 3 лет для лечения острых кишечных инфекций установленной и неустановленной этиологии, включая вирусные диареи, для профилактики и лечения дисбактериозов различной этиологии, в том числе сопровождающихся угнетением иммунной системы, а также в комплексной терапии пищевой аллергии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.