Эбастин в терапии сезонного аллергического ринита
- Аннотация
- Статья
- Ссылки
- English

Согласно результатам исследований, в настоящее время заболеваемость и распространенность аллергических болезней в разных странах достигают 20–40%. Аллергический ринит (АР) относится к наиболее частым аллергическим заболеваниям, им страдает 10–20% населения во всем мире [1].
В исследовании, проведенном в 2001 г. среди взрослого населения (≥ 18 лет) шести европейских стран, распространенность клинически подтвержденного АР варьировалась от 17 до 29% (в среднем 22,7%). При этом отмечалась существенная разница между показателем распространенности АР и частотой реально диагностированных случаев заболевания [2, 3].
По данным официальной статистики, в России аллергические заболевания выявляются у 10–15% населения (в зависимости от региона). Распространенность АР по регионам колеблется от 12,7 до 24%. У детей она достигает 40% [4].
Аллергический ринит характеризуется IgE-опосредованным воспалением, которое развивается в результате попадания аллергенов на слизистую оболочку полости носа, и наличием симптомов, таких как заложенность носа, выделения из носа, чихание, зуд в полости носа [5].
Формирование, развитие и течение АР во многом зависят от наследуемых факторов, предрасполагающих к развитию аллергии и проявляющихся в результате патогенного воздействия внешней среды при нарушении экологии, неправильном питании, снижении иммунитета.
Ранее АР подразделяли на сезонный и круглогодичный. Сезонный аллергический ринит (САР) связан с воздействием двух основных групп аллергенов – пыльцы растений и спор плесневых грибов, как правило вегетирующих на растениях. Заболевание характеризуется строгой сезонностью. Симптомы рецидивируют из года в год в одно и то же время в зависимости от периода цветения определенных видов растений. Интенсивность симптомов обусловлена концентрацией пыльцы в воздухе. У чувствительных пациентов симптомы могут возникать и при низкой концентрации пыльцы. По окончании сезона цветения симптомы исчезают, однако у ряда пациентов может отмечаться так называемый премирующий эффект – постепенное купирование симптомов заболевания в течение двух-трех недель после окончания сезона пыления. Такой феномен объясняется повышенной неспецифической реактивностью слизистой оболочки носа после длительного воздействия пыльцы. Отчетливо прослеживаются влияние погоды на состояние больного, высокая чувствительность в период обострения к неспецифическим раздражителям, таким как уличная пыль, резкие запахи. САР характеризуется появлением клинических симптомов (зуд, чихание, ринорея) через несколько минут после контакта с аллергеном, а у некоторых больных – через 6–12 часов (поздняя фаза аллергической реакции). Поздняя фаза характеризуется более выраженной гиперреактивностью слизистой оболочки носа как на аллергены, так и на неспецифические раздражители.
Круглогодичный аллергический ринит (КАР) связан с воздействием ингаляционных аллергенов жилища, клещей домашней пыли и аллергенов домашних животных, тараканов и др. Заболевание характеризуется периодической или постоянной симптоматикой без выраженных сезонных колебаний на протяжении всего года. При выезде за город симптомы заболевания обычно исчезают или уменьшаются.
Отмечается высокая чувствительность к неспецифическим раздражителям (табачный дым, холодный воздух, химические поллютанты: диоксид серы, озон, угарный газ, диоксид азота). На фоне КАР нередко возникают синусит, евстахиит, отит, гиперплазия аденоидной ткани, носовые кровотечения, приступы сухого кашля. У детей, страдающих КАР, часто имеют место повышенная утомляемость, головная боль, сердцебиение, потливость [6].
Данная классификация была пересмотрена международной группой экспертов ARIA (Allergic Rhinitis and its Impact on Asthma – Аллергический ринит и его влияние на астму) в 2001 г. [7]. Оснований для пересмотра было несколько. Во-первых, в ряде регионов мира воздействие аллергенов пыльцы и плесени может быть круглогодичным. Во-вторых, симптомы АР с сенсибилизацией к бытовым аллергенам присутствуют круглый год далеко не у всех больных. В-третьих, многие пациенты с АР имеют сенсибилизацию как к пыльцевым, так и к бытовым аллергенам. В-четвертых, неспецифические триггеры, воздействующие на пациента круглый год, способны постоянно поддерживать симптомы заболевания.
В основу классификации АР легли частота и выраженность клинических симптомов, а также степень нарушения качества жизни. По частоте АР подразделяют на интермиттирующий и персистирующий, по тяжести – на легкий, среднетяжелый и тяжелый.
Предложенная классификация имеет важное практическое значение. При сезонном и круглогодичном АР симптомы заболевания ассоциируются с теми аллергенами, к которым чувствителен больной. Определения «интермиттирующий» (легкий) и «персистирующий» (среднетяжелый, тяжелый) позволяют оценить выраженность клинических симптомов, их влияние на качество жизни и выбор терапии.
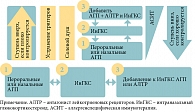
Терапия АР многоступенчатая и зависит от тяжести симптомов (рис. 1) [8].
Предложено несколько алгоритмов лечения АР с учетом его классификации. Большинство рекомендаций в целом согласуются между собой и обычно предполагают ступенчатую схему лечения в соответствии с тяжестью заболевания и видом АР.
Основные направления фармакотерапии АР следующие:
- проведение элиминационных мероприятий;
- назначение коротких курсов деконгестантов (3–5 дней);
- применение системных антигистаминных препаратов с противовоспалительным и противоотечным эффектом (дезлоратадин при САР и КАР, левоцетиризин – при полиорганной аллергии);
- проведение профилактических курсов кромонов (топических и системных);
- использование топической (по показаниям) системной антимикробной, в том числе противогрибковой, терапии;
- назначение топических глюкокортикостероидов (ГКС) короткими курсами при обострении как аллергического, так и бактериального воспаления.
Первая, вторая и третья ступени терапии зависят от тяжести АР. Фармакотерапию АР начинают с приема пероральных или назальных антигистаминных препаратов (АГП) (первая ступень). При неэффективности лечения используются интраназальные ГКС (ИнГКС) (вторая ступень). На третьей ступени к ИнГКС добавляют АГП и/или антагонисты рецепторов лейкотриенов. Если в течение одной-двух недель эффекта не наблюдается, следует пересмотреть диагноз. Если у детей младше двух лет АГП неэффективны, необходимо также пересмотреть диагноз.
Антагонисты Н1-рецепторов первого поколения легко проникают через гематоэнцефалический барьер благодаря своей липофильности и электростатическому заряду. В центральной нервной системе кроме блокады Н1-рецепторов многие антагонисты Н1-рецепторов блокируют мускариновые, серотониновые и альфа-адренергические рецепторы, что также может вызывать сонливость и другие проявления центрального действия этих препаратов. Учитывая побочные эффекты антагонистов H1-рецепторов первого поколения (рис. 2), приоритет следует отдавать антагонистам H1-рецепторов второго поколения [9].
АГП второго поколения являются препаратами первого ряда в лечении различных форм АР. АГП второго поколения отличают высокое сродство к H1-рецепторам (обеспечивает избирательность их блокады, отсутствие связывания с холино- и адренорецепторами и, как следствие, уменьшение побочных эффектов), прочность связывания с H1-рецепторами (гарантирует значительную продолжительность терапевтического действия и возможность однократного приема в течение суток), а также низкая проницаемость гематоэнцефалического барьера (соответственно отсутствуют седативный эффект и вмешательство в психомоторные функции) [10].
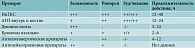
Эффективность препаратов различных групп в отношении контроля симптомов АР неодинакова (таблица) [11].
В клинических рекомендациях Российской ассоциации аллергологов и клинических иммунологов указано, что для достижения значимого терапевтического эффекта необходимо увеличить дозу АГП второго поколения [12]. Среди препаратов, представленных сегодня на отечественном фармацевтическом рынке, двойная дозировка возможна лишь у эбастина. Особенность фармакокинетики препарата состоит в его быстрой метаболизации в фармакологически активный метаболит – каребастин. Начало действия эбастина 10 мг отмечается через 1–1,5 часа после однократного приема. Через 2,5 часа пиковая концентрация каребастина в плазме крови достигает 80–100 нг/мл. Эбастин характеризуется высокой биодоступностью. Прием пищи не влияет на его всасывание из желудочно-кишечного тракта. Благодаря активному связыванию с белками плазмы каребастин имеет высокий объем распределения. Основным способом выведения каребастина из организма является почечная фильтрация, в меньшей степени препарат выделяется с калом. Конечный период полувыведения – 15–19 часов. Уровень максимальной концентрации каребастина в плазме крови возрастает в зависимости от принятой дозы эбастина, но время достижения максимальной концентрации и конечный период полувыведения остаются стабильными при использовании эбастина 10–30 мг. Конечный полупериод выведения сопоставим у молодых и пожилых лиц. Поэтому препарат могут принимать все пациенты без коррекции дозы в зависимости от возраста. Нарушение функции печени и почек оказывает минимальное влияние на фармакокинетику каребастина. Это также облегчает выбор препарата у больных с сопутствующей патологией.
По данным P. Gehhano и соавт. (1996), в дозах (60 мг/сут), в 3–6 раз превышающих терапевтические, эбастин не оказывает существенного влияния на интервал QT. Подтверждение тому – отсутствие разницы с данными, полученными в исследовании плацебо. В то же время, например, терфенадин при трехкратном превышении терапевтической дозы оказывает выраженное нежелательное действие, значительно удлиняя интервал QT [13].
В 2000 г. P. Ratner и соавт. проводили сравнительные клинические исследования эффективности эбастина 20 мг/сут и лоратадина 10 мг/сут у пациентов с персистирующим АР. По сравнению с лоратадином эбастин 20 мг/сут продемонстрировал более значимый клинический эффект, хорошую переносимость. На фоне его применения отсутствовали нежелательные явления [14, 15].
В 2013 г. M. Robert и соавт. в параллельном двойном слепом плацебоконтролируемом клиническом исследовании оценивали эффективность комбинации эбастина 10 мг/сут и деконгестанта для облегчения симптомов простуды. По истечении трех дней от начала терапии в группе комбинированного лечения (эбастин + деконгестант) пациентов с положительной динамикой состояния было больше, чем в группе плацебо. Статистически значимое уменьшение выраженности глазных и носовых симптомов зарегистрировано в группе комбинированной терапии. Наблюдались хорошая переносимость и безопасность совместного применения исследуемых препаратов [16].
В 2015 г. О.С. Бодня и соавт. провели сравнительное рандомизированное клиническое исследование эффективности эбастина, цетиризина и лоратадина у пациентов с сезонным АР. АГП второго поколения в монорежиме успешно купировали как назальные, так и конъюнктивальные симптомы ринита. Все препараты показали высокую терапевтическую эффективность и безопасность в течение двухнедельного курса. На фоне применения эбастина отмечался более быстрый и значимый клинический эффект по сравнению с другими исследуемыми препаратами. Кроме того, ученые оценивали маркер аллергического воспаления в полости носа – эозинофильный катионный протеин, который определяли в назальных смывах до начала и в конце лечения. Снижение этого показателя оказалось более выраженным (на 37%) у пациентов, получавших эбастин [17].
Таким образом, применение эбастина при САР длительными курсами обоснованно, эффективно и безопасно. Препарат имеет преимущества перед другими АГП второго поколения.
V.I. Popaduk, MD, PhD, Prof., I.M. Kirichenko, MD, PhD, Prof., N.S. Tokareva, PhD
People’s Friendship University of Russia
Contact person: Irina M. Kirichenko, loririna@yandex.ru
In the article the results of Russian and foreign authors aimed to investigate the clinical effectiveness of antihistamines in the treatment of seasonal allergic rhinitis. The authors noted ebastine efficacy and safety of long-term use in patients with allergic rhinitis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.