Программная реабилитация иммунной системы в лечении иммунокомпрометированных пациентов с круглогодичным аллергическим ринитом, ассоциированным с рекуррентными ОРВИ и рецидивирующими герпесвирусными инфекциями
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – уточнить особенности нарушений функционирования ИС у пациентов с круглогодичным аллергическим ринитом (КАР), ассоциированным с рекОРВИ и рецХГВИ, и на этой основе разработать программную реабилитацию ИС и оценить ее клинико-иммунологическую эффективность.
Материал и методы. В группу исследования (ГИ) были включены 36 взрослых пациентов обоего пола в возрасте 24–63 лет, страдавших КАР, ассоциированным с рекОРВИ и рецХГВИ. Группу сравнения (ГС) составили 50 условно здоровых лиц, сопоставимых по полу и возрасту с пациентами ГИ. Всем пациентам ГИ были проведены физикальное, иммунологическое и аллергологическое обследования с использованием серологических (иммуноферментный анализ, ImmunoCUP), молекулярно-генетических (полимеразная цепная реакция в реальном времени) методов исследования, проточной цитофлуориметрии и других методов. Все пациенты дали добровольное информированное согласие на участие в исследовании.
Статистическая обработка данных проведена с использованием стандартных компьютерных программ StatPlus.
Результаты и их обсуждение. У пациентов с КАР, ассоциированным с рекОРВИ и рецХГВИ, выявлены клинико-иммунологические критерии иммунокомпрометированности. При оценке клинических критериев установлено, что частота эпизодов рекОРВИ составляла 7,5 (4,8; 10,5) в год, а частота обострений рецХГВИ – 6,5 (5,3; 11,5) в год. Тяжесть симптомов КАР по визуальной аналоговой шкале составила 5,5 (4,0; 6,5) балла. При иммунологическом обследовании выявлен дефицит индуцированной продукции интерферона α (ИФН-α), снижение количества естественных киллерных клеток (ЕКК) CD3-CD16+CD56+ в сочетании со снижением количества цитотоксических Т-лимфоцитов (ЦТЛ) CD3+CD8+. Для коррекции выявленных нарушений в ИС и системе интерферонов разработана программная реабилитация ИС, включающая пролонгированную локальную (гель) и системную (суппозитории) терапию рекомбинантным ИФН-α2b в комплексе с антиоксидантами, а для восстановления ЕКК и ЦТЛ – таргетную иммуномодулирующую терапию препаратом Имунофан®, основной субстанцией которого является синтетический тимический гексапептид. На фоне восстановления количества ЕКК, ЦТЛ и статистически значимого повышения уровня индуцированной продукции ИФН-α наблюдалось достижение контроля над симптомами КАР, статистически значимое снижение частоты эпизодов рекОРВИ и обострений рецХГВИ.
Заключение. Показана высокая клинико-иммунологическая эффективность программной реабилитации ИС с включением интерфероно- и иммуномодулируюшей терапии у иммунокомпрометированных пациентов с КАР, ассоциированным с рекОРВИ и рецХГВИ.
Цель исследования – уточнить особенности нарушений функционирования ИС у пациентов с круглогодичным аллергическим ринитом (КАР), ассоциированным с рекОРВИ и рецХГВИ, и на этой основе разработать программную реабилитацию ИС и оценить ее клинико-иммунологическую эффективность.
Материал и методы. В группу исследования (ГИ) были включены 36 взрослых пациентов обоего пола в возрасте 24–63 лет, страдавших КАР, ассоциированным с рекОРВИ и рецХГВИ. Группу сравнения (ГС) составили 50 условно здоровых лиц, сопоставимых по полу и возрасту с пациентами ГИ. Всем пациентам ГИ были проведены физикальное, иммунологическое и аллергологическое обследования с использованием серологических (иммуноферментный анализ, ImmunoCUP), молекулярно-генетических (полимеразная цепная реакция в реальном времени) методов исследования, проточной цитофлуориметрии и других методов. Все пациенты дали добровольное информированное согласие на участие в исследовании.
Статистическая обработка данных проведена с использованием стандартных компьютерных программ StatPlus.
Результаты и их обсуждение. У пациентов с КАР, ассоциированным с рекОРВИ и рецХГВИ, выявлены клинико-иммунологические критерии иммунокомпрометированности. При оценке клинических критериев установлено, что частота эпизодов рекОРВИ составляла 7,5 (4,8; 10,5) в год, а частота обострений рецХГВИ – 6,5 (5,3; 11,5) в год. Тяжесть симптомов КАР по визуальной аналоговой шкале составила 5,5 (4,0; 6,5) балла. При иммунологическом обследовании выявлен дефицит индуцированной продукции интерферона α (ИФН-α), снижение количества естественных киллерных клеток (ЕКК) CD3-CD16+CD56+ в сочетании со снижением количества цитотоксических Т-лимфоцитов (ЦТЛ) CD3+CD8+. Для коррекции выявленных нарушений в ИС и системе интерферонов разработана программная реабилитация ИС, включающая пролонгированную локальную (гель) и системную (суппозитории) терапию рекомбинантным ИФН-α2b в комплексе с антиоксидантами, а для восстановления ЕКК и ЦТЛ – таргетную иммуномодулирующую терапию препаратом Имунофан®, основной субстанцией которого является синтетический тимический гексапептид. На фоне восстановления количества ЕКК, ЦТЛ и статистически значимого повышения уровня индуцированной продукции ИФН-α наблюдалось достижение контроля над симптомами КАР, статистически значимое снижение частоты эпизодов рекОРВИ и обострений рецХГВИ.
Заключение. Показана высокая клинико-иммунологическая эффективность программной реабилитации ИС с включением интерфероно- и иммуномодулируюшей терапии у иммунокомпрометированных пациентов с КАР, ассоциированным с рекОРВИ и рецХГВИ.




Введение
Актуальность проблемы лечения иммунокомпрометированных пациентов с аллергическими заболеваниями (АЗ), ассоциированными с рецидивирующими вирусными инфекциями, такими как рекуррентные ОРВИ (рекОРВИ) и часто рецидивирующие хронические герпесвирусные инфекции (рецХГВИ), обусловлена сложностью иммунопатогенетических механизмов, лежащих в основе развития этой патологии [1, 2]. В структуре АЗ лидирующую позицию занимает аллергический ринит (АР) [2, 3]. При этом сложной проблемой является формирование коморбидности, которая характеризуется как персистирующим течением КАР, так и наличием рекОРВИ и рецХГВИ, которые поддерживают хроническое воспаление как аллергического, так и инфекционного генеза. Данные литературы свидетельствуют о том, что возбудители респираторных и герпесвирусных инфекций часто являются коинфицирующими агентами [4]. Кроме того, немаловажным фактом является и то, что герпесвирусы проявляют пантропизм и способны поражать клетки иммунной системы (ИС) и, как следствие, вызывать дисбаланс в работе мукозального и системного иммунитета [4]. Все эти факторы, вместе взятые, приводят к формированию торпидности к противоаллергической, противовоспалительной и противоинфекционной терапии, что утяжеляет течение КАР [5–8].
При аллергическом воспалении слизистых оболочек респираторного тракта имеет место поляризация в сторону Т2 типа иммунного ответа. Показано, что у этих пациентов развивается комбинированная патология ИС, которая характеризуется, с одной стороны, Т2 типом иммунного ответа, что обусловливает течение аллергической патологии, с другой стороны, нарушением противовирусных механизмов как врожденного, так и адаптивного иммунитета, системы интерферонов (ИФН), что способствует возникновению сложной аллергической и вирусной инфекционной патологии [9–13].
Изучение особенностей и нарушений противовирусных механизмов иммунной защиты у пациентов с АЗ, ассоциированными с рекОРВИ и рецХГВИ, может послужить основой для создания новых персонифицированных подходов к комбинированной терапии, направленной не только на лечение АЗ, но и на реабилитацию ИС, восстановление дисбаланса в работе мукозального и системного иммунитета [14–19].
В последние годы разными авторами предлагается достаточно большое количество терапевтических стратегий по лечению этих пациентов, которые в том числе включают применение иммунотропных препаратов [10–19].
Однако до настоящего времени ни одна из применяемых схем и тактик терапии не была достаточно успешной, и эффективность проводимой терапии по-прежнему остается достаточно низкой. Это формирует актуальную потребность в создании персонифицированного подхода к пациентам с КАР, ассоциированным с рекОРВИ и рецХГВИ, и разработку программной реабилитации ИС, что должно позволить не только снизить частоту повторных ОРВИ и рецидивирующих ГВИ, но и привести к достижению контроля над симптомами КАР.
Цель исследования – уточнить особенности нарушений функционирования ИС у пациентов с КАР, ассоциированным с рекОРВИ и рецХГВИ, и на этой основе разработать программную реабилитацию ИС и оценить ее клинико-иммунологическую эффективность.
Материал и методы
Группа исследования (ГИ) включала 36 пациентов обоего пола (25 женщин и 11 мужчин) в возрасте от 24 до 63 лет. У всех пациентов более трех лет отмечались клинические симптомы КАР среднетяжелой/тяжелой степени тяжести, ассоциированные с частыми эпизодами рекОРВИ и/или обострениями рецХГВИ, до включения в исследование. Группу сравнения (ГС) составили 50 условно здоровых лиц, сопоставимых по полу и возрасту с пациентами ГИ.
Проведен сбор жалоб и анализ анамнестических данных, физикальное обследование пациентов. Для определения степени выраженности симптомов КАР была использована десятибалльная визуальная аналоговая шкала (ВАШ), которая включала оценку выраженности клинических симптомов, таких как чихание, ринорея, заложенность носа, снижение обоняния, зуд в носу и т.д. Для выявления признаков иммунокомпрометированности у пациентов ГИ был применен критериальный подход, разработанный ранее И.В. Нестеровой и Е.О. Халтуриной [20], включающий определение клинических и иммунологических критериальных признаков иммунокомпрометированности. Для пациентов ГИ при оценке признаков иммунокомпрометированности были выбраны: два важных критериальных признака – частота эпизодов рекОРВИ в год и частота обострений рецХГВИ в год.
Из оцениваемых иммунологических критериальных признаков иммунокомпрометированности были выбраны: количество лейкоцитов, лимфоцитов, нейтрофильных гранулоцитов (НГ), цитотоксических Т-лимфоцитов (ЦТЛ), естественных киллерных клеток (ЕКК), комплексная оценка системы ИФН.
Критериями включения пациентов в ГИ являлись:
- наличие круглогодичного течения АР с неудовлетворительным эффектом лечения – неполный контроль симптомов КАР на фоне проводимой стандартной противоаллергической терапии (применение топических моно- и комбинированных глюкокортикостероидов (ГКС), системная противоаллергическая терапия антигистаминными и антилейкотриеновыми препаратами);
- отсутствие в анамнезе аллерген-специфической иммунотерапии в течение последнего года;
- отсутствие в анамнезе использования биологической иммунотерапии в течение последнего года;
- отсутствие в анамнезе терапии системными ГКС в течение последнего года.
- Критерии исключения:
- беременность любого срока гестации;
- возраст до 18 лет;
- онкологические заболевания;
- аутоиммунные заболевания;
- хронические инфекционно-воспалительные и соматические заболевания в стадии декомпенсации;
- ВИЧ/СПИД, парентеральные вирусные гепатиты;
- болезни крови.
Для уточнения спектра сенсибилизации и оценки уровня общего и специфического иммуноглобулина E использовали иммуноферментный анализ (ИФА, Labsystems Multiskan Ascent, Финляндия, тест-система ЗАО «Вектор-Бест», Россия) и/или метод молекулярной аллергодиагностики, основанный на применении иммуночипа ImmunоCAP (Thermo Fisher Scientific, США). Для детекции и определения типа герпесвирусов в биоматериалах (кровь, слюна, соскоб с миндалин) были применены молекулярно-генетический (полимеразная цепная реакция в реальном времени, тест-система «АмплиСенс», Россия) и серологический (ИФА, Labsystems Multiskan Ascent, Финляндия, тест-система ЗАО «Вектор-Бест», Россия) методы исследования. Изучение параметров иммунного статуса пациентов проведено методом проточной цитометрии (оценка основных параметров клеточного иммунитета: Т-лимфоциты – CD3+, CD3+CD4+, CD3+CD8+, ЕКК – CD3-CD16+CD56+, В-клетки – CD19+ и др. (Cytomics FC-500, Beckman Coulter, США, МКАТ Beckman Coulter International S.A., Франция)), изучена спонтанная и индуцированная продукция ИФН-α (ИФА, Labsystems Multiskan Ascent, Финляндия, тест- система ЗАО «Вектор-Бест», Россия).
Исследование проводилось на базе клинико-диагностического центра «МЕДСИ на Белорусской» (г. Москва).
Исследование одобрено комиссией по вопросам этики, у всех пациентов получено добровольное информированное согласие на участие в исследовании и на обработку персональных данных согласно Хельсинкской декларации Всемирной медицинской ассоциации (WMA Declaration of Helsinki, 2013 г.).
Статистическая обработка данных проведена с использованием стандартных компьютерных программ StatPlus (версия 17.0 для Windows). Для анализа применены методы непараметрической статистики, результаты представлены в виде медианы (Ме) и интерквартильного размаха (Q1; Q3).
Различия считали статистически значимыми при р < 0,05.
Результаты
На момент включения в исследование все пациенты ГИ получали стандартную терапию КАР, подразумевающую применение топических ГКС (в моно- и комбинированной форме), антигистаминных и антилейкотриеновых препаратов в рекомендованных инструкциями дозах. Однако на фоне проводимой терапии контроля над симптомами КАР достигнуто не было, а выраженность симптомов по ВАШ оставалась достаточно высокой и составляла 5,5 (4,0; 6,5) балла. Кроме того, при возникновении эпизодов ОРВИ дополнительно к базисной противоаллергической терапии пациенты ГИ получали локальную терапию антисептическими средствами. Пациенты ГИ, страдавшие КАР, ассоциированным с частыми рецидивами ХГВИ, получали курсы пролонгированной супрессивной противогерпетической терапии синтетическими нуклеозидами, на фоне которых достичь стойкой клинической ремиссии также не удалось.
В процессе проведения исследования все пациенты ГИ, страдавшие КАР, ассоциированным с частыми ОРВИ, были консультированы у оториноларинголога с выполнением передней риноскопии, проведением микроскопического и бактериологического исследований материала из зева и носовых ходов, лучевой диагностики. По показаниям им была проведена санация очагов хронической бактериальной инфекции носоглотки, однако на фоне терапии урежения частоты эпизодов ОРВИ достигнуто не было.
В ходе исследования у пациентов ГИ было проведено изучение клинических и иммунологических критериев иммунокомпрометированности.
При изучении клинических особенностей пациентов ГИ выявлен ряд клинических критериальных признаков иммунокомпрометированности, являющихся клиническими проявлениями имеющегося у этих пациентов иммунодефицита. Показано, что 28,4% пациентов страдают частыми эпизодами рецХГВИ, основными этиологическими факторами которых являются вирусы простого герпеса (ВПГ) 1 и/или 2 типа. Частота обострений ГВИ, вызываемых ВПГ1 и/или ВПГ2, в среднем составляла 6,5 (5,3; 11,5) раза в год. У 24,9% пациентов обострения ГВИ были ассоциированы с эпизодами рекОРВИ, среди них у 46,7% пациентов имели место повторные эпизоды ОРВИ, ассоциированные с активацией вируса Эпштейна – Барр (ВЭБ) и вируса человеческого герпеса 6 типа (ВЧГ6). При этом частота эпизодов рекОРВИ в среднем составляла 7,50 (4,75; 10,50) раза в год.
При анализе коморбидного статуса у 58,82% пациентов ГИ были выявлены другие аллергические заболевания, при этом доминирующими нозологическими формами аллергопатологии являлись аллергический дерматит, хроническая крапивница, бронхиальная астма, атопический конъюнктивит и др. Установлено, что у 64,7% пациентов ГИ имели место сопутствующие хронические заболевания ЛОР-органов (преимущественно хронический тонзиллит, хронический гайморит), а 25% пациентов страдали дисбиотическими нарушениями микробиома кишечника в сочетании с бактериальными инфекциями кожи (пиодермия, фурункулез и другие гнойно-воспалительные инфекции).
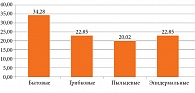
При анализе профиля сенсибилизации у пациентов ГИ было выявлено, что сенсибилизация к широкому спектру бытовых аллергенов является преобладающей и наблюдается у 34,3% пациентов. Сенсибилизация к аллергенам микроскопических грибков и разнообразным эпидермальным аллергенам выявлялась значительно реже – в 22,9% случаев. Сенсибилизация к пыльцевым аллергенам детектирована у 20,0% пациентов ГИ (рис. 1).
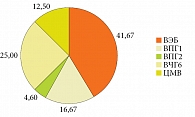
При изучении спектра герпесвирусов, встречающихся в структуре ХГВИ, лидирующую позицию занимал ВЭБ – 41,67%. В 25% случаев детектировался ВЧГ6, в 16,67% – ВПГ1. У 12,5% пациентов обнаружен цитомегаловирус (ЦМВ). В 4,6% случаев выявлен ВПГ2. При этом у 37,5% пациентов установлена микст-ХГВИ с доминированием ВЭБ (рис. 2).
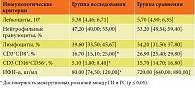
При изучении состояния системы противовирусной иммунной защиты у пациентов ГИ выявлено статистически значимое снижение количества CD3+CD8+ субпопуляции ЦТЛ, дефицит ЕКК, а также нарушение индуцированной продукции ИФН-α в 100% случаев (табл. 1). При этом важно отметить, что достоверных отличий показателей формулы периферической крови от показателей пациентов ГС выявлено не было (см. табл. 1).
Таким образом, на основании выявленных особенностей и дефектов функционирования основных звеньев противовирусной иммунной защиты и системы интерферонов, а также установленных клинических критериев иммунокомпрометированности у пациентов ГИ была разработана программная реабилитация ИС, включающая иммунопатогенетически обоснованную иммунофармакотерапию, направленную на таргетную коррекцию выявленных нарушений (табл. 2).
Для пациентов ГИ, которые продолжали получать начатую ранее стандартную противоаллергическую терапию КАР, разработанная программная реабилитация ИС включала таргетную пролонгированную локальную и системную интерферонотерапию рекомбинантным ИФН-α2b (рИФН-α2b) в комплексе с антиоксидантами, направленную на коррекцию нарушений в системе ИФН, а именно коррекцию индуцированной продукции ИФН-α. Интерферонотерапия состояла из локальной (гель) и системной (суппозитории) терапии рИФН-α2b в комплексе с антиоксидантами в дозе 3 млн МЕ/сут в течение одного месяца. Далее дозы препарата градуированно снижали каждые три недели вплоть до полной отмены. Курс интерферонотерапии составил три месяца. При обострении инфекции, вызванной ВПГ1 или ВПГ2, назначался короткий курс синтетических противовирусных препаратов (валацикловир) – 1000 мг/сут в течение десяти дней.
Для восстановления функциональной активности ЦТЛ и ЕКК был использован препарат Имунофан®, основной действующей субстанцией которого является синтетический аналог активного центра гормона тимуса тимопоэтина – гексапептид (ГП) (аргинил-α-аспартил-лизил-валил-тирозил-аргинин). Пациенты ГИ получали ГП интраназально десятидневными курсами в суточной дозировке 180 мг с частотой проведения курса один раз в месяц на протяжении трех месяцев.
После завершения программы терапии была проведена комплексная оценка клинической и иммунологической эффективности программной реабилитации ИС этих пациентов с использованием ранее выделенных критериальных признаков.
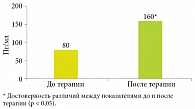
Установлено статистически значимое снижение выраженности симптомов КАР в 2,2 раза по ВАШ – с 5,5 до 2,5 балла. Отмечено уменьшение частоты эпизодов ОРВИ в три раза (с 7,5 до 2,5 раза в год) и частоты рецидивов ХГВИ в 1,9 раза (с 6,5 до 3,5 раза в год) у пациентов ГИ (табл. 3, рис. 3).
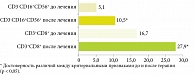
При анализе гемограмм пациентов ГИ статистически значимых изменений общего количества лейкоцитов и лимфоцитов периферической крови не было установлено. Отмечалась тенденция к восстановлению содержания НГ (см. табл. 2). В то же время при оценке субпопуляционного состава клеток периферической крови было показано увеличение в два раза количества ЕКК, а также в 1,7 раза количества ЦТЛ (табл. 4, рис. 4).
Кроме того, у пациентов ГИ после проведения курса программной реабилитации ИС, включающей таргетную интерфероно- и иммуномодулирующую терапию, наблюдалось статистически значимое повышение уровня индуцированной продукции ИФН-α более чем в два раза по сравнению с исходным уровнем, однако таковое не достигало показателей ГС (рис. 5).
Обсуждение
В настоящем исследовании получены данные о наличии дефектов функционирования врожденного и адаптивного звеньев ИС у пациентов, страдающих КАР, ассоциированным с рекОРВИ и рецХГВИ.
У пациентов ГИ выявлены различные нарушения ИС и системы интерферонов: статистически значимое снижение количества лимфоцитов врожденного иммунитета – ЕКК CD3-CD16+CD56+, лимфоцитов адаптивного иммунитета – CD3+CD8+ ЦТЛ, значительный дефицит индуцированной продукции ИФН-α.
У пациентов с КАР средней степени тяжести, неадекватно отвечавших на стандартную противоаллергическую терапию, установлено наличие клинических критериев иммунокомпрометированности: частота эпизодов рекОРВИ – более 11,5 в год, обострений рецХГВИ – более 10,5 в год.
Разработанная и иммунопатогенетически обоснованная, с учетом данных о выявленных нарушениях в системе противовирусной иммунной защиты и системе интерферонов, программная реабилитация ИС у пациентов с КАР, ассоциированным с рекОРВИ и рецХГВИ, включала интерфероно- и таргетную иммуномодулирующую терапию, стандартную противоаллергическую и противовирусную терапию синтетическими нуклеозидами. При этом с целью коррекции системы интерферонов использовалась пролонгированная локальная и системная терапия рИФН-α2b в комплексе с антиоксидантами (гель и суппозитории в адекватных дозах). Обладая плейотропными эффектами на ЕКК и ЦТЛ, тимический ГП, являющийся синтетическим аналогом активного центра гормона тимуса тимопоэтина, – препарат Имунофан®, оказал позитивное иммуномодулирующее влияние на лимфоциты врожденного и адаптивного иммунитета посредством связывания с их рецепторами нейронального типа.
Следует подчеркнуть, что разработанная программная реабилитация ИС продемонстрировала высокую позитивную клинико-иммунологическую эффективность, что выражалось в статистически значимом снижении выраженности симптомов КАР в два раза по ВАШ, частоты рекОРВИ в три раза, частоты рецХГВИ в 1,9 раза, произошедшем на фоне восстановления количества клеток врожденного ЕКК CD3-CD16+CD56+ и адаптивного иммунитета CD3+CD8+ ЦТЛ и статистически значимого увеличения индуцированной продукции ИФН-α.
Выводы
- Пациенты, страдающие КАР средней степени тяжести, ассоциированным с рекОРВИ и рецХГВИ, имеют клинические критериальные признаки иммунокомпрометированности.
- Установлены особенности нарушений функционирования системы противовирусной иммунной защиты (дефицит ЕКК, ЦТЛ) и системы ИФН (дефицит индуцированной продукции ИФН-α) у пациентов с КАР средней степени тяжести, ассоциированным с рекОРВИ и рецХГВИ.
- Выявленные нарушения противовирусной иммунной защиты: дефицит ЕКК и ЦТЛ, а также дефицит индуцированной продукции ИФН-α, обусловливают возникновение частых, повторных эпизодов ОРВИ и рецидивирование хронической ГВИ, что усугубляет тяжесть проявлений КАР.
- Разработанная иммунопатогенетически обоснованная программная реабилитация ИС, включающая применение таргетной интерферонотерапии с использованием рИФН-α2b в сочетании с антиоксидантами и иммуномодулирующей терапией препаратом Имунофан®, проведенная на фоне стандартной комплексной терапии КАР, продемонстрировала высокую клинико-иммунологическую эффективность.
- Повышение эффективности проводимой стандартной противоаллергической терапии КАР произошло на фоне снижения вирусной нагрузки, о чем свидетельствует урежение частоты эпизодов рекОРВИ и рецХГВИ после проведения программной реабилитации ИС и системы интерферонов, способствовавшей восстановлению противовирусной иммунной защиты.
I.V. Nesterova, MD, PhD, Prof., E.O. Khalturina, MD, PhD, N.V. Garskova
Academy of Postgraduate Education of the Federal Scientific and Clinical Center of the Federal Medical-Biological Agency
Peoples' Friendship University named after Patrice Lumumba
MEDSI Clinical Diagnostic Center at Belorusskaya, Moscow
Sechenov First Moscow State Medical University (Sechenov University)
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
The relevance problem of treating immunocompromised patients with allergic diseases (AD) associated with recurrent viral infections, such as recurrent acute respiratory viral infections (ARVI) and frequently recurrent chronic herpes virus infections (recCHVI) is due to the complexity of the immunopathogenetic mechanisms underlying the development of this pathology. Various allergic diseases associated with recARVI and recCHVI occur against the background of persistent inflammation of the mucous layer of the respiratory tract, which is facilitated by a variety of disorders of the innate and adaptive parties of the immune system (IS). The study of the features and disorders of antiviral mechanisms of immune defense in patients with AD associated with recARVI and recCHVI can serve as the basis for the creation of new personalized approaches to combination therapy aimed not only at treating AD, but also at rehabilitating the IS, restoring imbalances in the work of the mucosal and systemic immunity.
The aim – to clarify the features of disorders of the functioning of the IS in patients with year-round allergic rhinitis (YAR) associated with recARVI and recCHVI and on this basis to develop a programmed rehabilitation of the IS and assess its clinical and immunological effectiveness.
Material and methods. The study group (SG) included 36 adult patients of both sexes aged 24–63 years suffering from YAR associated with recARVI and recCHVI. The comparison group (CG) consisted of 50 conditionally healthy individuals, comparable in sex and age with SG patients. All patients from SG underwent physical, immunological and allergological examinations using serological (enzyme immunoassay, ImmunoCUP), molecular genetic (real-time polymerase chain reaction) research methods, flow cytofluorimetry and other methods. Voluntary informed consent was obtained from all patients.
Statistical processing was carried out using StatPlus standard computer programs.
Results and discussion. Clinical and immunological criteria of immunocompromitation were identified in patients with YAR associated with recRCVI and recCHVI. The assessment of clinical criteria revealed that frequency of recARVI episodes 7.5 (4.8; 10.5) per year, and the frequency of exacerbations of recCHVI 6.5 (5.3; 11.5) per year. The severity of YAR symptoms by VAS was 5.5 (4.0; 6.5). Immunological examination revealed a deficiency in the induced production of interferon α (IFN-α), a decrease in the number of natural killer cells (NK) CD3-CD16+CD56+, in combination with a decrease in the number of cytotoxic T-lymphocytes (CTL) CD3+CD8+. To correct the identified disorders in the IS and interferon system, a program rehabilitation of the IS was developed, including prolonged local (gel) and systemic (suppositories) therapy with rIFN-α2b in combination with antioxidants, and targeted immunomodulatory therapy with Imunofan®, the main substance of which is synthetic thymic hexapeptide. Against the background of a recovery in the number of NK, CTL and a statistically significant increase in the level of induced IFN-α production, achieved control over the symptoms of YAR, a statistically significant decrease in the frequency of episodes of acute respiratory viral infections and exacerbations of recCHVI.
Conclusion. The high clinical and immunological efficacy of programmed rehabilitation of the IS including interferon and immunotherapy in immunocompromised patients with YAR associated with recARVI and recCHVI was shown.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.