количество статей
7131
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Эффективность и токсичность химиотерапии по схеме FOLFIRINOX у больных диссеминированным раком желудка. Предварительные результаты
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Онкология, Гематология и Радиология" №4
- Аннотация
- Статья
- Ссылки
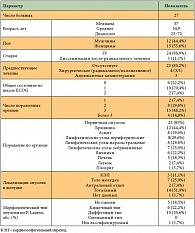
Таблица 1. Характеристика пациентов
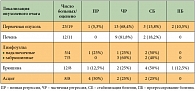
Таблица 2. Эффективность химиотерапии 1-й линии по схеме FOLFIRINOX в зависимости от локализации опухолевых очагов

Таблица 3. Частота гематологической токсичности по числу больных (n = 27)

Таблица 4. Частота гематологической токсичности по числу курсов химиотерапии (n = 179)
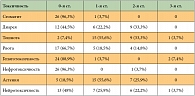
Таблица 5. Частота негематологической токсичности по числу больных (n = 27)
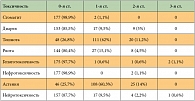
Таблица 6. Частота негематологической токсичности по числу курсов химиотерапии (n = 179)

Таблица 7. Эффективность трехкомпонентных режимов химиотерапии при диссеминированном раке желудка
<p class="x-text">Рак желудка остается одним из самых распространенных злокачественных новообразований в мире, занимая по частоте встречаемости четвертое место после опухолей легкого, молочной железы и толстой кишки.</p>
<p class="x-text">Скрытое бессимптомное течение рака желудка, низкий уровень онкологической настороженности среди населения и медицинского персонала приводят к выявлению уже неоперабельного процесса у 50% пациентов. Продолжительность жизни больных диссеминированным раком желудка, не получающих специфическое противоопухолевое лечение, колеблется в пределах от 3 до 5 месяцев [1, 2]. Основным методом лечения данной категории пациентов является химиотерапия, которая позволяет увеличить продолжительность жизни больных до 1 года при выживаемости без прогрессирования болезни до 6 мес. и более, а также устранить или облегчить симптомы, связанные с опухолью, улучшая тем самым качество жизни пациентов [3].</p>
<p class="x-text">Метаанализ рандомизированных исследований II и III фазы продемонстрировал статистически значимое увеличение частоты достижения объективного эффекта и медианы общей выживаемости больных при назначении полихимиотерапии по сравнению с монохимиотерапией и оптимальной симптоматической терапией [4, 5]. Сравнительный анализ эффективности двух- и трехкомпонентных режимов химиотерапии показал статистически достоверное улучшение выживаемости больных при использовании трехкомпонентных режимов по сравнению с двухкомпонентным<a name="anchor-57-anchor" id="anchor-57-anchor" >и [6].</a></p>
<a name="anchor-57-anchor" id="anchor-57-anchor" >
<p class="x-text">В настоящее время одной из наиболее эффективных схем химиотерапии при диссеминированном раке желудка является DCF (доцетаксел + цисплатин + 5-фторурацил (5-ФУ) в режиме суточных инфузий) [7]. Однако применение данной комбинации ограничено высокой токсичностью. В крупном исследовании V-325 лечение по схеме DCF осложнилось нейтропенией 3–4-й степени у 82% больных, в том числе у 29% сопровождалось фебрильной лихорадкой. Таким образом, разработка более эффективных, но менее токсичных режимов лечения больных диссеминированным раком желудка является, неоспоримо, задачей актуальной и своевременной.</p>
</a>
<p class="x-text"><a name="anchor-57-anchor" id="anchor-57-anchor" >Учитывая превосходящую эффективность трехкомпонентных режимов (при раке желудка), в отделении химиотерапии ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН в 2011 г. инициировано исследование по изучению эффективности и токсичности трехкомпонентной комбинации FOLFIRINOX: иринотекан + оксалиплатин + лейковорин и 46-часовая инфузия 5-ФУ, которая уже продемонстрировала высокую эффективность при раке толст</a><a name="anchor-58-anchor" id="anchor-58-anchor" >ой кишки и поджелудочной ж</a><a>е</a>лезы [8, 9]. По предварительным результатам исследований II фазы, данная комбинация является высокоэффективной у больных диссеминированным раком желудка при хорошем профиле токсичности [10, 11]. В данной статье мы представляем промежуточные результаты исследования лечения 27 пациентов.</p>
<p class="x-podzag-"><b>Материалы и методы</b></p>
<p class="x-text">Критериями включения в исследование являлись:</p>
<ul>
<li class="x-text-bull">морфологически подтвержденный неоперабельный рак желудка или пищеводно-желудочного перехода (стадия IV);</li>
<li class="x-text-bull">возраст старше 18 лет;</li>
<li class="x-text-bull">оценка общего состояния больного ≤ 2 баллов по шкале Восточной объединенной группы онкологов (Eastern Cooperative Oncology Group – ECOG, 0–4 балла);</li>
<li class="x-text-bull">адекватная функция костного мозга (гемоглобин ≥ 9 г/дл,
<br />
нейтрофилы ≥ 1,5 × 109/л, тромбоциты ≥ 100 × 109/л), печени (уровень общего билирубина ≤ 1,5 верхней границы нормы (ВГН), аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) ≤ 2,5 ВГН (при наличии метастазов в печени –
<br />
≤ 5 ВГН), щелочной фосфатазы ≤ 5 ВГН), почек (концентрация креатинина сыворотки < 115 мкмоль/л, клиренс креатинина ≥ 50 мл/мин);</li>
<li class="x-text-bull">предполагаемая продолжительность жизни более 3 месяцев;</li>
<li class="x-text-bull">отсутствие химиотерапии с лечебной целью по поводу рака желудка.</li>
</ul>
<p class="x-text">Адъювантная химиотерапия, если таковая проводилась, должна быть завершена, по крайней мере, за 6 месяцев до начала паллиативной химиотерапии.</p>
<p class="x-text">Критериями исключения были следующие:</p>
<ul>
<li class="x-text-bull">признаки декомпенсированного стеноза желудка, кишечной непроходимости, активного желудочно-кишечного кровотечения;</li>
<li class="x-text-bull">выявленное метастатическое поражение центральной нервной системы;</li>
<li class="x-text-bull">активный неконтролируемый инфекционный процесс;</li>
<li class="x-text-bull">хроническая диарея;</li>
<li class="x-text-bull">периферическая полинейропатия ≥ 2 степени по Оценочной шкале общих критериев токсичности Национального института исследования рака (National Cancer Institute – Common Toxicity Criteria – NCI-CTC) v. 3.0.;</li>
<li class="x-text-bull">сопутствующие заболевания в стадии декомпенсации (сахарный диабет, сердечно-сосудистые, легочные заболевания, болезни печени и почек), психические расстройства, включая деменцию, шизофрению, алкоголизм.</li>
</ul>
<p class="x-text">До начала лечения с целью установления распространенности процесса проводилось обследование, включающее:</p>
<ul>
<li class="x-text-bull">ультразвуковое исследование (УЗИ) шейно-надключичных зон, брюшной полости, забрюшинного пространства, полости малого таза;</li>
<li class="x-text-bull">эзофагогастродуоденоскопию (ЭГДС);</li>
<li class="x-text-bull">рентгенографию желудка;</li>
<li class="x-text-bull">рентгенографию органов грудной клетки;</li>
<li class="x-text-bull">электрокардиографию; </li>
<li class="x-text-bull">онкомаркеры (РЭА (раково-эмбриональный антиген), СА19-9, СА72-4);</li>
<li class="x-text-bull">клинический и биохимический анализы крови;</li>
<li class="x-text-bull">по показаниям – компьютерная томография (КТ) брюшной, грудной полостей, сцинтиграфия и рентгенография костей, лапароскопия.</li>
</ul>
<p class="x-text">Включенные в исследование пациенты получали химиотерапию в режиме FOLFIRINOX: иринотекан – в дозе 150–180 мг/м2 в 1 день, оксалиплатин – в дозе 85 мг/м2 в 1 день, лейковорин – 200 мг/м2
<br />
в 1 день, 5-ФУ – 250–400 мг/м2 струйно в 1 день с последующей 48-часовой инфузией 5-ФУ в дозе 2000–2600 мг/м2. Курсы повторяли каждые 2 недели. Лечение сопровождалось проведением стандартной антиэметической терапии (блокаторы 5-HT3-рецепторов, дексаметазон ± блокатор рецепторов нейрокинина-1 (NK1) апрепитант), на фоне кальциево-магниевой пре- и постмедикации с целью профилактики острой нейротоксичности оксалиплатина.</p>
<p class="x-text">Эффективность лечения оценивали каждые 3 курса химиотерапии, используя критерии RECIST (Response Evaluation Criteria in Solid Tumors – критерии оценки ответа солидных опухолей на терапию) 1.1, токсичность – каждый курс. Пациентам с исходной локализацией отдаленных метастазов на брюшине, выявленных только при лапароскопии, повторную лапароскопию выполняли после 6–9 курсов химиотерапии при отсутствии признаков прогрессирования процесса. Для подтверждения полной регрессии метастазов по брюшине во время лапароскопии обязательным являлось выполнение множественной биопсии брюшины и взятие смывов с брюшины с последующим морфологическим исследованием. При морфологическом подтверждении полной регрессии метастазов пациенты были консультированы хирургом с последующим хирургическим лечением. После завершения 9 курсов лечения и в отсутствие прогрессирования болезни поддерживающая терапия не назначалась, проводили динамическое наблюдение за больным. В случае выявления прогрессирования болезни более чем через 3 месяца от окончания химиотерапии возобновлялось лечение по прежней схеме. Если прогрессирование болезни фиксировали в течение 3 месяцев после завершения химиотерапии по схеме FOLFIRINOX, пациенту назначали химиотерапию 2-й линии по схеме: доцетаксел 65 мг/м2 в 1 день + капецитабин по 1500 мг/м2 в сутки, разделенных на 2 приема, внутрь, с вечера первого дня по утро 15-го дня курса + бевацизумаб 7,5 мг/кг в день 1 (при отсутствии противопоказаний к нему). Повторение цикла – каждые 21 день.</p>
<p class="x-text">На момент анализа в исследование включено 27 больных:
<br />
12 мужчин и 15 женщин в возрасте от 23 до 72 лет (табл. 1). Средний возраст пациентов составил 55 лет, медиана возраста – 57 лет. У 24 (88,9%) больных исходно был диагностирован диссеминированный рак желудка (IV стадия), из них у одного пациента метастазы в печень были выявлены интраоперационно, однако в связи с высоким риском развития желудочного кровотечения была выполнена паллиативная гастрэктомия. У 7 из 24 больных диссеминация опухолевого процесса в виде канцероматоза брюшины была выявлена во время диагностической лапароскопии. Генерализация болезни после радикальной операции по поводу рака желудка III стадии, дополненной адъювантной химиотерапией, выявлена у 3 пациентов.</p>
<p class="x-text">Первичная опухоль присутствовала у 23 больных, из них тотальный рак желудка –
<br />
у 14 (51,9%), рак тела желудка – у 7 (25,9%), кардиоэзофагеального перехода (КЭП) – у 3 (11,1%), антрального и пилорического отделов – у 2 пациентов (7,4%). Локализация метастатических очагов была следующей: в печени – у 5 (18,5%), канцероматоз брюшины – у 12 (44,4%), в том числе с асцитом – у 8 (29,6%), метастатическое поражение яичников было выявлено у 6 (22,2%), забрюшинных лимфоузлов – у 7 (25,9%), периферических лимфоузлов – у 8 (29,6%) пациентов. Вовлечение в опухолевый процесс 3 и более органов отмечено у 63% больных. Таким образом, контингент включенных в исследование больных характеризуется обширным распространением опухолевого процесса.</p>
<p class="x-text">Все больные были в общем удовлетворительном состоянии, оцененном по шкале ECOG как 0, 1 и 2 соответственно у 6 (22,2%), 19 (70,4%) и 2 (7,4%) пациентов.</p>
<p class="x-text">Морфологический тип опухоли по классификации P. Lauren определен у 22 пациентов, среди которых преобладающим оказался диффузный – у 68,2%, кишечный – у 27,3%, неклассифицируемый – у 4,5% больных.</p>
<p class="x-podzag-"><b>Характеристика лечения</b></p>
<p class="x-text">Всего 27 больным было проведено 179 курсов химиотерапии по схеме: иринотекан в дозе 150–180 мг/м2 + оксалиплатин в дозе 85 мг/м2 + лейковорин в дозе 200 мг/м2 ± 5-ФУ по 250–400 мг/м2 струйно + 5-ФУ по 2000–2600 мг/м2 в виде 48-часовой инфузии. Дозы препаратов корректировали в зависимости от токсичности лечения. Медиана количества курсов, проведенных одному больному, равняется 6 (от 1 до 9 курсов).</p>
<p class="x-text">Трем пациентам при прогрессировании болезни после 1-й линии химиотерапии по схеме FOLFIRINOX производилась реиндукция химиотерапии в прежнем режиме в связи с длительной ремиссией.</p>
<p class="x-text">Причинами прекращения лечения явились: плановое решение в связи с проведением лечения в полном объеме (9 курсов химиотерапии) – у 10 (58,8%), прогрессирование процесса – у 5 (29,4%), токсичность лечения – у 2 пациентов (11,8%) (аллергическая реакция в виде выраженной кожной сыпи после 2-го курса лечения, гепатотоксичность 3-й степени после 7-го курса).</p>
<p class="x-podzag-"><b>Эффективность лечения</b></p>
<p class="x-text">Оценка эффективности лечения производилась у всех больных, получивших 2 и более курсов химиотерапии. На момент анализа непосредственная эффективность лечения оценена у 23 пациентов.</p>
<p class="x-text">Объективный эффект был зарегистрирован у 13 (56,5%) больных: полная регрессия опухоли – у одного (4,3%), частичная регрессия опухоли – у 12 (52,2%). У 8 (34,8%) больных была отмечена стабилизация, у 2 (8,7%) – прогрессирование болезни. Таким образом, контроль роста опухоли был достигнут у 91,4% пациентов. Медиана длительности частичной регрессии составила 5+ мес. (от 0,57+ мес. до 8,83+ мес.), медиана длительности стабилизации болезни – 4,43+ мес. (от 3,1 до 8,03+ мес.).</p>
<p class="x-text">После завершения 9 курсов химиотерапии 2 пациентам с исходной локализацией отдаленных метастазов только на брюшине для оценки эффекта лечения была выполнена повторная лапароскопия. Во время лапароскопии ранее визуализированных изменений по брюшине выявлено не было. По результатам морфологического исследования множественных биоптатов брюшины и смывов с брюшины у обоих пациентов опухолевые клетки не обнаружены, что позволило констатировать полную регрессию отдаленных метастазов и выполнить им R0-гастрэктомию. У одного пациента при морфологическом исследовании послеоперационного материала зарегистрирована полная регрессия и первичной опухоли, у второй пациентки в опухоли желудка отмечены явления лекарственного патоморфоза 2-й степени, таким образом, эффект лечения расценен как частичная регрессия. Оба пациента в настоящее время находятся под динамическим наблюдением без признаков прогрессирования болезни. В связи с проведением химиотерапии (9 курсов) в полном объеме до операции послеоперационная химиотерапия не назначена.</p>
<p class="x-text">Приводим пример клинического наблюдения полной регрессии отдаленных метастазов и первичной опухоли в результате химиотерапии по схеме FOLFIRINOX.</p>
<p class="x-text"><i>– Больной А., 65 лет, обратился в РОНЦ с жалобами на общую слабость, быструю утомляемость, снижение веса на 10 кг в течение 3 месяцев. При обследовании диагностирована умереннодифференцированная аденокарцинома желудка с переходом на кардию. Во время диагностической лапароскопии выявлены и морфологически верифицированы метастазы по брюшине.</i></p>
<i> </i>
<p class="x-text"><i>С 19.06.2012 по 04.12.2012 проведено 9 курсов химиотерапии по схеме FOLFIRINOX.</i></p>
<i> </i>
<p class="x-text"><i>Лечение осложнялось диареей 2-й степени, астенией 2-й степени, тошнотой 2-й степени, рвотой 1-й степени, нейтропенией 4-й степени, в связи с чем после 2-го курса дозы препаратов были редуцированы на 20%. После 4-го курса химиотерапии у пациента появились признаки периферической полинейропатии 1-й степени тяжести, которые достигли 3-й степени после 9-го курса химиотерапии.</i></p>
<i> </i>
<p class="x-text"><i>За время лечения у больного существенно уменьшилась слабость, стабилизировался вес. При ЭГДС после 3 курсов химиотерапии отмечена положительная динамика в виде уменьшения границ опухолевой инфильтрации, после 6-го и 9-го курсов – незначительное нарастание положительного эффекта.</i></p>
<i> </i>
<p class="x-text"><i>После 9 курсов химиотерапии в плановом порядке больному была выполнена диагностическая лапароскопия с множественной биопсией брюшины и взятием смывов. Согласно результатам цитологического и гистологического исследований элементов опухоли обнаружено не было, была зафиксирована полная резорбция отдаленных метастазов.</i></p>
<i> </i>
<p class="x-text"><i>14.01.2013 пациенту выполнена гастрэктомия, D2 лимфодиссекция. Послеоперационный период протекал без особенностей. По данным гистологического исследования послеоперационного материала в желудке определялись очаги фиброза (лечебный патоморфоз 4-й степени), в одном прилежащем лимфатическом узле выявлены комплексы клеток аденокарциномы с признаками лечебного патоморфоза 4-й степени. В остальных 17 удаленных лимфатических узлах элементов опухоли не обнаружено.</i></p>
<i> </i>
<p class="x-text"><i>Таким образом, в результате проведения химиотерапии удалось добиться полной регрессии отдаленных метастазов и первичной опухоли желудка. Единственным проявлением заболевания на момент операции являлся метастаз в парагастральный лимфатический узел с признаками лечебного патоморфоза 4-й (?) степени.</i></p>
<i> </i>
<p class="x-text"><i>С учетом проведения полного объема запланированной химиотерапии и наличия нейротоксичности химиотерапия после операции не назначена, рекомендовано динамическое наблюдение.</i></p>
<i> </i>
<p class="x-text"><i>На август 2013 г. пациент наблюдается без признаков прогрессирования болезни в течение 7 мес. после операции и в течение 9 мес. после завершения химиотерапии. Продолжительность жизни больного составляет 14 мес. Сохраняются признаки периферической полинейропатии 2-й степени.</i></p>
<p class="x-text">Анализируя эффективность данной комбинации химиотерапии в зависимости от локализации опухолевых очагов (табл. 2), мы обнаружили, что наиболее чувствительными являются метастазы в печени (81,8%), первичная опухоль (73,7%, в том числе 1 полная регрессия), метастазы в забрюшинных (60%, в том числе 2 полные регрессии) и надключичных лимфоузлах (50%, в том числе 1 полная регрессия), по брюшине (37,5%, в том числе 1 полная регрессия). Асцит исходно был выявлен у 8 пациентов, на фоне лечения у 4 (50%) больных наблюдалась его полная резорбция, у 2 (25%) – значительное уменьшение (частичная регрессия), у 2 больных (25%) объем асцитической жидкости оставался прежним, не требуя эвакуации, то есть наблюдалась стабилизация процесса. У одной пациентки стабилизация асцита сохранялась не долго (менее 3 мес.), последующие линии химиотерапии были неэффективны, что требовало проведения неоднократных лапароцентезов с эвакуацией в среднем около 10 л асцитической жидкости.</p>
<p class="x-text">На момент анализа медиана выживаемости больных без прогрессирования болезни составила 8,7 мес., при этом 80% пациентов находились под наблюдением без признаков прогрессирования болезни 6 и более месяцев. Медиана общей выживаемости не достигнута, все пациенты живы. На момент анализа химиотерапию 2-й линии получали 8 больных.</p>
<p class="x-podzag-"><b>Токсичность</b></p>
<p class="x-text">Оценена токсичность 179 курсов химиотерапии у 27 больных. Гематологическая токсичность в большинстве случаев была умеренно выраженной и обратимой, наиболее частым видом гематологической токсичности была нейтропения, зарегистрированная у 81,5% больных на 44,1% курсов (табл. 3, 4).</p>
<p class="x-text">Нейтропения 3 + 4-й степени зарегистрирована у 51,9% пациентов на 15,6% курсах. Ни один курс химиотерапии не осложнился фебрильной нейтропенией.</p>
<p class="x-text">Тромбоцитопения 2-й степени наблюдалась только у одной пациентки после 1 курса. Однако тромбоцитопения 1-й степени (при количестве тромбоцитов от 75 до 99 × 109/л) зафиксирована у 14 пациентов (51,9%) на 44 курсах (24,6%) и требовала удлинения интервалов между курсами химиотерапии у 6 пациентов (22,2%) на 13 курсах (7,2%). Тромбоцитопения носила кумулятивный характер и, как правило, развивалась на 5–6-м курсе химиотерапии.</p>
<p class="x-text">На момент включения в исследование нормальный уровень гемоглобина был у 17 (62,9%), анемия 1-й степени тяжести – у 7 (25,9%). У 3 (11,2%) пациентов была зарегистрирована анемия 2-й степени тяжести, из них на фоне лечения у одного больного отмечена нормализация уровня гемоглобина, у 2 – уменьшение тяжести анемии до 1-й степени. У 7 пациентов с исходной анемией 1-й степени наблюдалась следующая динамика уровня гемоглобина: снижение до 2-й степени тяжести отмечено у 3 пациентов, уровень гемоглобина сохранялся стабильным у 4 пациентов, нормализации уровня гемоглобина не произошло ни у одного больного. При исходно нормальном уровне гемоглобина развитие анемии 1-й степени наблюдалось у 3, 2-й степени – у 1 пациента, стабильно нормальным за время лечения уровень гемоглобина сохранялся у 13 пациентов. За время лечения уровень гемоглобина не изменился у 17 (63%), снизился на 1 ступень – у 6 (22,2%), на 2 ступени – у 1 (3,7%), повысился на 1 ступень – у 2 (7,4%), на 2 ступени – у 1 (3,7%) больного.</p>
<p class="x-text">Выраженность негематологической токсичности, как правило, не превышала 2-й степени (табл. 5, 6). Побочные эффекты 3-й степени были редкими и отмечены только у 4 больных: гепатотоксичность – у 2 (7,4%), нейротоксичность –
<br />
у 1 (3,7%), тошнота – у 1 (3,7%) пациента. Отмечались следующие виды токсичности 2-й степени: тошнота – у 9 (33,3%), диарея – у 9 (33,3%), астения – у 7 (25,9%), нейротоксичность – у 6 (22,2%), рвота – у 4 (14,8%) пациентов, кардиотоксичность (пароксизм фибрилляции предсердий) – 1 (3,7%) и нефротоксичность – у 1 пациента (3,7%). Нейротоксичность, не превышающая 1-й степени и не требующая редукции доз препаратов, отмечена у 7 пациентов (26%).</p>
<p class="x-podzag-"><b>Обсуждение</b></p>
<p class="x-text">По предварительным результатам проводимого нами исследования, комбинация FOLFIRINOX демонстрирует высокую эффективность лечения больных диссеминированным раком желудка с частотой объективного эффекта 56,6%, в том числе с 1 полной регрессией опухоли. Контроль роста опухоли достигнут у 91,4% пациентов. Медиана выживаемости без прогрессирования болезни составила 8,7 мес. В связи с небольшим периодом наблюдения медиана выживаемости больных не достигнута.</p>
<p class="x-text">Режим продемонстрировал хорошую переносимость. Гематологическая токсичность была умеренно выраженной. Нейтропения 3–4-й степени отмечалась у 51,8% пациентов и не сопровождалась фебрильной лихорадкой. Тромбоцитопения 2-й степени наблюдалась только у одного больного, однако клинически значимая тромбоцитопения 1-й степени (75–99 × 109/л) являлась достаточно частым осложнением (у 51,8% больных) и носила кумулятивный характер, в связи с чем 22,2% пациентов приходилось откладывать очередной курс химиотерапии. Негематологическая токсичность 3-й степени проявлялась в виде гепатотоксичности у 7,4%, нейротоксичности – у 3,7%, тошноты – у 3,7% больных.</p>
<p class="x-text">Полученные результаты сопоставимы с данными немногочисленных международных исследований по изучению эффективности комбинации FOLFIRINOX у больных диссеминированным раком желудка.</p>
<p class="x-text">Так, в одном исследовании объективный эффект был достигнут у 63,3% больных, в том числе 2 полные регрессии. Медиана времени до прогрессирования болезни составила 7,3 мес., медиана общей выживаемости – 11,9 мес., 1-годичная выживаемость – 42,9%. Нейтропения 3–4-й степени зафиксирована у 49% пациентов, негематологические побочные явления 3-й степени в виде тошноты/рвоты, стоматита и диареи наблюдались у 42,6%, 4,3% и 10,6% больных [10].</p>
<p class="x-text">Еще в одном исследовании химиотерапию по схеме FOLFIRINOX проводили с использованием более низких доз препаратов: иринотекан 150 мг/м2 + оксалиплатин 85 мг/м2 + лейковорин 100 мг/м2 + 5-ФУ 2000 мг/м2 в виде 48-часовой инфузии. Объективный эффект был достигнут у 66,7% больных, в том числе 2 полные регрессии, медиана времени до прогрессирования болезни составила 9,6 мес., медиана общей выживаемости – 14,8 мес. Нейтропения 3–4-й степени отмечена у 46% пациентов, включая только
<br />
2 эпизода фебрильной нейтропении. Токсичностью 3–4-й степени осложнилось менее 10% всех курсов химиотерапии. Побочные явления 3-й степени в виде диареи, тошноты/рвоты наблюдались у 10% и 44% больных соответственно. Ни у одного пациента лечение не осложнилось нейротоксичностью 3-й степени [11].</p>
<p class="x-text">Низкая частота тошноты и рвоты 3-й степени в нашем исследовании (3,7% против 42–44% в международных исследованиях), предположительно, обусловлена проведением первичной профилактики антагонистами HT3-рецепторов (Китрил 3 мг внутривенно в 1 день, затем по 1 мг два раза в день перорально в течение трех дней) и глюкокортикостероидами (дексаметазон по 8 мг 2 раза в день внутримышечно в течение 5 дней), а также добавлением блокатора NK1-рецепторов Эменда при плохой переносимости 1 курса химиотерапии.</p>
<p class="x-text">По результатам нашего исследования, комбинация FOLFIRINOX превосходит трехкомпонентные режимы, применяемые при диссеминированном раке желудка (DCF, ECF, EOX), по частоте объективного эффекта и медиане выживаемости без прогрессирования болезни, обладая при этом умеренным профилем токсичности (табл. 7).</p>
<p class="x-text">Интересными представляются наблюдения полной регрессии отдаленных метастазов у пациентов с изолированным поражением брюшины. При изучении других режимов химиотерапии у больных диссеминированным раком желудка нами уже были зафиксированы случаи полной регрессии отдаленных метастазов по брюшине, что позволяло выполнить пациентам R0-операции. Медиана общей выживаемости в данной группе оказывается существенно выше, чем в общей популяции.</p>
<p class="x-text">Таким образом, предварительные результаты исследования продемонстрировали целесообразность его продолжения. Набор пациентов в исследование продолжается. Планируется анализ отдаленных результатов лечения при достижении медианы общей выживаемости. </p>
<div class="story"> </div>
</div>
<div class="story">
<p><b>Клинические исследования</b></p>
</div>
<div class="story">
<p class="x-vinos-right">Сравнительный анализ эффективности двух- и трехкомпонентных режимов химиотерапии показал статистически достоверное улучшение выживаемости больных диссеминированным раком желудка при использовании трехкомпонентных режимов
<br />
по сравнению с двухкомпонентными.</p>
</div>
1. Glimelius B., Ekström K., Hoffman K. et al. Randomized comparison between chemotherapy plus best supportive care with best supportive care in advanced gastric cancer // Ann. Oncol. 1997. Vol. 8. № 2. P. 163–168.
2. Pyrhönen S., Kuitunen T., Nyandoto P., Kouri M. Randomised comparison of fluorouracil, epidoxorubicin and methotrexate (FEMTX) plus supportive care with supportive care alone in patients with non-resectable gastric cancer // Br. J. Cancer. 1995. Vol. 71. № 3. P. 587–591.
3. Ajani J.A., Moiseyenko V.M., Tjulandin S. et al. Quality of life with docetaxel plus cisplatin and fluorouracil compared with cisplatin and fluorouracil from a phase III trial for advanced gastric or gastroesophageal adenocarcinoma: the V-325 Study Group // J. Clin. Oncol. 2007. Vol. 25. № 22. P. 3210–3216.
4. Murad A.M., Santiago F.F., Petroianu A. et al. Modified therapy with 5-fluorouracil, doxorubicin, and methotrexate in advanced gastric cancer // Cancer. 1993. Vol. 72. № 1. P. 37–41.
5. Wagner A.D., Grothe W., Haerting J. et al. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data // J. Clin. Oncol. 2006. Vol. 24. № 18. P. 2903–2909.
6. Ajani J.A., Fodor M.B., Tjulandin S.A. et al. Phase II multi-institutional randomized trial of docetaxel plus cisplatin with or without fluorouracil in patients with untreated, advanced gastric, or gastroesophageal adenocarcinoma // J. Clin. Oncol. 2005. Vol. 23. № 24. P. 5660–5667.
7. Van Cutsem E., Moiseyenko V.M., Tjulandin S. et al. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group // J. Clin. Oncol. 2006. Vol. 24. № 31. P. 4991–4997.
8. Masi G., Allegrini G., Cupini S. et al. First-line treatment of metastatic colorectal cancer with irinotecan, oxaliplatin and 5-fluorouracil/leucovorin (FOLFOXIRI): results of a phase II study with a simplified biweekly schedule // Ann. Oncol. 2004. Vol. 15. № 12. P. 1766–1772.
9. Conroy T., Paillot B., François E. et al. Irinotecan plus oxaliplatin and leucovorin-modulated fluorouracil in advanced pancreatic cancer – a Groupe Tumeurs Digestives of the Federation Nationale des Centres de Lutte Contre le Cancer study // J. Clin. Oncol. 2005. Vol. 23. № 6. P. 1228–1236.
10. Cao W., Yang W., Lou G. et al. Phase II trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) as first-line treatment for advanced gastric cancer // Anticancer Drugs. 2009. Vol. 20. № 4. P. 287–293.
11. Lee J., Kang W.K., Kwon J.M. et al. Phase II trial of irinotecan plus oxaliplatin and 5-fluorouracil/leucovorin in patients with untreated metastatic gastric adenocarcinoma // Ann. Oncol. 2007. Vol. 18. № 1. P. 88–92.
Новости на тему
15.09.2023 07:00:00
17.08.2022 01:00:00
17.07.2014
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.