Эффективность и токсичность комбинированного режима «доцетаксел + цисплатин + лейковорин + 5-фторурацил» при диссеминированном раке желудка
- Аннотация
- Статья
- Ссылки
Частичная регрессия отмечена у 34,1%, стабилизация болезни –
у 36,6% и прогрессирование болезни – у 29,3%. Медиана выживаемости без прогрессирования достигла 5,4 месяца, общая выживаемость –
11,7 месяца, 1-годичная выживаемость составила 42,8%, 2-годичная – 14,3%, 3-годичная – 9,5%. У 2 пациентов на фоне лечения отмечена полная резорбция отдаленных метастазов, что позволило выполнить им радикальную операцию и значительно увеличить продолжительность жизни – до 43 месяцев и 53 месяцев.
Токсичность режима была умеренной. Нейтропения 3–4-й степени наблюдалась у 59,5% больных и только у 1 больного сопровождалась фебрильной лихорадкой. Негематологическая токсичность 3-й степени отмечена у 5 пациентов (11,9%): в виде диареи – у 7,2%, стоматита – у 2,4%, астении – у 2,4% больных.
Данный режим продемонстрировал сопоставимую эффективность с режимом DCF в исследовании V-325, но более благоприятный токсический профиль, что позволяло чаще проводить химиотерапию амбулаторно.
Частичная регрессия отмечена у 34,1%, стабилизация болезни –
у 36,6% и прогрессирование болезни – у 29,3%. Медиана выживаемости без прогрессирования достигла 5,4 месяца, общая выживаемость –
11,7 месяца, 1-годичная выживаемость составила 42,8%, 2-годичная – 14,3%, 3-годичная – 9,5%. У 2 пациентов на фоне лечения отмечена полная резорбция отдаленных метастазов, что позволило выполнить им радикальную операцию и значительно увеличить продолжительность жизни – до 43 месяцев и 53 месяцев.
Токсичность режима была умеренной. Нейтропения 3–4-й степени наблюдалась у 59,5% больных и только у 1 больного сопровождалась фебрильной лихорадкой. Негематологическая токсичность 3-й степени отмечена у 5 пациентов (11,9%): в виде диареи – у 7,2%, стоматита – у 2,4%, астении – у 2,4% больных.
Данный режим продемонстрировал сопоставимую эффективность с режимом DCF в исследовании V-325, но более благоприятный токсический профиль, что позволяло чаще проводить химиотерапию амбулаторно.


Введение
Несмотря на наблюдаемую в последние десятилетия стойкую тенденцию к снижению заболеваемости, по данным мировой статистики, рак желудка занимает второе место в структуре смертности от онкологических заболеваний [1].
Коварность этого заболевания заключается в том, что в связи с ранним лимфогенным и гематогенным распространением, длительным бессимптомным периодом и отсутствием специфических признаков на ранних стадиях очень часто диагноз ставится уже на поздних стадиях, когда единственным методом лечения может быть только лекарственная терапия.
Целесообразность и эффективность лекарственной терапии при диссеминированном раке желудка была доказана в нескольких рандомизированных исследованиях II и III фазы, показавших увеличение продолжительности жизни больных на фоне химиотерапии по сравнению с адекватным симптоматическим лечением с 3–5 месяцев до 10–12 месяцев, и в настоящее время не вызывает сомнений [2, 3, 4, 5, 6].
Дальнейшее повышение эффективности лекарственной терапии связано с разработкой комбинированных режимов, показавших по сравнению с монотерапией статистически достоверное увеличение продолжительности жизни больных [4, 7].
Стандартными комбинациями химиопрепаратов, используемыми при диссеминированном раке желудка в разных странах, являются CF (цисплатин, 5-фторурацил), «цисплатин/оксалиплатин + капецитабин» и ECF (эпирубицин, цисплатин, 5-фторурацил). Но преимуществ в выживаемости на фоне терапии какой-либо из вышеперечисленных комбинаций отмечено не было, что и послужило поводом для продолжения поиска новых препаратов и их комбинаций.
Доцетаксел – полусинтетический противоопухолевый препарат растительного происхождения, получаемый путем химического синтеза из природного сырья – игл тиса европейского (Taxus baccata). Доцетаксел продемонстрировал активность при раке желудка как в монорежиме (по данным ряда исследований, объективный эффект составляет 20%) [8, 9, 10, 11, 12, 13, 14], так и в составе противоопухолевых комбинаций.
Эффективность двухкомпонентных режимов, включающих доцетаксел, послужила основанием для создания трехкомпонентной комбинации.
Согласно результатам исследования V-325, опубликованным в 2006 г. [15], комбинация DCF (доцетаксел, цисплатин, 5-фторурацил) оказалась эффективнее стандартного режима CF по всем параметрам. Медиана выживаемости больных без прогрессирования болезни и медиана общей выживаемости были существенно выше в группе DCF по сравнению с CF: 5,6 месяца против 3,7 месяца (p = 0,01) и 9,2 месяца против 8,6 месяца (p = 0,02), как и частота объективного эффекта – 37% против 25% (p = 0,01) соответственно. Дополнительно были оценены 1-годичная и 2-годичная выживаемость, которые при режиме DCF по сравнению с CF составили 40% против 32% и 18% против 9% соответственно. Но, как и предполагалось, трехкомпонентный режим оказался более токсичным. Так, нейтропения 3–4-й степени была зарегистрирована у 82% больных в группе DCF и у 57% пациентов, получающих химиотерапию по схеме CF, лейкопения – у 65% и 31%, фебрильная нейтропения – у 29% и 12% больных соответственно. Проведение вторичной профилактики гранулоцитарным колониестимулирующим фактором (Г-КСФ) при режиме DCF способствовало снижению частоты фебрильной нейтропении до 12%. Негематологическая токсичность также была выше в группе DCF: диарея 3–4-й степени отмечалась у 20,4% и 8% больных, нейропатия – у 17% и 6% соответственно.
В настоящее время режим DCF рекомендован для применения в первой линии химиотерапии диссеминированного рака желудка, однако его широкому применению препятствует высокая токсичность. В связи с большей токсичностью назначение данного режима должно быть избирательным, с тщательной оценкой соматического статуса больного. Следует иметь в виду и необходимость назначения сопроводительной терапии колониестимулирующими факторами.
Таким образом, дальнейшее изучение доцетаксела в различных комбинированных режимах при диссеминированном раке желудка является актуальным и перспективным. С целью снижения токсичности режима DCF при сохранении эффективности нами было организовано исследование эффективности и токсичности модифицированного режима DCF.
Материалы и методы
Критериями включения в исследование являлись:
1) морфологически подтвержденный неоперабельный рак желудка или пищеводно-желудочного перехода (стадия IV);
2) возраст старше 18 лет;
3) общее состояние больного ≤ 2
баллов по четырехбалльной шкале оценки общего состояния онкологического больного Восточной объединенной группы онкологов (Eastern Cooperative Oncology Group, ECOG);
4) адекватная функция костного мозга (гемоглобин ≥ 9 г/дл, нейтрофилы ≥ 1,5 × 109/л, тромбоциты ≥ 100 × 109/л), печени (уровень общего билирубина
≤ 1,5 норм, аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ) ≤ 2,5 норм (при наличии метастазов печени ≤ 5 норм, щелочная фосфатаза ≤ 5 норм)), почек (креатинин < 115 мкмоль/л, клиренс креатинина ≥ 50 мл/мин);
5) предполагаемая продолжительность жизни более 3 месяцев;
6) отсутствие в анамнезе химиотерапии с лечебной целью по поводу рака желудка.
Адъювантная химиотерапия, если таковая проводилась, не должна была включать цисплатин или таксаны и должна была быть завершена по крайней мере за 6 месяцев до начала паллиативной химиотерапии.
Критериями исключения были следующие:
1) признаки кишечной непроходимости, активного желудочно-кишечного кровотечения;
2) метастатическое поражение центральной нервной системы;
3) активный неконтролируемый инфекционный процесс;
4) хроническая диарея;
5) периферическая полинейропатия ≥ 2 степени по критериям оценочной шкалы общих критериев токсичности Национального института исследования рака версии 3.0 (NCI-CTC, National Cancer Institute – Common Toxicity Criteria);
6) сопутствующие заболевания в стадии декомпенсации (сахарный диабет, сердечно-сосудистые, легочные заболевания, болезни печени и почек), психические расстройства, включая деменцию, шизофрению, алкоголизм.
Характеристика и план лечения
Доцетаксел (препарат Таксотер®) вводили в дозе 75 мг/м2 в виде 1-часовой внутривенной инфузии во 2-й день цикла на фоне премедикации дексаметазоном по 8 мг за 13, 3 и 1 час до инфузии доцетаксела, затем по 8 мг каждые 12 часов на протяжении 3 суток.
Цисплатин вводили в дозе 75 мг/м2
после инфузии доцетаксела на фоне гипергидратации и антиэметической защиты, включающей блокаторы 5-HT3-рецепторов и дексаметазон (блокатор NK-рецепторов апрепитант назначали по показаниям).
Лейковорин вводился по 50 мг внутривенно струйно перед инфузией 5-фторурацила (5-ФУ), далее следовала 3-часовая инфузия 5-ФУ в дозе 500 мг/м2 в 1, 2, 3-й дни цикла.
Повтор курсов химиотерапии проводили каждые 3 недели.
В отсутствие прогрессирования болезни или непереносимой токсичности пациентам проводили 6 курсов химиотерапии, однако при нарастании эффекта после 6-го курса дополнительно назначали еще 2 курса химиотерапии по прежней схеме, затем пациентам продолжали поддерживающее лечение по схеме «лейковорин по 50 мг внутривенно струйно + 5-ФУ в дозе 500 мг/м2 в 1, 2, 3-й дни каждые 3 недели» до прогрессирования процесса или непереносимой токсичности.
При выявлении прогрессирования болезни пациенту возобновляли химиотерапию по прежней схеме, если поддерживающая терапия длилась более 4 месяцев, или начинали химиотерапию второй линии по схеме XELIRI (иринотекан 250 мг/м2 в 1-й день + капецитабин 2000 мг/м2 в сутки в 2 приема в течение 14 дней каждые 3 недели), если период без активного лечения был менее 4 месяцев.
Результаты
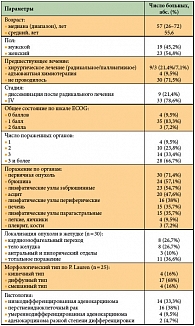
В исследовании приняли участие 42 больных, характеристика которых представлена в таблице 1, среди них 19 мужчин и 23 женщины. Средний возраст пациентов составил 55,6 лет, медиана – 57 лет (от 26 до 72).
На момент включения в исследование у большинства больных (78,6%) был диагностирован исходно диссеминированный неоперабельный процесс, причем у 9 из 33 – после лапароскопии, во время которой было выявлено метастатическое поражение брюшины. Трем пациентам из 33 была выполнена паллиативная гастрэктомия: одному в связи с угрозой желудочного кровотечения и двум – в связи с декомпенсированным стенозом выходного отдела желудка.
У 9 больных (21,4%) генерализация опухолевого процесса была выявлена после радикального лечения, из них адъювантная химиотерапия после радикальной операции была проведена 4 пациентам.
Первичная опухоль присутствовала у 30 больных, при этом тотальный рак желудка был выявлен в 36,7% случаев, рак кардиоэзофагеального перехода – в 26,7%, тела желудка – в 26,7%, поражение антрального и пилорического отделов желудка – в 10% случаев. У 24 больных выявлен канцероматоз брюшины, из них у 20 – асцит различной степени выраженности. Достаточно частой локализацией метастазов были забрюшинные лимфоузлы – у 23 пациентов; метастазы в периферические лимфоузлы выявлены у 16, в печень – у 15, в яичники и легкие – у 4, в кости и плевру – у 3 пациентов.
Таким образом, контингент включенных в исследование больных характеризуется обширным распространением опухолевого процесса (вовлечение в опухолевый процесс 3 органов наблюдалось у 33,3% больных, 3 и более органов – у 66,7% больных).
Все больные находились в общем удовлетворительном состоянии, оцененном по шкале ECOG как 0, 1 и 2 соответственно у 4 (9,5%), 35 (83,3%) и 3 (7,2%) пациентов.
Морфологический тип опухоли по классификации P. Lauren определен у 25 пациентов, преобладал диффузный тип, выявленный у 68% больных, кишечный и смешанный типы опухоли встречались с одинаковой частотой – у 16% больных каждый.
Характеристика лечения
Всего 42 больным проведено 224 курса химиотерапии, медиана количества циклов, проведенных 1 больному, составила 6 (от 1 до 9). Один курс химиотерапии был проведен только одному больному, по 2 курса получили 2 пациента, 3 курса – 10, 4 курса – 3, 5 курсов – 4, 6 курсов – 18 больных. Более 7 курсов химиотерапии получили 4 больных (табл. 2).
Причинами прекращения лечения стали прогрессирование процесса – у 32 пациентов (80%), токсичность лечения – у 2 больных (5%) (аллергическая реакция на доцетаксел, повторные эпизоды потери сознания), отказ больного – 1 пациент (2,5%), обострение сопутствующих заболеваний – у 4 больных (острое нарушение мозгового кровообращения, неконтролируемая артериальная гипертония, рецидивирующие пневмонии, реактивация туберкулеза), плановое решение – 1 пациент (в результате комбинированного лечения была достигнута полная регрессия опухоли, пациент не получает специфического лечения и наблюдается без признаков прогрессирования болезни уже в течение 32 месяцев).
Интенсивность дозы доцетаксела была в пределах 52,5–100%, в среднем составила 21,5 мг/м2 в неделю, что соответствовало 86% от запланированной дозы, интенсивность дозы цисплатина колебалась от 58,7 до 100%, в среднем составила 21,7 мг/м2 в неделю (86,8%), и 5-ФУ – 40,9–100%, в среднем – 452,4 мг/м2 в неделю (90,5%). В полной дозе доцетаксел получили 9 (21,5%) пациентов, цисплатин – 14 (33,3%) пациентов, 5-ФУ – 16 (38%) пациентов.
Впоследствии химиотерапия второй линии проведена 22 больным (52,4%), из которых 5 затем получили химиотерапию третьей линии.
Эффективность терапии
Оценка эффективности лечения производилась у больных, получивших 2 и более курсов химиотерапии. Одна пациентка получила только 1 курс лечения, после чего в связи с декомпенсацией стеноза выходного отдела желудка ей была выполнена паллиативная гастрэктомия, и дальнейшее лечение не проводилось из-за длительной выраженной астении. Таким образом, объективный эффект был оценен у 41 пациента из 42.
Полной регрессии опухоли на фоне химиотерапии достигнуто не было. Частичная регрессия отмечена у 14 (34,1%) больных, стабилизация болезни – у 15 (36,6%). Таким образом, контроль роста опухоли достигнут в 70,7% случаев. Прогрессирование болезни зарегистрировано у 12 (29,3%) больных. Медиана длительности частичной регрессии составила 5,13 месяца (от 1,63 до 18,2 месяца, в среднем 6,88 месяца). Медиана длительности стабилизации болезни составила 5,5 месяца (от 2,73 до 19,8 месяца, в среднем 6,63 месяца).
Эффективность комбинации доцетаксела с цисплатином и 5-ФУ/лейковорином (TPFL) в зависимости от морфологического типа опухоли представлена в таблице 3. Однако в связи с небольшим числом пациентов судить об истинной эффективности химиотерапии в зависимости от морфологического типа опухоли у данной популяции больных затруднительно.
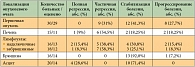
Анализируя частоту достижения объективного эффекта в зависимости от локализации опухолевых очагов (табл. 4), мы обнаружили, что наиболее чувствительными являются метастазы в печень (46,7%, в том числе 1 полная регрессия), забрюшинные лимфоузлы (44,4%, в том числе 1 полная регрессия), надключичные лимфоузлы (43,7%, в том числе 12,5% полных регрессий). Выраженная положительная динамика со стороны первичной опухоли отмечена у 31% больных. Асцит исходно был выявлен у 20 больных, в том числе требующий эвакуации – у 2 (10%), определяемый клинически, но не требующий эвакуации жидкости – у 1 (5%), определяемый только при ультразвуковом исследовании – у 17 (85%) больных. На фоне лечения у 10 (71,4%) пациентов количество жидкости в брюшной полости оставалось прежним, то есть наблюдалась стабилизация процесса, у 4 пациентов отмечена резорбция асцита (28,6%). Лапароцентез выполняли 2 больным с исходно напряженным асцитом, повторная эвакуация жидкости из брюшной полости не потребовалась.
Медиана выживаемости больных без прогрессирования болезни составила 5,4 месяца (1,8–40,2+ месяцев), 6-месячная выживаемость без прогрессирования болезни отмечена у 42%, 1-годичная – у 11,9% больных.
Медиана общей выживаемости всей группы больных составила 11,7 месяца (4,2–48,4+ месяцев). К моменту анализа 5 пациентов живы. Двум больным продолжают лечение по данной схеме в качестве повторной реиндукции в связи с длительной ремиссией (18 месяцев и 17 месяцев). У 2 (4,7%) пациентов достигнута полная резорбция отдаленных метастазов (у одного пациента – в печени, у второго – по брюшине), что позволило выполнить им операции и значительно увеличить продолжительность жизни.
Одногодичная выживаемость составила 42,8%, двухгодичная – 14,3%, трехгодичная – 9,5%, один пациент жив более 4 лет.
Анализ выживаемости больных в зависимости от интенсивности дозы дал неожиданные результаты. Беспрогрессивная выживаемость у пациентов, получивших дозу доцетаксела и цисплатина менее 100%, составила 5,5 месяца, а при лечении в полных дозах – 4,9 месяца (р = 0,026). Редукция дозы 5-ФУ не привела к статистически значимому влиянию на выживаемость без прогрессирования болезни.
Токсичность
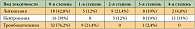
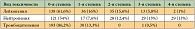
Оценена токсичность 227 курсов химиотерапии у 42 больных. Частота гематологической токсичности в зависимости от числа больных и числа курсов химиотерапии представлена в таблицах 5 и 6. Гематологическая токсичность, в частности нейтропения, была умеренно выраженной и обратимой. Нейтропенией 3-й + 4-й степени лечение осложнилось у 59,5% больных на 25,4% курсов. Фебрильная нейтропения отмечена у 1 больного на 1 курсе. Тромбоцитопения 3-й степени зарегистрирована однократно у одного больного, тромбоцитопения 1-й степени наблюдалась у 11 (26,2%) пациентов на 30 (13,4%) курсах.
На момент включения в исследование нормальный уровень гемоглобина был у 19 больных (45,3%), анемия 1-й степени выявлена у 16 (38%), анемия 2-й степени – у 7 пациентов (16,7%). Динамика изменения уровня гемоглобина у пациентов, исходно имеющих анемию 2-й степени, была следующей: у одной пациентки отмечено усугубление анемии до 3-й степени; у 5 пациентов за время лечения отмечено повышение уровня гемоглобина до 1-й степени, у 2 пациентов за время лечения сохранялась анемия 2-й степени. У 11 пациентов с анемией 1-й степени исходно за время лечения отмечено снижение уровня гемоглобина до 2-й степени, у одного пациента – до 3-й степени, у 3 пациентов сохранялся стабильный уровень гемоглобина. При исходно нормальном уровне гемоглобина развитие анемии 1-й степени наблюдалось у 9 пациентов, 2-й степени – у 6 пациентов, стабильно нормальным за время лечения уровень гемоглобина сохранялся у 4 пациентов. Таким образом, снижение уровня гемоглобина за время лечения на одну степень зафиксировано у 21 (50%), на две – у 7 (16,7%), стабильным уровень гемоглобина оставался у 9 (21,4%) пациентов, повышение на одну степень – у 5 (11,9%) больных.
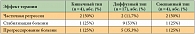
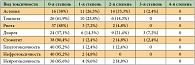
Негематологическая токсичность была не частой и, как правило, не превышала 2-й степени. Побочные эффекты 3-й степени отмечены у 5 больных: диарея – у 3 (7,2%), стоматит – у 1 (2,4%), астения – у 1 пациента (2,4%). Два препарата в данной комбинации – доцетаксел и цисплатин – обладают таким побочным эффектом, как нейротоксичность. Однако нейропатия не привела к прекращению лечения ни у одного больного.
Нейротоксичность 1-й степени была зарегистрирована у 11,9% больных, 2-й степени – у 4,8%. Как правило, симптомы периферической полинейропатии дебютировали после 5–6-го курса.
Отмечались следующие виды токсичности 2-й степени: астения – у 14 (33,3%), диарея – у 9 (21,4%), тошнота – у 6 (14,3%), стоматит – у 2 (4,8%), рвота – у 2 (4,8%) пациентов.
Частота негематологической токсичности по больным и по курсам химиотерапии представлена в таблицах 7 и 8.
Исходно в редуцированных дозах лечение начинали 5 больным, двум из которых в процессе химиотерапии дозы препаратов были эскалированы до стандартных. Причинами исходной редукции доз препаратов стали гипербилирубинемия – у 1, ECOG 2 – у 3, множественная сопутствующая патология – у 1 пациента. В процессе лечения у 13 больных дозы препаратов были редуцированы в связи с токсическими явлениями: 9 пациентам редукция дозы потребовалась после 1-го курса, двоим пациентам – после 2-го и после 3-го курсов. Причинами редукции доз препаратов являлись диарея 2-й и 3-й степени, стоматит 2-й и 3-й степени, рвота 4-й степени, длительная нейтропения 4-й степени, гипербилирубинемия 2-й степени.
Обсуждение
Согласно полученным данным, эффективность режима TPFL составила 34,1% при медиане выживаемости без прогрессирования процесса 5,4 месяца и медиане общей выживаемости 11,7 месяца, что сопоставимо с результатами исследования V-325.
Комбинация DCF позволила получить объективный эффект у 38,7% больных, медиана выживаемости без прогрессирования болезни составила 5,2 месяца, медиана выживаемости больных – 10,2 месяца. При сопоставимой эффективности двух режимов токсичность комбинации DCF оказалась значительно выше. Побочные эффекты 3-й + 4-й степени наблюдались у 68% больных: нейтропения – у 82% (фебрильная нейтропения – у 16%), нейротоксичность – у 8%, тошнота – у 14%, рвота – у 15%, диарея – у 20%, стоматит – у 23% пациентов. Токсичность исследуемого нами режима была более приемлемой.
Нейтропенией 3-й + 4-й степени лечение осложнилось у 59,5% пациентов, только у одного больного (2,4%) 1 курс лечения осложнился нейтропенией. Ни у одного пациента лечение не осложнилось нейротоксичностью 3-й степени, 2-я степень нейротоксичности наблюдалась у 4,8%, 1-я степень – у 9,6% больных. Отмечались следующие виды токсичности 2-й степени: стоматит – у 2,4%, диарея – у 33,3%, тошнота – у 19%, рвота – у 7,2%, астения – у 40,5% пациентов.
У двух больных удалось достичь полной регрессии отдаленных метастазов, после чего им была выполнена радикальная операция, продолжительность жизни этих больных составила 43 месяца и 53 месяца.
Комбинация доцетаксела с цисплатином и 5-ФУ/лейковорином в представленной модификации обладает сопоставимой с режимом DCF противоопухолевой активностью при существенно меньшей токсичности. Приемлемый профиль безопасности позволяет использовать данный режим в амбулаторных условиях. Диапазон эффективных разовых доз доцетаксела и цисплатина от 60 до 75 мг/м2 позволяет адаптировать режим для соматически отягощенных больных без потери эффективности лечения. Возможность достижения полной регрессии отдаленных метастазов позволяет в единичных случаях выполнить адекватное оперативное пособие и тем самым существенно увеличить продолжительность жизни больных.
Частичная регрессия отмечена у 34,1%, стабилизация болезни –
у 36,6% и прогрессирование болезни – у 29,3%. Медиана выживаемости без прогрессирования достигла 5,4 месяца, общая выживаемость –
11,7 месяца, 1-годичная выживаемость составила 42,8%, 2-годичная – 14,3%, 3-годичная – 9,5%. У 2 пациентов на фоне лечения отмечена полная резорбция отдаленных метастазов, что позволило выполнить им радикальную операцию и значительно увеличить продолжительность жизни – до 43 месяцев и 53 месяцев.
Токсичность режима была умеренной. Нейтропения 3–4-й степени наблюдалась у 59,5% больных и только у 1 больного сопровождалась фебрильной лихорадкой. Негематологическая токсичность 3-й степени отмечена у 5 пациентов (11,9%): в виде диареи – у 7,2%, стоматита – у 2,4%, астении – у 2,4% больных.
Данный режим продемонстрировал сопоставимую эффективность с режимом DCF в исследовании V-325, но более благоприятный токсический профиль, что позволяло чаще проводить химиотерапию амбулаторно.
