Эффективность N-ацетилцистеина в эрадикации биопленок. XVIII Съезд оториноларингологов России. Сателлитный симпозиум компании «Замбон»
- Аннотация
- Статья
- Ссылки



Проблема биопленок при ЛОР-патологиях
О клиническом значении биопленок при ЛОР-патологии рассказал д.м.н., профессор, директор НИИ антимикробной химиотерапии Смоленской государственной медицинской академии Р.С. КОЗЛОВ. Образование биопленок имеет особенно важное значение при хронических инфекциях (хронический средний отит, хронический риносинусит и т.п.). При острых инфекциях без тенденции к колонизации бактерий роль биопленок гораздо меньше. Профессор Козлов подчеркнул, что 99% микроорганизмов существуют в виде биопленок. Биопленка – это группа активно взаимодействующих друг с другом микроорганизмов и их внеклеточных продуктов, формирующих структурное сообщество на поверхности ткани, инородных тел или медицинских приспособлений. Потенциальные возбудители инфекции дыхательных путей и ЛОР-органов свободно образуют биопленку. Скорость ее формирования зависит от многих внешних факторов, в том числе от количества питательных веществ. Принципиально важным условием для образования биопленки является наличие поверхности (идеальный субстрат – инородное тело), на которой планктонная форма бактерий может эффективно абсорбироваться. После адгезии и пролиферации микроорганизмов начинается процесс созревания биопленки, вырабатывается субстрат, который, с одной стороны, обеспечивает более тесное взаимодействие микроколоний в биопленке, с другой – защищает биопленку от неблагоприятных факторов окружающей среды (высушивание, антибиотики и дезинфектанты, клеточные и гуморальные механизмы защиты макроорганизма). Для эффективного существования биопленке нужна высокая микробная плотность. Когда концентрация достигает критической массы, бактерии перестают размножаться внутри биопленки, происходит деление планктона и высвобождение планктонных клеток.
У микроорганизмов в составе биопленки наблюдается увеличение устойчивости к антимикробным препаратам (как минимум в 100 раз). Экзополисахаридный матрикс биопленки (биополимер, обеспечивающий контакт бактерий с колонизируемой поверхностью) создает барьер для проникновения антибиотика. Кроме того, определенные виды бактерий обладают способностью обмениваться друг с другом некоторыми механизмами вирулентности, в том числе генами резистентности. Именно поэтому сейчас все большее значение приобретает способность действующих веществ препаратов проникать в биопленку и разрушать ее плотность. Р.С. Козлов отметил, что антибиотики разрушают в первую очередь ту часть биопленки, которая находится дальше от поверхности и ограничена в доступе к питательным веществам. Однако когда верхняя часть пленки удалена, нижние слои получают доступ к питательным веществам, начинают активно размножаться и, как следствие, идет развитие повторной инфекции.
В настоящее время разрабатываются новые подходы к блокированию образования биопленки in vitro. Во-первых, это фаготерапия – разрушение биопленки синтезированным бактериофагом. Во-вторых, использование белков, препятствующих адгезии бактерий. В-третьих, создание дефицита питательных веществ внутри биопленки.
Р.С. Козлов познакомил слушателей с новейшей доказательной базой эффективной эрадикации биопленок при ЛОР-инфекциях N-ацетилцистеином и его производными в комбинации с некоторыми антимикробными препаратами. Так, J.P. Pintucci и соавт. в 2010 г. опубликовали результаты исследования, которое продемонстрировало эффективность N-ацетилцистеина в снижении адгезии микроорганизмов при ЛОР-инфекциях. В 2011 г. A. Smith и соавт. представили систематический обзор 30 исследований, который показал, что тиамфеникола глицинат ацетилцистеинат (Флуимуцил®-антибиотик ИТ) имеет преимущество в борьбе с биопленками, в том числе в клинических условиях.
Биопленки и рецидивирующие респираторные инфекции
В структуре заболеваемости верхних дыхательных путей основное место занимают риносинуситы (41,2%), тонзиллофарингиты (33,5%), отиты (22,6%) и ларингиты (2,5%). Риносинусит часто переходит в хроническую форму, которая носит персистирующий характер, даже несмотря на оптимальную терапию пероральными и внутривенными антибиотиками. Также растет распространенность рецидивирующих форм острого среднего отита. Ведущей причиной затяжного и хронического течения заболеваний респираторного тракта являются бактериальные пленки, считает главный специалист по детской оториноларингологии Департамента здравоохранения Москвы, д.м.н., профессор, заместитель директора ФГУ «НКЦ оториноларингологии ФМБА России» Т.И. ГАРАЩЕНКО.
Образование биопленок иници-ируется множественными генетическими механизмами бактерий. Бактерии стремятся приблизиться к поверхности и организоваться в микроструктуры – биопленки. Планктонные клетки прикрепляются к поверхности (например, к кохлеарному импланту) до тех пор, пока не образуют единый монослой. Микроколонии синтезируют вокруг себя слизистый матрикс, формируя биопленку. От биопленки отделяются планктонные микробные клетки, которые в последующем могут образовывать новые биопленки и тем самым становиться причиной реинфекции или обострения хронического процесса. Сложность эрадикации биопленок заключается в том, что антибиотики плохо проникают внутрь биопленки и редко достигают самых глубоких ее слоев. Кроме того, бактерии внутри биопленок «передают» друг другу факторы резистентности к пероральным и внутривенным антибактериальным препаратам.
Существуют методики, которые позволяют выявлять биопленки. Это сканирующая электронная микроскопия, флуоресцентная in situ гибридизация, ПЦР. К сожалению, эти методы практически недоступны врачам. Между тем бактериальные биопленки вызывают 65% нозокомиальных (внутрибольничных) инфекций, лечение которых оценивается в 1 млрд долларов США в год. К таким инфекциям могут быть отнесены все оториноларингологические хронические заболевания, в том числе хронические отиты и хронические риносинуситы. Одной из главных задач врача при лечении данных заболеваний является назначение препарата, который способствует эрадикации биопленок.
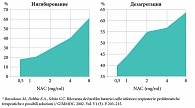
Были проведены многочисленные клинические исследования, которые доказали, что мукорегулирующая терапия содействует разрушению биопленок. Так, были получены результаты, свидетельствующие, что N-ацетилцистеин (Ринофлуимуцил® и Флуимуцил®) ингибирует образование биомасс и вызывает дезагрегацию биопланктона. Причем эффективность этих процессов выше при увеличении концентрации N-ацетилцистеина в очаге инфекции (рис. 1).
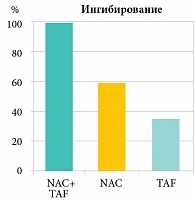
Другое исследование показало, что эффективность комбинации муколитика (N-ацетилцистеина) и антибиотика выше, чем при раздельном применении препаратов (рис. 2). N-ацетилцистеин разрушает слизь и способствует непосредственному действию антибиотика на бактерии. Единственный антибактериальный препарат, который можно комбинировать с муколитиком, – тиамфеникол, поскольку все остальные антибиотики разрушаются прямыми муколитиками, либо их использование должно быть с временным интервалом. Тиамфеникол активен в отношении многих бактерий (к нему сохраняется низкий уровень резистентности), кроме того, его можно применять в виде аэрозоля.
Определение минимальной подавляющей концентрации Флуиму-цил®-антибиотика ИТ, вводимого в пазухи, и расчет терапевтической дозы были проведены на кафедре оториноларингологии педиатрического факультета РГМУ им. Н.И. Пирогова. Пациентам основной группы проводили местную терапию синусита Флуимуцил®-антибиотиком ИТ внутрипазушно, больные из контрольной группы получали системные антибиотики (амоксициллин/клавуланат). Уже на второй пункции в основной группе возбудитель не выделялся в 72% случаев. В контрольной группе микробная обсемененность определялась у 100% больных. Таким образом, исследователями был сделан вывод, что одновременное совместное применение оригинальной комплексной композиции топических муколитических и антибактериальных препаратов (Флуимуцил®-антибиотик ИТ) значительно повышает эффективность клинических результатов в лечении синуситов. Такая местная терапия может конкурировать с системной антимикробной терапией.
Т.И. Гаращенко рассказала еще об одном проведенном исследовании, целью которого было выяснить, может ли топическое лечение заменить или отсрочить хирургическое вмешательство пациентов с рецидивирующими инфекциями верхних дыхательных путей. Пациентам в полость носа 10 дней в месяц на протяжении полугода вводили Флуимуцил®-антибиотик ИТ в сочетании с беклометазоном. В результате хирургическое вмешательство потребовалось лишь 20% больных, поскольку основная цель – санация носоглотки от биомасс – была достигнута.
Топическое лечение обладает большей эффективностью при инфекциях верхних дыхательных путей по сравнению с пероральной терапией. Пациенты с риносинуситами, средними отитами и другими заболеваниями верхних дыхательных путей нуждаются в местной муколитической терапии, поскольку биопленки локализуются непосредственно на лор-органах. Среди таких препаратов в России существует только один топический муколитик – Ринофлуимуцил. Это назальный спрей, который содержит в своем составе муколитик N-ацетилцистеин и мягкий сосудосуживающий компонент туаминогептан. Местная муколитическая терапия наряду с антибактериальной терапией необходима пациентам для эрадикации слизи из носовых пазух, которая позволяет избежать застоя слизи и образования биопленок. Особое значение имеет прием Ринофлуимуцила в практике амбулаторного врача, поскольку далеко не во всех амбулаторных учреждениях есть необходимое оборудование для проведения более сложных процедур, и профилактика рецидивов муколитическими препаратами занимает важное место в терапии хронических процессов.
Возможности муколитической терапии
Подводя итоги сателлитного симпозиума, его председатель, главный оториноларинголог Московской области, д.м.н., профессор В.М. СВИСТУШКИН напомнил слушателям, что N-ацетилцистеин:
- активизирует деятельность реснитчатого эпителия;
- уменьшает бактериальную колонизацию;
- уменьшает вязкость и адгезию;
- оказывает противовоспалительный и антиоксидантный эффекты.
Он сообщил, что ведение пациентов с рецидивирующими и хроническими респираторными инфекциями часто представляет непростую задачу для врачей. Биопленки создают очаг хронической инфекции в верхних отделах респираторного тракта (носоглотка, околоносовые пазухи, среднее ухо). Сниженная чувствительность биопленок к стандартным курсам пероральных антибиотиков обусловливает персистирующее течение рецидивирующих респираторных инфекций. Лечение, направленное на разрушение биопленок, представляется более обоснованной стратегией для предотвращения хронизации процессов, чем хирургическое вмешательство.
Таким образом, топическое комбинированное лечение – N-ацетилцистеин + антибиотик (Флуимуцил®-антибиотик ИТ), – а также местную терапию ацетилцистеином (Ринофлуимуцил) можно считать терапией первого выбора при рецидивирующих и хронических инфекциях верхних дыхательных путей. Ринофлуимуцил обладает топическими антиадгезивными свойствами в отношении как вирусов, так и бактерий. Его применение предупреждает обострение хронических процессов, предотвращает вторичное инфицирование и уменьшает бактериальную колонизацию.
В заключение профессор Свистушкин поднял еще одну важную тему – сравнение эффективности и безопасности ацетилцистеина и дженерических препаратов. Оригинальный N-ацетилцистеин содержит меньше дополнительных ингредиентов, чем дженерики, которые могут вызывать токсические или аллергические реакции, а также могут влиять на эффективность действия препарата. Естественно, мы должны отдавать предпочтение оригинальному препарату.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.