Роль интеграционной реабилитации иммунной системы будущих матерей в профилактике рекуррентных респираторных инфекций у их детей
- Аннотация
- Статья
- Ссылки
- English
Материалы и методы. Клинико-иммунологически обследовано 86 иммунокомпрометированных женщин 20–33 лет: с экстрагенитальной патологией (ЭГП) – РРИ, хронические заболевания респираторного тракта и ЛОР-органов (n = 42); с генитальной патологией (ГП) – хронические инфекционно-воспалительные заболевания (ИВЗ) генитального тракта (n = 46). Группа сравнения – 20 условно здоровых женщин. Проведен ретроспективный анализ с оценкой частоты и длительности РРИ у 45 детей (до трех лет), рожденных от наблюдаемых женщин.
Результаты. У иммунокомпрометированных женщин с нетипично протекающими ЭГП и ГП выявлена дисрегуляция иммунной системы с доминирующими нарушениями в виде дефектного функционирования нейтрофильных гранулоцитов (НГ), дефицита интерферона γ (IFNγ). Разработана интеграционная программа прегравидарной реабилитации иммунной системы (ИППРИС) иммунокомпрометированных женщин, которая включала дополнительное к традиционной терапии использование таргетной комбинированной интерфероно- и иммунотерапии (рекомбинантный ИФНα2b в сочетании с антиоксидантами; глюкозаминилмурамилдипептид). ИППРИС демонстрирует позитивные клинико-иммунологические эффекты, превосходящие эффекты традиционной терапии, и позволяет не только восстановить основные противоинфекционные механизмы врожденного и адаптивного иммунитета при ИВЗ экстрагенитальной и генитальной локализации, существенно повысить репродуктивный потенциал иммунокомпрометированных женщин в виде увеличения частоты возникновения беременностей в течение трех месяцев после лечения, уменьшения на 30% репродуктивных потерь, но и профилактировать возникновение у их детей РРИ и вторичного иммунодефицита.
Заключение. Применение ИППРИС у иммунокомпрометированных женщин с ИВЗ различной локализации способствовало улучшению здоровья рожденных ими детей, у 47,8% детей клинических признаков иммунокомпрометированности (РРИ) не наблюдалось.
Материалы и методы. Клинико-иммунологически обследовано 86 иммунокомпрометированных женщин 20–33 лет: с экстрагенитальной патологией (ЭГП) – РРИ, хронические заболевания респираторного тракта и ЛОР-органов (n = 42); с генитальной патологией (ГП) – хронические инфекционно-воспалительные заболевания (ИВЗ) генитального тракта (n = 46). Группа сравнения – 20 условно здоровых женщин. Проведен ретроспективный анализ с оценкой частоты и длительности РРИ у 45 детей (до трех лет), рожденных от наблюдаемых женщин.
Результаты. У иммунокомпрометированных женщин с нетипично протекающими ЭГП и ГП выявлена дисрегуляция иммунной системы с доминирующими нарушениями в виде дефектного функционирования нейтрофильных гранулоцитов (НГ), дефицита интерферона γ (IFNγ). Разработана интеграционная программа прегравидарной реабилитации иммунной системы (ИППРИС) иммунокомпрометированных женщин, которая включала дополнительное к традиционной терапии использование таргетной комбинированной интерфероно- и иммунотерапии (рекомбинантный ИФНα2b в сочетании с антиоксидантами; глюкозаминилмурамилдипептид). ИППРИС демонстрирует позитивные клинико-иммунологические эффекты, превосходящие эффекты традиционной терапии, и позволяет не только восстановить основные противоинфекционные механизмы врожденного и адаптивного иммунитета при ИВЗ экстрагенитальной и генитальной локализации, существенно повысить репродуктивный потенциал иммунокомпрометированных женщин в виде увеличения частоты возникновения беременностей в течение трех месяцев после лечения, уменьшения на 30% репродуктивных потерь, но и профилактировать возникновение у их детей РРИ и вторичного иммунодефицита.
Заключение. Применение ИППРИС у иммунокомпрометированных женщин с ИВЗ различной локализации способствовало улучшению здоровья рожденных ими детей, у 47,8% детей клинических признаков иммунокомпрометированности (РРИ) не наблюдалось.




Введение
Достижения современной медицины позволяют профилактировать возникновение острых респираторных вирусных инфекций (ОРВИ) у взрослых и детей. Однако в структуре инфекционных болезней лидирующие позиции по-прежнему занимают ОРВИ с удельным весом, в частности в детской популяции, до 65–90%, среди которых в эпидемический сезон 2017–2019 гг. около 80% приходилось на долю респираторных инфекций негриппозной этиологии. ОРВИ являются одной из основных причин госпитализации детей раннего детского возраста – до 39,5% и в 7% случаев – причиной смерти детей в стационарах [1–4]. При этом на детей с рекуррентными респираторными инфекциями (РРИ) приходится 50–60% всех регистрируемых заболеваний и около 20% детей болеют ОРВИ практически ежемесячно [5–8]. Современный взгляд на РРИ, базирующийся на научных исследованиях и практическом опыте, отражает единое мнение о неоднородности группы детей с РРИ, что диктует необходимость верификации основного диагноза и разработки персонифицированных подходов к реабилитации пациентов. Так, РРИ могут быть клиническим проявлением врожденных ошибок иммунитета (первичных иммунодефицитов), генетической предрасположенности к проявлениям иммунного дисбаланса, иммунологической незрелости с развитием транзиторной иммунной дисрегуляции, аллергических заболеваний, хронических инфекционно-воспалительных заболеваний различной этиологии и локализации [9–14]. В то же время высокая частота повторяемости ОРВИ во многом определяется неадекватностью реагирования иммунной системы, приводящей к развитию вторичного иммунодефицита под влиянием различных неблагоприятных антенатальных, перинатальных, средовых факторов. Дефектное функционирование иммунной системы может нарушать распознавание и клиренс патогенов (бактерий, вирусов, грибов, простейших), что приводит к развитию различных острых и хронических заболеваний и зачастую их нетипичному течению [8, 15–18]. Нетипично протекающие инфекционно-воспалительные заболевания (НПИВЗ) характеризуются упорным рецидивированием или латентностью, затяжным течением или значительной тяжестью и генерализацией воспалительного процесса с развитием септических осложнений и в своей основе имеют негативную модификацию функций клеток иммунной системы. При лечении НПИВЗ отмечается кратковременный позитивный эффект или резистентность к методам стандартной терапии.
Значительная представленность и лидерство респираторных вирусов и их серотипов в этиологической структуре респираторных инфекций (40–95%) определяют дальнейшее развитие воспалительного процесса, связанного с литическим воздействием вирусов на эпителий слизистых оболочек респираторного тракта, что может стимулировать существенное увеличение бактериальной нагрузки, развитие вторичных осложнений различной локализации [19–21]. С другой стороны, к настоящему времени известно, что бактериальная суперинфекция способствует повышению восприимчивости организма к вирусной инфекции, тем самым замыкая порочный круг. Маркеры респираторных вирусов обнаруживаются в эпителиальных клетках и непосредственно в клетках иммунной системы вне клинических проявлений ОРВИ, что говорит об их персистенции, сопровождается РРИ и дисрегуляцией иммунной системы [22]. Важно отметить и то, что в периоды клинического благополучия у детей с РРИ частота выявления контаминации слизистой оболочки носоглотки вирусами респираторной группы более чем в три раза выше в сравнении с эпизодически болеющими ОРВИ, и самосанации у детей с высокой частотой выявления вирусной контаминации носоглотки не происходит [23].
Среди причин, приводящих к возникновению РРИ, выделяют различные экзогенные и эндогенные факторы, которые важно учитывать при разработке комплекса лечебно-профилактических мероприятий. Следует отметить, что во всех семьях детей с РРИ выявлена инфицированность практически всех других членов семей (94%) и преобладание вирусно-бактериального варианта инфицирования [24]. С нашей точки зрения, особый интерес представляет неблагоприятный материнский анамнез иммунокомпрометированных детей с РРИ. Так, разнообразной хронической соматической патологией страдали 75% матерей иммунокомпрометированных детей с РРИ, при этом обострение хронических соматических заболеваний во время беременности возникало у 64,3% матерей, что потребовало проведения антибактериальной и противовоспалительной терапии. Из хронической инфекционно-воспалительной патологии наиболее часто встречались хронические заболевания ЛОР-органов и респираторного тракта (хронический тонзиллит, хронический фарингит, хронический синусит, хронический бронхит) – 47,6%, 38% женщин имели патологию мочеполовой системы (хронический пиелонефрит, хронический сальпингоофорит, хронический метроэндометрит). До наступления беременности 82,1% матерей переносили частые повторные ОРВИ. Более половины матерей (53,6%) имели постоянный контакт в семье с родственниками, страдающими подобной патологией. Во время беременности ОРВИ зарегистрированы у подавляющего большинства женщин – 92,9%, причем у 75% матерей ОРВИ возникали на ранних сроках беременности (до 12 недель) [5, 25]. Другими авторами также показано, что факторами риска частой респираторной заболеваемости у детей являются возникающие во время беременности острые инфекционные заболевания или обострения хронических заболеваний [26, 27].
С учетом вышеизложенного можно предположить, что развитие у женщин репродуктивного возраста дефектного функционирования иммунной системы с клиническими проявлениями в виде инфекционно-воспалительных заболеваний (ИВЗ) различной локализации играет важную роль как в возникновении, течении и исходе беременности, так и в формировании иммунокомпрометированности у детей раннего возраста и обосновывает использование прегравидарной реабилитации иммунной системы женщин.
Цель исследования – обосновать необходимость использования иммунокомпрометированными женщинами с ИВЗ различной локализации прегравидарной реабилитации иммунной системы для оптимизации их лечения и профилактики рекуррентных респираторных инфекций у рожденных ими детей.
Материалы и методы
В исследовании приняли участие 106 женщин репродуктивного возраста (от 20 до 33 лет) с хроническими генитальными и экстрагенитальными патологиями вне периода острых клинических проявлений и условно здоровые женщины, распределенные на следующие клинические группы в соответствии с терапевтической тактикой:
- группа 1 до лечения – 42 женщины с экстрагенитальной патологией (ЭГП), в частности с инфекционно-воспалительными заболеваниями дыхательной системы, ЛОР-органов: РРИ, хронические заболевания респираторного тракта и ЛОР-органов;
- группа 1 после лечения (ТТ-ИТ) – 23 женщины с ЭГП, получавшие интеграционную программу реабилитации иммунной системы (ИПРИС), включающую традиционную терапию (ТТ) и иммунотропную терапию (ИТ);
- группа 1 после лечения (ТТ) – 19 женщин с ЭГП, получавших прегравидарную традиционную терапию (ТТ);
- группа 2 до лечения – 44 женщины с генитальной патологией (ГП): хронические инфекционно-воспалительные заболевания (ИВЗ) генитального тракта;
- группа 2 после лечения (ТТ-ИТ) – 22 женщины с ГП, получавшие ИПРИС, включающую традиционную терапию (ТТ) и иммунотропную терапию (ИТ);
- группа 2 после лечения (ТТ) – 22 женщины с ГП, получавшие прегравидарную традиционную терапию (ТТ).
Группу сравнения составили 20 условно здоровых женщин репродуктивного возраста, обратившихся в клинику с целью установки внутриматочной спирали.
Методом проточной цитофлуориметрии (FC500 Beckman Coulter, США) с соответствующими МкАТ Beckman Coulter International S.A. (Франция) проведено иммунофенотипирование Т- и В-лимфоцитов, естественных киллерных клеток (ЕКК, CD3-CD16+CD56+) периферической крови (ПК), рассчитан иммунорегуляторный индекс (ИРИ, CD3+CD4+/CD3+CD8+). Тестирование фагоцитарной и микробицидной функций НГ осуществлялось с определением количества активно фагоцитирующих St. aureus НГ (%ФАН), захвата (фагоцитарное число – ФЧ, фагоцитарный индекс – ФИ), оценкой переваривающей активности (процент переваривания – %П, индекс переваривания – ИП). NADPH-оксидазную активность НГ определяли по показателям NBT-теста спонтанного (сп.) и стимулированного (ст.) (St. aureus); при этом учитывали процент формазан-позитивных клеток (%ФПК), средний цитохимический индекс (СЦИ), по соотношению %ФПКст/%ФПКсп рассчитывали коэффициент мобилизации (КМ). Методом ИФА определяли уровни сывороточных IgA, IgM, IgG, цитокинов IL-6, IL-10, IL-1RA, TNFα, IL-1β, IFNγ (тест-системы ООО «Вектор-Бест», Новосибирск).
Нами был проведен ретроспективный анализ с оценкой состояния здоровья 45 детей обоего пола до трехлетнего возраста, рожденных от иммунокомпрометированных женщин, вошедших в исследование: 22 ребенка (10 девочек и 12 мальчиков), рожденных от матерей с ГП, и 23 ребенка (12 девочек и 11 мальчиков), рожденных от женщин с ЭГП. При этом учитывали клинические признаки иммунокомпрометированности: высокая частота ОРВИ в год (более 10 раз в год), их значительная продолжительность (7–14 и более дней), осложненное течение ОРВИ с присоединением бактериальной суперинфекции.
Статистическую обработку данных осуществляли в компьютерных программах Microsoft Exсel 2016 и StatPlus 2010. Использовали непараметрические статистические критерии Вилкоксона и Манна – Уитни. Результаты представляли в виде медианы (верхний и нижний квартиль) – Me (Q1; Q3). Статистически значимые различия определяли при p < 0,05.
Результаты и обсуждение
На основании сбора анамнеза были выявлены женщины, имеющие клинические признаки иммунокомпрометированности [8]. Так, у женщин с ЭГП (группа 1 до лечения) обращает на себя внимание высокая частота рекуррентных ОРВИ (четыре и более эпизодов в год) – 8,8 (6,8; 10,3) эпизодов ОРВИ в год и обострений хронических инфекционно-воспалительных заболеваний респираторного тракта и ЛОР-органов (три и более эпизодов в год) – 4,6 (4,0; 5,9) эпизодов в год. Хронические заболевания респираторного тракта и ЛОР-органов представлены хроническим тонзиллитом (52,4%), хроническим фарингитом (35,7%), хроническим синуситом (30,9%). Длительность ОРВИ составляла 12,6 (9,4; 14,7) дней. В лечении значительных по продолжительности ОРВИ зачастую из-за присоединения вторичной бактериальной инфекции нижних дыхательных путей и ЛОР-органов часто использовали антибактериальную терапию – 6,8 (4,0; 7,9) курсов в год.
У женщин с хроническими ИВЗ генитального тракта (группа 2 до лечения) клинически заболевания характеризовались возникновением частых обострений (два-три и более раз в год) и/или вялотекущим течением, недостаточным эффектом от проводимых лечебных мероприятий. Структура ГП представлена хроническим сальпингоофоритом (79,5%), хроническим метроэндометритом (61,4%) и хроническим вульвовагинитом (38,6%), не встречающимся изолированно.
В результате комплексного исследования иммунной системы (ИС) женщин с ИВЗ генитального тракта, респираторного тракта и ЛОР-органов была выявлена дисрегуляция ИС.
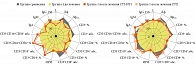
У женщин с ЭГП (группа 1 до лечения), впервые планирующих беременность, установлен дисбаланс субпопуляций лимфоцитов, смещаемый в сторону преобладания киллерных клеток (CD3+CD8+-лимфоцитов) (p < 0,05), необходимых для обеспечения противовирусного иммунитета в острый период, который сохраняется вне периода острых клинических проявлений. В то же время РРИ не приводят к приросту ЕКК. Супрессивная направленность иммунного ответа прослеживается и по отношению к гуморальному иммунитету (IgA, IgM, IgG) – отсутствие повышения сывороточных иммуноглобулинов для осуществления эффекторных функций клетками при элиминации вирусных и бактериальных патогенов (рис. 1).
У женщин с ГП (группа 2 до лечения) вне периода видимых острых клинических проявлений, впервые планирующих беременность, выявлен дисбаланс функционирования клеточного иммунитета за счет незначительного увеличения абсолютного количества CD3+CD19-Т-лимфоцитов, CD3+CD4+Т-лимфоцитов на фоне значимого увеличения количества CD3+CD8+Т-лимфоцитов (p < 0,05) со снижением в 1,3 раза соотношения клеток с хелперной и цитотоксической активностью (ИРИ, p < 0,05), незначительное повышение количества CD3-CD19+В-лимфоцитов и цитотоксических клеток врожденного иммунитета – CD3-CD16+CD56+-лимфоцитов, что свидетельствует об усилении клеточных реакций адаптивного и врожденного иммунитета. При этом имеет место отсутствие ответа сывороточных IgA, IgM, IgG на хронический воспалительный процесс с риском развития недостаточности гуморальной защиты как слизистых, так и более глубоких тканей генитального тракта, не зависящим от этиологии инфекционного процесса (рис. 1).
У женщин с ЭГП и ГП отмечается нарушение эффекторных функций НГ, которое имеет сходные черты и представлено уменьшением содержания активно фагоцитирующих клеток, активацией их поглотительной способности и снижением NADPH-оксидазной активности с истощением резервного микробицидного потенциала. Однако в группе женщин с ГП дополнительно отмечается снижение переваривающей активности. В целом повреждение НГ негативно отражается прежде всего на осуществлении ими как бактерицидной, так и вирусоцидной функции, что создает платформу для поддержания воспаления, возникновения в более ранние сроки как острых, так и обострений хронических ИВЗ и является иммунологическим критерием иммунокомпрометированности женщин с ГП и ЭГП (рис. 2).
При оценке уровня цитокинов установлено увеличение содержания противовоспалительных IL-10 и IL-1RA у женщин с ЭГП и ГП, обладающих иммуносупрессирующим действием. В то же время наблюдается повышенный уровень провоспалительных цитокинов – IL-6 и IL-1β (только при ГП). В обеих группах исследования отмечался дефицит IFNγ (рис. 3).
Выявленные нарушения функционирования ИС создают предпосылки для поддержания вялотекущего воспалительного процесса при кажущемся клиническом улучшении как в генитальном тракте, так и в респираторном тракте и ЛОР-органах и повышают вероятность частых обострений хронических ИВЗ, возникновения РРИ под влиянием различных негативных триггерных факторов. В связи с вышеизложенным обоснована необходимость использования в прегравидарной подготовке иммунотерапии, направленной на устранение дисрегуляции ИС – дефектного функционирования НГ, дефицита IFNγ.
Прегравидарная подготовка женщин с ЭГП и ГП начиналась не менее чем за три месяца до планируемой беременности. При выявлении обострения хронических ИВЗ генитального тракта сначала проводилось адекватное лечение (антибактериальная и противовоспалительная терапия). Лечебно-профилактические мероприятия у женщин с ЭГП включали санацию очагов хронической инфекции респираторного тракта и ЛОР-органов до достижения ремиссии с включением локальной и/или системной антибактериальной терапии. Данное исследование начиналось в период ремиссии хронических инфекционно-воспалительных заболеваний генитального тракта, респираторного тракта и ЛОР-органов и вне острых проявлений ОРВИ. Традиционная терапия состояла из дотации витаминов и микроэлементов (фолаты, йод, полиненасыщенные жирные кислоты, поливитаминно-минеральные комплексы), коррекции вагинального микробиоценоза, дисбиотических нарушений слизистых ротоглотки и кишечника. Данные подходы отражены в клиническом протоколе, разработанном Междисциплинарной ассоциацией специалистов репродуктивной медицины (МАРС) [28].
С целью коррекции дефектного функционирования ИС с доминирующими дефектами НГ и системы ИФН (дефицит IFNγ), а также для сохранения репродуктивного потенциала иммунокомпрометированных женщин с ЭГП и ГП, снижения инфекционного риска, влияющего как на возникновение, течение и исход беременности, так и на развитие внутриутробной инфекции у плода, разработана и проведена интеграционная программа прегравидарной реабилитации иммунной системы (ИППРИС) иммунокомпрометированных женщин с данными патологиями, которая включала дополнительное к традиционной терапии использование таргетной комбинированной интерфероно- и иммунотерапии (таблица).
Установлено, что у женщин с ЭГП после проведения ИППРИС наблюдались снижение абсолютного содержания CD3+Т-лимфоцитов (p < 0,05), CD3+CD4+Т-лимфоцитов (p < 0,05) и повышенного до лечения количества CD3+CD8+Т-лимфоцитов, прирост относительного количества CD3-CD16+CD56+-лимфоцитов (p < 0,05), то есть восстановился баланс между клетками с хелперной и цитотоксической активностью при видимом клиническом улучшении и уменьшении как антигенной нагрузки, так и воспалительной реакции. Однако сохранялся установленный до лечения неадекватный ответ гуморального иммунитета вследствие снижения в 1,5 раза IgA, что предполагает, прежде всего, дефекты мукозального иммунитета и служит критерием риска для более раннего повтора ОРВИ или обострения хронических заболеваний респираторного тракта и ЛОР-органов. Влияние комплексного лечения без включения интерфероно- и иммунотерапии на клеточный и гуморальный иммунитет женщин с ЭГП оказалось менее эффективным (рис. 1).
Положительные эффекты влияния ИППРИС на параметры клеточного и гуморального иммунитета более выражены и у женщин с хроническими ИВЗ генитального тракта: снизилось абсолютное количество CD3+Т-лимфоцитов, CD3+CD4+Т-лимфоцитов, CD3+CD8+Т-лимфоцитов, что положительно сказалось на балансе клеток с хелперной и цитотоксической активностью. Настораживающая до лечения неадекватность гуморального иммунитета на хронический воспалительный процесс к окончанию лечения сгладилась, и определялось значимое повышение уровня сывороточного IgA (p < 0,05), который обеспечивает защиту от проникновения патогенов, в первую очередь через слизистые оболочки (рис. 1).
У женщин с ЭГП в клинически благополучный период вместо ожидаемого повышения фагоцитарной и микробицидной активности НГ ввиду частых ОРВИ и короткого межрецидивного периода хронической патологии отмечалась дефектность НГ, а по окончании иммунотерапии при нормализации процессов поглощения другие дефекты НГ становятся более явными – дефицит ФАН, NADPH-оксидазная активность, но при этом значительно уменьшается вирусная и бактериальная агрессия, поскольку клинически у женщин существенно сокращается частота ОРВИ, обострений хронических заболеваний респираторного тракта и ЛОР-органов (рис. 2).
При проведении только традиционной терапии у женщин с ЭГП активация поглотительной и переваривающей активности НГ свидетельствует об участии НГ в поддержании воспалительного процесса с высоким риском более быстрого развития острых или обострения хронических заболеваний респираторного тракта и ЛОР-органов, что может негативно сказаться на планируемой беременности.
В результате проведения ИППРИС у женщин с ГП наблюдалась реставрация дефектного функционирования НГ с достижением баланса между процессами поглощения и микробицидной активности. Эффект влияния ТТ без иммунотерапии не способствовал восстановлению дефектного функционирования НГ.
Наибольшую эффективность ИППРИС демонстрирует при хронических ИВЗ генитального тракта в отношении эффекторных функций НГ: восстановились резервные возможности, устранился существующий дисбаланс между процессами поглощения и микробицидной активностью НГ. При ЭГП после использования иммунотерапии на фоне позитивных клинических эффектов отмечалось сохранение дисфункций НГ, что свидетельствует о более тяжелом повреждении системы НГ при РРИ, хронических заболеваниях респираторного тракта и ЛОР-органов и необходимости более длительной коррекции выявленных нарушений.
Традиционная прегравидарная подготовка не позволила устранить дисбаланс в системе сывороточных цитокинов, а по ряду цитокинов отмечалась диагностически неблагоприятная динамика – дальнейший рост IL-6, IL-1β, IL-10 при ЭГП, а также IL-1RA и TNFα при ГП и отсутствие восстановления дефицита IFNγ у женщин репродуктивного возраста с ИВЗ различной локализации. При проведении ИППРИС имело место снижение IL-1β и повышение его рецепторного антагониста (IL-1RA) при ГП, а также существенное снижение IL-6, IL-10, при этом уровень IFNγ восстанавливался как при ЭГП, так и при ГП (рис. 3).
Проведенная ИППРИС женщинам с хроническими ИВЗ генитального тракта и с РРИ, хроническими заболеваниями ЛОР-органов способствовала достижению позитивных клинических эффектов. Увеличилась частота наступления беременности в большем проценте случаев у женщин с ЭГП (на 7,7%), чем у женщин с ГП, и при этом беременность наступала в более ранние сроки – в течение трех месяцев после проведения ИППРИС по сравнению с женщинами, получавшими только ТТ. Важно и то, что в группах женщин с ГП и ЭГП после проведения иммунотерапии значительно сократилась частота возникновения самопроизвольных выкидышей – на 30% по сравнению с прегравидарной традиционной терапией, а патология беременности (патологическое предлежание плода, угроза прерывания беременности, гестоз, маловодие, фетоплацентарная недостаточность, ОРВИ) и родов (аномалия родовой деятельности) реже регистрировалась при ЭГП.
У женщин с ЭГП, получавших иммунотерапию, значительно сократилась частота повторных ОРВИ, обострений хронических заболеваний респираторного тракта и ЛОР-органов до момента наступления беременности, что существенно увеличило длительность периода, как между эпизодами ОРВИ, так и между обострениями хронической бактериальной инфекции ЛОР-органов. При этом заболевания протекали более сглаженно с возможным применением преимущественно локальной, реже системной антибактериальной терапии.
У женщин с ГП отмечались положительные клинические эффекты при проведении иммунотерапии в виде уменьшения количества обострений, увеличения длительности безрецидивного периода хронических заболеваний генитального тракта, восстановления репродуктивных функций и иммунного статуса.
У женщин с ГП из 29 возникших беременностей 22 беременности (75,9%) закончились успешным родоразрешением в срок от 38 до 40 недель; с ЭГП беременность возникла у 34 женщин, которая закончилась срочными родами у 23 женщин (67,6%). Все дети родились доношенными. В раннем неонатальном периоде у детей не было выявлено признаков родовой травмы, асфиксии в родах, аспирации, внутриутробного инфицирования или инфицирования в родах. В позднем неонатальном периоде также не выявлялись признаки инфекционно-воспалительной патологии у детей. Таким образом, своевременное планирование беременности с проведением комплекса лечебно-диагностических мероприятий, безусловно, снижает риск рождения ребенка с внутриутробной инфекцией, а также уменьшает число осложнений во время беременности и родов.
Темповые изменения показателей физического развития исследуемых детей на первом году жизни соответствовали среднему физическому развитию детей. Дети в 100% случаев в среднем до 1 года жизни при вскармливании получали грудное молоко, из них 86,7% находились на естественном вскармливании, а 13,3% детей – на смешанном вскармливании.
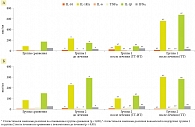
Ретроспективный анализ через три года состояния детей, рожденных от иммунокомпрометированных женщин с ИВЗ различной локализации, включенных в исследование, показал, что у 54,5% детей, рожденных от иммунокомпрометированных матерей с ГП, и у 47,8% детей, рожденных от матерей с ЭГП, отмечался ранний дебют первых эпизодов ОРВИ (3–6 месяцев), а повышение частоты ОРВИ до 10 и более раз в год с одного года. При этом частота возвратных ОРВИ у детей, рожденных от иммунокомпрометированных матерей с ГП и ЭГП, получавших ИППРИС, была меньше, чем у детей, рожденных от матерей, находившихся на традиционной прегравидарной подготовке (на 16,6% при ГП и на 9% при ЭГП у женщин соответственно) (рис. 4).
Сравнительный анализ показал, что у детей, рожденных от матерей с ЭГП, в более ранние сроки возникали первые эпизоды ОРВИ – в 3,5 (2,6; 4,8) месяцев жизни по сравнению с детьми, рожденными от матерей с ГП – 5,4 (4,9; 6,5) месяцев жизни (p < 0,05), что может быть связано, с одной стороны, с контактом с матерью, у которой также в ранние сроки после родов возникали ОРВИ, в том числе осложняющиеся вторичной бактериальной инфекцией респираторного тракта и ЛОР-органов, а с другой – со снижением резистентности ребенка к ОРВИ вследствие нарушения функционирования ИС. У детей, рожденных от матерей с ЭГП, более часто регистрировалась острая бактериальная инфекция респираторного тракта и ЛОР-органов (острый бронхит, острая пневмония, острый средний отит, острый гнойный аденоидит), осложняющие ОРВИ, что пролонгировало заболевания и требовало более частого назначения антибактериальной терапии – до 8–9 курсов в год (p < 0,05).
В целом, проведение ИППРИС иммунокомпрометированным женщинам с ИВЗ различной локализации оказало позитивный эффект на здоровье рожденных ими детей, и у 47,8% детей клинических признаков иммунокомпрометированности в раннем детском возрасте не наблюдалось.
Проведенными исследованиями доказана необходимость и разработан алгоритм стратегии и тактики прегравидарной реабилитации иммунной системы иммунокомпрометированных женщин с ИВЗ различной локализации с включением иммунотерапии, демонстрирующий позитивную клинико-иммунологическую эффективность (рис. 5).
Заключение
Анализ данных современной научной литературы и результатов собственных исследований позволяет сделать заключение о необходимости и иммунопатогенетической обоснованности проведения прегравидарной подготовки женщин с хроническими ИВЗ генитального тракта и женщин с высокой частотой заболеваемости ОРВИ, хроническими заболеваниями респираторного тракта и ЛОР-органов с использованием наряду с традиционной терапией иммунотерапии препаратами таргетного действия (рекомбинантный ИФНα2b в сочетании с антиоксидантами; глюкозаминилмурамилдипептид).
В результате прегравидарной подготовки женщин с хроническими ИВЗ различной локализации получены более выраженные позитивные клинико-иммунологические эффекты в группах женщин, которые получали разработанную ИППРИС. Разработанная программа комбинированной системной интерферонотерапии и иммунотерапии позволяет не только восстановить основные противоинфекционные механизмы врожденного и адаптивного иммунитета при ИВЗ экстрагенитальной и генитальной локализации, но и существенно повысить репродуктивный потенциал иммунокомпрометированных женщин в виде увеличения частоты возникновения беременностей, уменьшения репродуктивных потерь, а также снижения числа осложнений беременности и родов. В настоящем исследовании прослежена связь между неблагополучным инфекционным материнским анамнезом у иммунокомпрометированных матерей с ИВЗ различной локализации и ранним дебютом и большей частотой встречаемости РРИ и вторичного иммунодефицита у детей раннего возраста, родившихся от иммунокомпрометированных матерей, не получавших иммунотерапию в прегравидарной подготовке. Показана клинико-иммунологическая эффективность проведения ИППРИС иммунокомпрометированным женщинам репродуктивного возраста с ИВЗ различной локализации, способствующая реставрации выявленных нарушений ИС, сохранению репродуктивного потенциала женщин и созданию благоприятной платформы с целью профилактики чрезмерной нагрузки инфекционными антигенами и иммунокомпрометированности у рожденных ими детей (у 47,8% детей клинических признаков иммунокомпрометированности в раннем детском возрасте не наблюдалось).
Финансирование.
Исследование выполнено в рамках государственного задания Министерства здравоохранения Российской Федерации № 121031000071-4.
I.V. Nesterova, PhD, Prof., S.V. Kovaleva, PhD, G.A. Chudilova, PhD, L.V. Lomtatidze, PhD, S.N. Pikturno, V.A. Krutova, V.V. Malinovskaya, PhD3
Kuban State Medical University, Krasnodar
People’s Friendship University of Russia, Moscow
National Research Center for Epidemiology and Microbiology named after honorary academician N.F. Gamalei
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
Introduction. Rehabilitation of children with recurrent respiratory infections (RRI) includes clarifying the causes of frequent respiratory morbidity, detailing the maternal history and genetic predisposition, the characteristics of the clinical manifestations of ARVI and verifying the leading diagnosis, including immunocompromised. Despite the successes achieved in the rehabilitation of children with RRI, the need for RRI prevention becomes obvious already at the stage of preconception preparation of their mothers.
Materials and methods. 86 immunocompromised women aged 20–33 were examined clinically and immunologically: with extragenital pathology (EGP) – RRI, chronic diseases of the respiratory tract and ENT organs (n = 42); with genital pathology (GP) – chronic infectious and inflammatory diseases (IVD) of the genital tract (n = 46). The comparison group consisted of 20 conditionally healthy women. A retrospective analysis was carried out with an assessment of the frequency and duration of RRI in 45 children (under 3 years old) born to the observed women.
Results. In immunocompromised women with atypical EGP and GP, dysregulation of the immune system was revealed with dominant disorders in the form of defective functioning of neutrophilic granulocytes (NG), IFNγ deficiency. An integration program for pregravid rehabilitation of the immune system (IPPRIS) of immunocompromised women was developed, which included, in addition to traditional therapy, the use of targeted combined interferon and immunotherapy (recombinant interferon α2b in combination with antioxidants; glucosaminylmuramyldipeptide). IPPRIS demonstrates positive clinical and immunological effects that are superior to those of traditional therapy, and allows not only to restore the main anti-infective mechanisms of innate and adaptive immunity in case of IVD of extragenital and genital localization, but also to significantly increase the reproductive potential of immunocompromised women in the form of an increase in the incidence of pregnancies within 3 months after treatment , reducing reproductive losses by 30%, but also preventing the occurrence of RRI and secondary immunodeficiency in their children.
Conclusion. The administration of IPPRIS to immunocompromised women with various IVDs improved the health of their children, and 47.8% of children did not show clinical signs of immunocompromise (RRI).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.